SARS-CoV-2抗体阴性及抗体阳性患者血清炎症因子表达水平的研究
汤 庆,李 松,钟元锋,李 晨,刘 沛,田学文,刘为勇,孙自镛,李辉军
华中科技大学同济医学院附属同济医院检验科,湖北武汉 430030
新型冠状病毒(SARS-CoV-2)传播迅速,当前国内外防治形势异常严峻[1-3]。机体感染SARS-CoV-2后可引起适应性体液免疫应答,约7 d会产生针对性IgM抗体,约14 d产生IgG抗体[1]。然而,有报道称2.0%~8.5%患者在感染SARS-CoV-2后没有出现SARS-CoV-2抗体[4]。目前国内关于新型冠状病毒肺炎(COVID-19)患者不产生抗体的报道较少,本研究对SARS-CoV-2抗体阴性及抗体阳性患者的炎症因子表达水平进行比较分析,旨在为COVID-19的临床治疗及疫苗研发提供一些参考依据,现报道如下。
1 资料与方法
1.1一般资料 选取2020年1—2月华中科技大学同济医院中法新城院区定点收治住院确诊的COVID-19患者212例为研究对象,按照患者自检出核酸阳性起2周后是否产生SARS-CoV-2抗体将其分为抗体阴性组44例,其中男性22例、女性22例,平均年龄(52.8±17.9)岁;以及抗体阳性组168例,其中男性80例、女性88例,平均年龄(59.4±13.8)岁;抗体阳性组中含SARS-CoV-2 IgM抗体阳性137例,SARS-CoV-2 IgG抗体阳性168例。纳入标准:(1)有流行病学接触史;(2)有发热、咳嗽等症状,实验室检查发现白细胞或淋巴细胞水平降低,胸部CT检查显示病毒性肺炎改变,且按国家卫生健康委员会新型冠状病毒肺炎诊疗方案(试行第八版)[5]临床诊断为COVID-19。排除标准:年龄<18岁,急诊入院诊断不明确或资料缺失。收集患者的年龄、性别、住院天数、临床分型、临床结局、基础性疾病及呼吸辅助情况等一般临床资料进行研究分析。本研究通过华中科技大学同济医学院附属同济医院伦理委员会审核批准。本文属于回顾性研究免除患者知情同意书。
1.2仪器与试剂 SARS-CoV-2 IgM和IgG抗体采用深圳市亚辉龙生物科技股份有限公司iFlash3000 全自动化学发光免疫分析仪进行检测,试剂及定标品为原装配套;全血细胞计数采用日本SYSMEX XN3000全自动生化分析仪进行检测,试剂为其配套试剂。超敏C反应蛋白(hs-CRP)采用德国罗氏COMBAS 8000全自动生化分析仪进行检测,试剂及定标品购自日本生研,乳酸脱氢酶(LDH)采用德国罗氏COMBAS 8000全自动生化分析仪进行检测,试剂及定标品为原装配套。白细胞介素(IL)-1β、IL-2R、IL-8、IL-10、肿瘤坏死因子-α(TNF-α)采用SIEMENSIMMULITE 1000免疫分析仪进行检测,试剂及定标品为原装配套。IL-6采用Roche e602电化学发光法检测仪进行检测,试剂及定标品为原装配套。检测标本均按照实验室标准操作规程进行,保证所有检测系统平稳无故障且待测项目室内质控均为在控状态。
1.3方法
1.3.1标本采集及处理 所有患者均于入院24 h内完成静脉血标本采集,全血细胞计数采用乙二胺四乙酸抗凝剂、hs-CRP采用肝素锂抗凝剂、D-二聚体及纤维蛋白原(FIB)采用枸橼酸钠抗凝剂、细胞因子及SARS-CoV-2 IgM和IgG抗体采用二氧化硅/分离胶的采血管采集。需离心标本采用3 500 r/m离心10 min,不能立即检测的标本暂存于4 ℃冰箱中,需长期保存的血清/血浆标本放置于-70 ℃保存。
1.3.2SARS-CoV-2 IgM和IgG抗体检测 患者于入院当日及择期进行SARS-CoV-2 IgM和IgG抗体检测,保证所有患者在10~<20 d及20~<30 d均能获得抗体数据。IgM 和 IgG 浓度<10.0 AU/mL时,为无反应性(阴性);标本IgM和IgG浓度≥10.0 AU/mL时认为有反应性(阳性)。
1.3.3细胞因子检测 收到标本时立即对细胞因子进行离心上机检测,避免放置较长时间。IL-1β、IL-2R、IL-8、IL-10、IL-6、TNF-α参考范围分别为<5.0 pg/mL、223.0~710.0 U/mL、<62.0 pg/mL、<9.1 pg/mL、<8.1 pg/mL、<7.0 pg/mL。
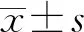
2 结 果
2.1两组临床资料比较 抗体阴性组年龄、住院天数小于抗体阳性组,差异有统计学意义(P<0.05)。见表1。

表1 COVID-19住院患者一般临床资料
2.2两组SARS-CoV-2 IgG、IgM抗体滴度变化 抗体阴性组自检出COVID-19核酸阳性后10~<20 d及20~<30 d血清中均未检测出SARS-CoV-2 IgG、IgM抗体。抗体阳性组自检出COVID-19核酸阳性后10~<20 d及20~<30 d血清中检出SARS-CoV-2 IgG、IgM抗体。抗体阳性组自检出COVID-19核酸阳性后20~<30 d SARS-CoV-2 IgG抗体滴度较自检出COVID-19核酸阳性后10~<20 d升高,而抗体阳性组自检出COVID-19核酸阳性后20~<30 d SARS-CoV-2 IgM抗体滴度较自检出COVID-19核酸阳性后10~<20 d降低。见表2。

表2 两组SARS-CoV-2 IgG、IgM抗体滴度变化[S/CO,M(P25,P75)]

续表2 两组SARS-CoV-2 IgG、IgM抗体滴度变化[S/CO,M(P25,P75)]
2.3抗体阳性组与抗体阴性组患者入院时实验室指标之间的差异分析 抗体阳性组WBC、中性粒细胞计数(NEUT)、单核细胞计数(MONO)、RBC、血小板计数(PLT)、IL-2R、IL-10、TNF-α与抗体阴性组比较,差异均无统计学意义(P>0.05);而抗体阳性组hs-CRP、LDH、IL-1β、IL-6、IL-8、IL-10、D-二聚体及FIB高于抗体阴性组,淋巴细胞计数(LYMPH)、血红蛋白浓度(HGB)及血细胞比容(Hct)低于抗体阴性组,差异有统计学意义(P<0.05)。见表3。

表3 SARS-CoV-2 IgM、IgG抗体阳性组与抗体阴性组患者入院时实验室指标分析
3 讨 论
目前由于缺乏COVID-19有效的治疗药物,该病给全球公共卫生系统带来了巨大挑战[6]。机体细胞免疫和体液免疫在抗病毒感染中起着至关重要的作用[7]。有研究报道,机体在感染SARS-CoV-2 1周后血清中可检测到SARS-CoV-2 IgM抗体,发病2周后上升到峰值,3~4周后开始下降,SARS-CoV-2 IgG抗体转阳的中位数时间为12~14 d[8]。本研究发现抗体阴性组血清中未检测到SARS-CoV-2 IgG抗体、SARS-CoV-2 IgM抗体,与抗体阳性组相比,抗体阴性组年龄较小,且住院天数较短。抗体阴性组患者年龄较小、恢复较快,可能体内存在其他方式的免疫反应,比如细胞免疫,特异性IgA抗体、细胞因子等促进患者恢复[9]。两组临床分型、临床结局、呼吸机辅助通气治疗方面比较,差异无统计学意义(P>0.05),可能是由于收治患者病情偏重,同时患者合并基础疾病较重,如急性脑梗死、急性冠心病、恶性肿瘤等。然而,具体原因还需要后续继续进行更大样本及更深入的研究。
SARS-CoV-2感染后,引起机体免疫应答的同时,也活化了各种细胞信号,导致炎症因子大量释放,引起细胞因子风暴。炎症因子的释放是一种应激反应,一方面有利于病毒清除,然而失控的炎性反应和免疫紊乱会引起多器官免疫病理损伤[10],有研究表明,COVID-19患者可出现细胞因子水平升高,并与疾病严重程度呈正相关[11-12],可能与患者存在免疫失衡及其导致的细胞因子释放综合征(CRS)有关[13]。IL-6 是诱发CRS 的重要因子,可通过上调血管内皮生长因子的表达来破坏血管屏障稳定性,从而刺激单核细胞表达更多的组织因子,加剧外源性凝血系统活化,生成的凝血酶反过来又可诱导血管内皮产生更多的IL-6 及其他细胞因子,这样“细胞因子风暴”与凝血系统紊乱形成了恶性循环[14]。本研究发现抗体阳性组体内血清hs-CRP、LDH、IL-1β、IL-6、IL-8、IL-10、D-二聚体及FIB水平高于抗体阴性组,表明未检测到SARS-CoV-2 IgG、IgM抗体的COVID-19患者体内的炎性反应水平较轻。这类患者感染可能局限于呼吸道黏膜细胞,或者感染的病毒载量较小,抗体反应主要由分泌性免疫系统控制,故引起全身性的炎性反应较小。由于抗体阴性组样本量较少,故本研究中无法在年龄与住院天数进行匹配,关于年龄及住院天数对细胞因子水平是否有影响还需进一步的研究。
综上所述,本研究发现,未检测到SARS-CoV-2 IgG、IgM抗体的COVID-19患者相对于抗体阳性患者其体内炎性反应较轻,病程较短,其为临床治疗及疫苗的研发提供一些参考依据。

