黑木耳蛋白提取工艺优化及其功能特性研究
安兆祥,蔡志鹏,黄占旺,沈勇根,徐 弦,程宏桢,李晓明,刘馥源
(江西农业大学食品科学与工程学院,江西省发展与改革委员会农产品加工与安全控制工程实验室,江西南昌 330045)
黑木耳(Auricularia auricula),又名树鸡、光木耳、木蕊等,木耳科木耳属胶质真菌,在我国主要栽培于黑龙江、四川、广西和云南等地。黑木耳子实体胶质含量较高,质地柔软平滑,味道鲜美[1]。中医学认为,黑木耳具有润肺止咳、滋肾养胃、润燥、补气养血等作用,黑木耳富含蛋白质、矿物质、多糖、维生素、膳食纤维和氨基酸等物质,是我国珍贵的药食兼用真菌[2]。黑木耳蛋白含量为10.0~16.2 g/100 g[3],其蛋白质中含有17种氨基酸,尤以谷氨酸和天门冬氨酸为主[4]。研究表明,黑木耳蛋白具有抗肿瘤[5]功效。
黑木耳因蛋白质含量高、脂肪热量低等特点,已成为获取植物蛋白的新兴资源[1]。依据黑木耳蛋白的凝胶特性,将其添加到半固体食品中,可以改善食品的机械性能;在液体食品中可以提高乳化液的稳定性,还可以降低油-水界面的张力,提高该物质的热稳定性,延长其货架期[4]。目前,提取植物蛋白常规的方法有酶法、超声波法、碱法和复合法等[2]。左莹等[6]采用酶法水解玉米淀粉糖渣蛋白,提取率为39.77%,酶法提取反应条件温和,能耗低,但提取率低,成本高;姚兴存等[7]采用超声波辅助提取条斑紫菜蛋白,提取率为37.6%,超声波法耗能少、时间短,但对仪器设备要求高;李晓明等[8]采用碱法提取白玉菇蛋白,提取率为43.19%,碱法操作简单,成本低,但高碱条件易使蛋白变性。近年来,国内外的研究成果表明,超声辅助酶法的提取技术具有很大的研究前景[9−10]。超声辅助酶法是近年来发展较快的新型提取方法,由于超声波在溶液中迅速产生空化、剪切、剧烈搅拌等作用,同时结合酶高效、专一的特点,能够降解植物细胞壁及组织,提高细胞壁和细胞膜通透性并加速蛋白的溶出[11]。许新月等[12]采用超声辅助酶法提取杏鲍菇蛋白,提取率为75.7%;Hildebrand等[13]使用超声波辅助溶菌酶提取小球藻蛋白,回收率从33%提高至42%,使用超声波辅助蛋白酶提取可促进蛋白质的恢复率(58%~82%)。因此,相比于传统的蛋白提取方法,超声波-酶法具有省时、节能和高效等优点,已广泛应用于生物活性成分等的提取[14−15]。
国内外关于黑木耳蛋白的研究鲜有报道,主要集中在黑木耳碳水化合物的提取和功能性质研究[16−17],且运用超声波-酶法优化黑木耳蛋白提取工艺的研究尚未见报道。本实验拟研究超声波-酶法提取黑木耳蛋白,通过单因素实验,结合Plackett-Burman(PB)试验设计和Box-Behnken试验设计,确定黑木耳蛋白最适提取工艺,并在不同pH下对所得蛋白功能特性进行测定,以期为黑木耳蛋白的提取利用与综合开发提供理论指导。
1 材料与方法
1.1 材料与仪器
黑木耳 市购,产地黑龙江省;菜籽油 市购,产地安徽芜湖金龙鱼工厂;无水乙醇 天津市大茂化学试剂厂;牛血清蛋白(BSA) 上海源叶生物科技有限公司;碱性蛋白酶(15万U/g,最适作用温度65 ℃、pH8.5) 河南万邦实业有限公司;考马斯亮蓝G-250上海强顺化学试剂有限公司;硫酸铜、硫酸钾、硼酸、磷酸均为分析纯。
K-355凯氏定氮仪 瑞士步琪有限公司;SB-3200DTD超声波清洗仪 宁波新芝生物科技股份有限公司;WFJ 2100可见分光光度计 尤尼科(上海)科学仪器有限公司;Q500B高速多功能粉碎机 上海冰都电器有限公司;SF-GL-20高速冷冻离心机上海菲恰尔分析仪器有限公司;T-25 basic高速分散机 艾卡(广州)仪器设备有限公司;BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;便携式pH计 上海大普仪器有限公司;BYXX-50烘箱杭州艾博科技工程有限公司;Scientz-10N冷冻干燥机 宁波新芝生物科技股份有限公司;
1.2 实验方法
1.2.1 样品预处理 挑选无霉烂虫蛀、无机械损伤的黑木耳清洗除杂,于烘箱60 ℃烘干4 h,冷却后粉碎,过100目筛,得到黑木耳粉,置于干燥环境下保存,备用。
1.2.2 黑木耳蛋白提取工艺流程 黑木耳粉→称量→溶解→超声处理→调pH→酶解→灭酶→离心分离→取上清液(蛋白提取液)→测蛋白含量→等电点沉淀→离心分离→沉淀水洗至中性→真空冷冻干燥→黑木耳蛋白。
1.2.3 操作要点 黑木耳按1.2.1方法预处理,称取一定量的木耳粉末,按料液比1:80(g/mL)进行溶解,然后在超声功率180 W,50 ℃超声30 min,之后用0.1 mol/L NaOH溶液调溶液pH为10.5,再添加5%的碱性蛋白酶,40 ℃水浴加热酶解2 h,90 ℃灭酶15 min,10000 r/min离心15 min,收集上清液,得到蛋白提取液,用0.1 mol/L HCl溶液调pH至3.5,于4 ℃冰箱中冷沉24 h后,12000 r/min离心15 min,收集沉淀,水洗至中性,真空冷冻干燥,得黑木耳蛋白。
1.2.4 单因素实验 在超声波-酶法提取黑木耳蛋白工艺中,首先对木耳粉进行超声波预处理,处理结束后进入酶解反应,研究各参数对蛋白提取率的影响。以蛋白提取率为指标,分别考察料液比(1:50、1:60、1:70、1:80、1:90、1:100 g/mL)、超声时间(10、20、30、40、50、60 min)、超声温度(30、40、50、60、70、80 ℃)、酶添加量(1.0%、2.0%、3.0%、4.0%、5.0%、6.0%)、酶解pH(8.0、8.5、9.0、9.5、10.0、10.5)、酶解温度(45、50、55、60、65、70 ℃)、酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)共计7个因素对黑木耳蛋白提取率的影响。每个水平重复3次,取均值,试验过程中固定超声功率为180 W,不变水平值为:超声时间30 min、超声温度50 ℃、酶解pH为10.5、料液比1:80(g/mL)、酶解时间2 h、酶添加量5%、酶解温度40 ℃。
1.2.5 Plackett-Burman(PB)试验设计 PB设计中,将1.2.4中7个单因素依次编码为X1、X2、X3、X4、X5、X6和X7。对于每个因素,均设定高(+)、低(−)2个水平,以蛋白提取率(Y)为响应值,X1~X7影响因素为自变量,共进行12次试验。因素和水平如下表1。
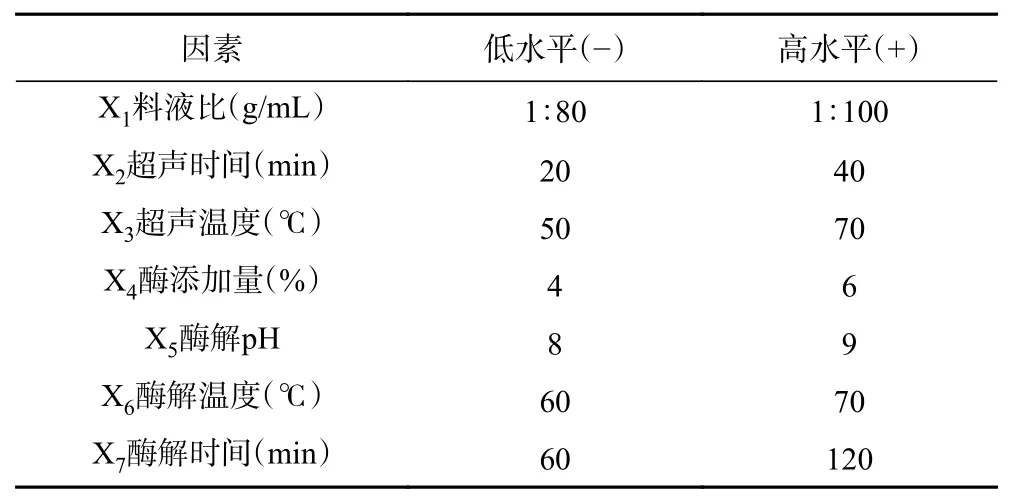
表 1 PB试验设计因素与水平Table 1 PB experiment design factors and levels
1.2.6 Box-Behnken试验设计 根据PB试验结果,选取料液比(A)、超声时间(B)、酶解pH(C)和酶解温度(D)作为Box-Behnken试验设计(见表2)的4个自变量,建立响应值与自变量之间的函数关系,进而寻求黑木耳蛋白提取工艺的最优组合。

表 2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken experiment design
1.2.7 黑木耳蛋白提取率的计算
1.2.7.1 黑木耳总蛋白含量的测定 参照GB 5009.5-2016《食品中蛋白质的测定》[18]凯氏定氮法,测得黑木耳粉末中总蛋白含量为(11.38±0.25)g/100 g。
1.2.7.2 黑木耳提取液中蛋白含量的测定 首先配制不同质量浓度的牛血清蛋白标准溶液,采用考马斯亮蓝法[19]测定595 nm处的吸光度值,并做空白对照,分别以蛋白含量与吸光度值为横纵坐标,绘制牛血清蛋白标准曲线:y=4.6925x+0.0808(R2=0.9992)。另外,取黑木耳蛋白提取液,按照上述方法,测定上清液蛋白含量。
按照式(1)计算黑木耳蛋白提取率:

1.2.8 黑木耳蛋白等电点(pI)的测定 称取6.0 g木耳粉于500 mL烧杯中,加入480 mL的蒸馏水,搅拌溶解,用0.1 mol/L NaOH溶液调pH至9.0,40 ℃水浴加热提取2 h后,8000 r/min离心30 min,取上清液20 mL分装于50 mL烧杯中,用HCl调pH分别为2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0,重复试验3次,于4 ℃冰箱中冷沉24 h后,12000 r/min离心15 min,取上清液于595 nm处测定吸光值,吸光值最低时的pH即为黑木耳蛋白等电点。
1.2.9 黑木耳蛋白功能特性的测定
1.2.9.1 起泡性及泡沫稳定性的测定 参照张思思等[20]的方法并做调整。配制浓度为2%的样品40 mL,调节不同pH为2.0、3.5、5.0、6.5、8.0、9.5,快速分散2 min(9500 r/min),倒出分散液,及时读取均质停止时泡沫体积以及均质停止30 min后的泡沫体积。计算公式如下。

1.2.9.2 溶解性的测定 参照李晓明等[8]的方法并做调整。称量一定质量的蛋白样品,配制质量浓度为10 g/L,分别量取20 mL待测样液,调节不同pH为2.0、3.5、5.0、6.5、8.0、9.0,使之充分溶解,室温条件下搅拌45 min,4000 r/min离心20 min,沉淀不溶蛋白,采用考马斯亮蓝法测定上清液中蛋白含量。计算公式如下。

1.2.9.3 乳化性及乳化稳定性的测定 参照薛蕾等[21]的方法并做调整。配制1%蛋白溶液,量取25 mL样品于烧杯中,调节不同pH为2.0、3.5、5.0、6.5、8.0、9.5,加入相同比例的菜籽油,快速分散2 min(9500 r/min),快速移取25 mL乳化液离心15 min(2500 r/min),将离心管取出立于水平桌面迅速读取乳化层高度及液体总高度。再将上述乳化液80 ℃水浴30 min,用自来水冷却至室温,离心15 min(2500 r/min),取出读取并记录剩余乳化层高度。计算公式如下。

1.2.9.4 持水性的测定 参照杨希娟等[22]的方法并做调整。先对25 mL离心管进行称重,再称取0.5 g黑木耳蛋白样品于离心管中,加入10 mL蒸馏水配成蛋白待测液,调节不同pH为2.0、3.5、5.0、6.5、8.0、9.5,振荡、混匀,常温下静置30 min,使之充分吸水,3000 r/min离心20 min,除去上层水液,称取离心管和残留物总质量。计算公式如下。

1.2.9.5 吸油性的测定 参照张艳荣等[23]的方法并做调整。先对10 mL的离心管进行称重,再称取0.5 g黑木耳蛋白样品于离心管中,随后加入10 mL菜籽油,调节不同pH为2.0、3.5、5.0、6.5、8.0、9.5,振荡、混匀,静置30 min,3000 r/min离心20 min,除去上层油液,称取离心管和残留物总质量。计算公式如下。

1.3 数据处理
使用Design expert 11.0进行PB试验和Box-Behnken试验设计及响应面试验数据优化,试验重复3次,通过SPSS 20.0进行数据分析,采用新复极差法(Duncan’s)进行显著性分析(P<0.05表示有显著差异,P<0.01表示有极显著差异),Origin 2018.0进行绘图处理。
2 结果与分析
2.1 单因素实验结果
探究各因素对黑木耳蛋白提取率的影响,如图1所示。
从图1A可以看出,随料液比的增大黑木耳蛋白的提取率呈先上升后下降的趋势。当料液比为1:90(g/mL)时,蛋白提取率最大。这是因为随溶液体积增大,木耳粉在溶液中的分散度和接触面积随之增大,加速蛋白的溶出,提取液用量继续增加,超声破碎不充分[2],蛋白提取率下降显著(P<0.05)。故选取料液比1:90(g/mL)进行下一步优化。
图1 B显示,黑木耳蛋白提取率随超声时间的延长呈先上升后下降的趋势,在30 min破碎效果达到最佳(P<0.05)。原因可能是超声波所产生的机械效应和空化效应大大加强了细胞破碎程度,显著增大了蛋白溶出速率。30 min后,蛋白提取率开始下降,可能是破碎时间过长,细胞内降解蛋白的酶溶出,破坏了蛋白的结构,机器产生大量热使蛋白质降解和变性[24]。所以选取超声时间为30 min进行下一步优化。
由图1C可以看出,黑木耳蛋白提取率随超声温度的升高呈先上升后下降的趋势,蛋白提取率在超声温度达到60 ℃时最高,超声温度继续升高,蛋白提取率下降显著(P<0.05)。原因可能是超声温度和超声过程中产生的热效应共同作用使溶液体系温度过高,引起物料糊化和蛋白质变性[25],提取率下降明显。所以选取超声温度为60 ℃进行下一步优化。
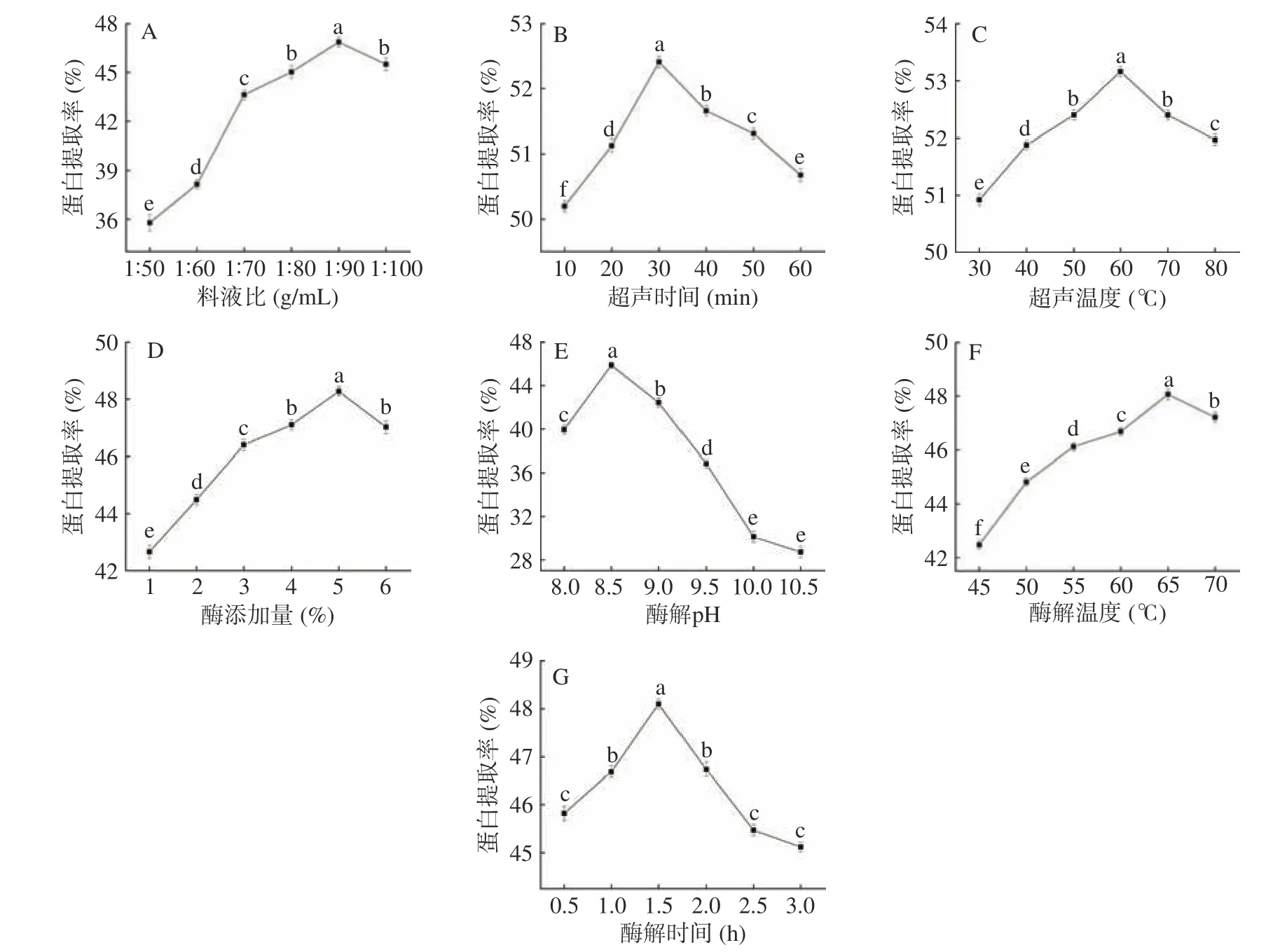
图 1 各因素对黑木耳蛋白提取率的影响Fig.1 Effects of various factors on the extraction rate of Auricularia auriculata protein
图1 D中,黑木耳蛋白提取率随酶添加量的增加逐渐升高,当酶添加量达到5%时,蛋白提取效果最好(P<0.05),然而当酶添加量大于5%时,蛋白提取率开始缓慢下降。原因可能是酶在适宜浓度范围内,伴随酶添加量的增大,酶加速细胞壁的降解,使原料中的蛋白更易溶出。当酶溶度达到饱和时,由于所有底物均已和酶形成中间产物继续提高酶的浓度,反而会使酶促反应降低,且酶本身具有竞争性抑制作用,故当酶添加量超过一定范围时,黑木耳蛋白提取率反而会降低[26]。所以选取酶添加量为5%进行下一步优化。
由图1E所示,黑木耳蛋白提取率随酶解pH的增大迅速升高,当pH到达8.5时酶的破壁效果最好,蛋白提取率最高,pH继续增大,蛋白提取率下降显著(P<0.05)。由此可知,黑木耳蛋白提取率随pH的增大而明显升高,表明碱性pH能够疏松蛋白结构,提高蛋白溶解性,但碱性过强则会致使蛋白变性,从而破坏蛋白品质[25]。故选取酶解pH为8.5进行下一步优化。
由图1F可知,黑木耳蛋白提取率随酶解温度的升高呈先上升后下降趋势。酶活性在温度为65 ℃时,达到最大值,蛋白溶出速率也达到最大。温度继续升高,酶活性遭到破坏,破壁效果显著下降(P<0.05),蛋白提取率也随之降低[27]。所以选取提取酶解温度65 ℃进行下一步优化。
图1 G显示,黑木耳蛋白提取率随酶解时间的延长,呈现先上升后下降的趋势。当反应时间为1.5 h时,蛋白提取率最大,此后,延长酶解时间提取率下降显著(P<0.05),原因可能是底物随酶解时间的延长而不断减少,酶解产物的积累抑制了酶的活力,同时部分溶出蛋白被水解,导致蛋白提取率下降[28]。故选取酶解时间为1.5 h进行下一步优化。
2.2 PB试验设计结果
根据表3试验结果,利用Design-Expert 11.0软件进行多元回归方程拟合和方差分析,得到以黑木耳蛋白提取率为响应值的最优回归方程为:Y=131.42842−0.230957X1+0.236742X2+0.111009X3+0.497741X4−5.37870X5−0.690105X6+4.26641X7。
根据表4方差分析结果可知,该模型差异极显著(P<0.01),R2=0.9713,即有97.13%的试验数据可用该模型解释。对黑木耳蛋白提取率的影响极显著(P<0.01)的因素依次为X6>X5,影响显著(P<0.05)的因素依次为X2>X1>X7,X3、X4影响不显著(P>0.05)。因此,选取酶解温度、酶解pH、超声时间和料液比4个因素进行Box-Behnken试验。

表 3 PB试验设计方案及结果Table 3 Design scheme and results of PB experiment
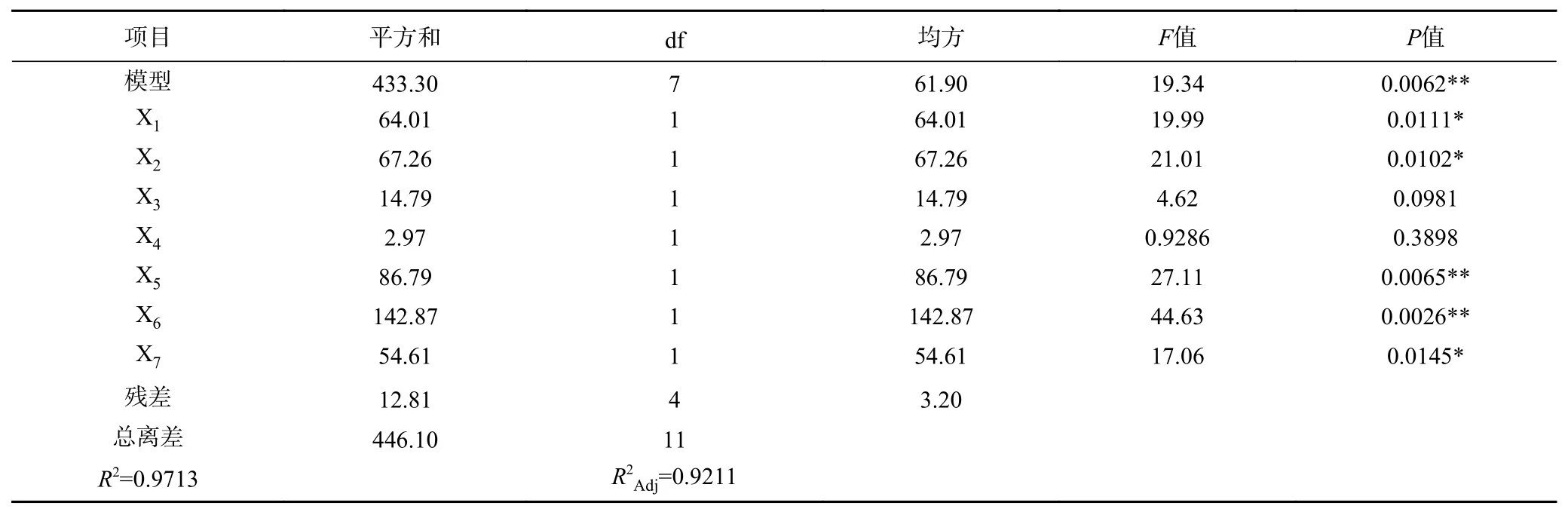
表 4 PB试验设计方差分析结果Table 4 Analysis of variance results of PB experiment design
2.3 Box-Behnken试验设计结果
根据Box-Benhnken中心组合试验设计原理[24],综合单因素实验和PB试验结果,以黑木耳蛋白质提取率作为响应值,考察料液比、超声时间、酶解pH和酶解温度4个因素对于结果的影响,以得出最优试验条件。Box-Behnken试验方案与结果见表5,方差分析结果见表6。
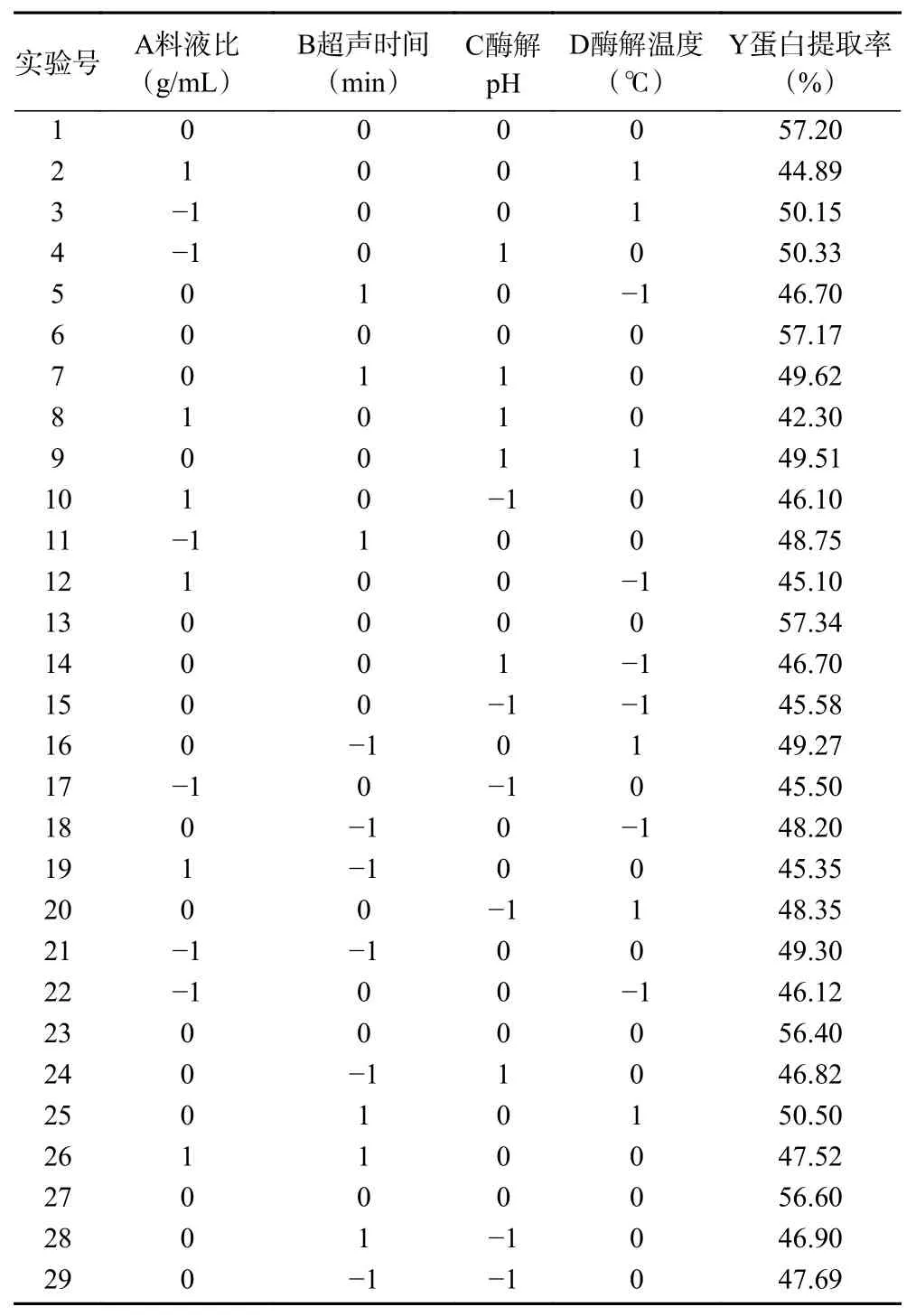
表 5 Box-Behnken试验设计方案及结果Table 5 Design scheme and results of Box-Behnken experiment
对表5中的数据,采用响应面方法分析试验结果,得到黑木耳蛋白提取率(Y)的二次回归方程为:Y=56.94−1.57A+0.28B+0.43C+1.19D+0.68AB−2.16AC−1.06AD+0.8975BC+0.6825BD+0.01CD−5.68A2−3.78B2−5.18C2−4.47D2。
由表6可知,该模型差异极显著(P<0.01),决定系数R2为0.9926,说明模型拟合程度良好,能较好地拟合试验结果。失拟项不显著(P>0.05),说明模型误差较小,校正决定系数R2Adj为0.9851,说明模型的相关性和解释度都很好,可以用此模型进行理论分析和预测。模型一次项A、D,交互项AC、AD、BC,二次项A2、B2、C2、D2对黑木耳蛋白提取率的影响极显著(P<0.01),一次项C,交互项AB、BD影响显著(P<0.05)。4个影响因素中,对黑木耳蛋白质提取率影响最大的为料液比,其次为酶解温度和酶解pH,影响最小的为超声时间。
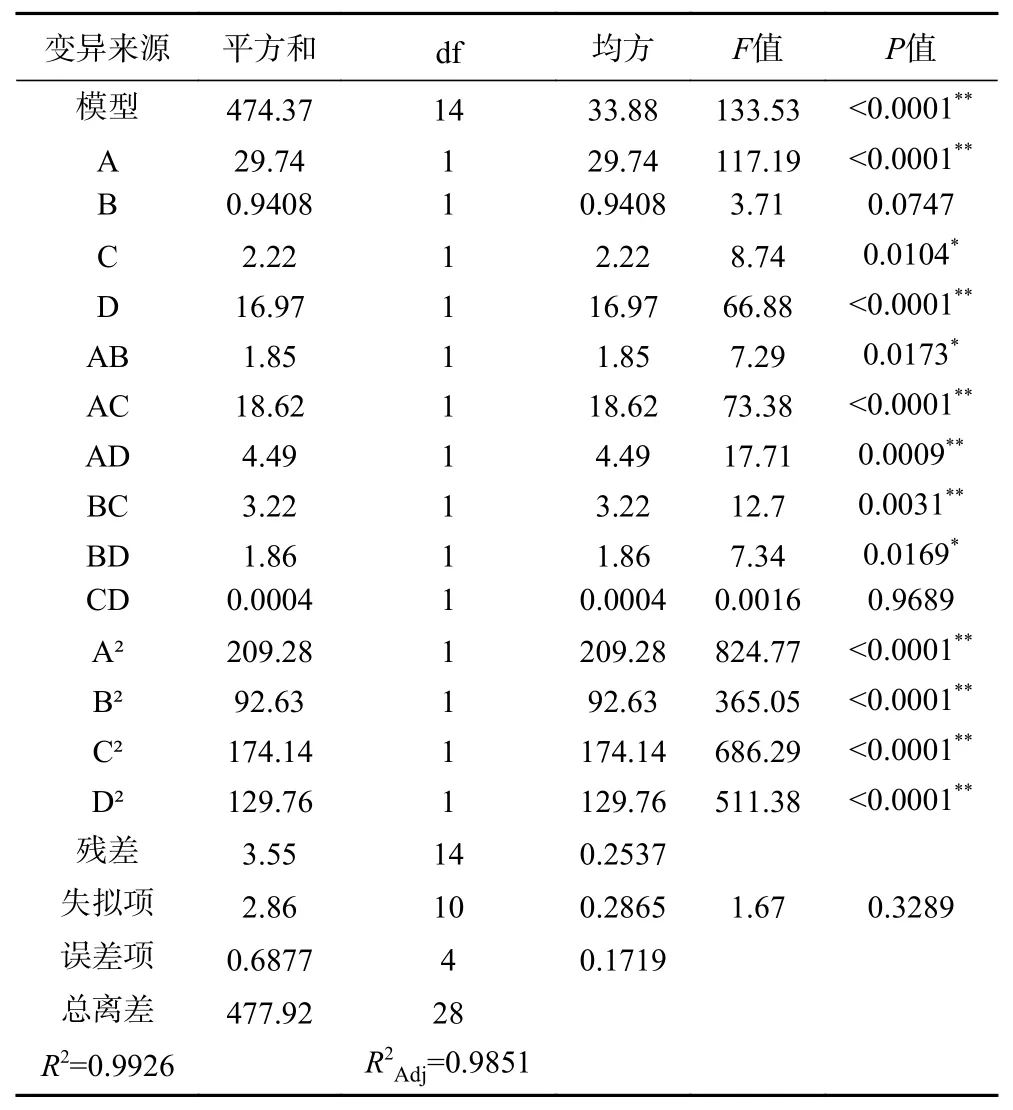
表 6 Box-Behnken试验方差分析结果Table 6 Variance analysis results of Box-Behnken experiment
2.4 各因素之间交互作用和响应面分析
由Design-Expert 11.0软件对试验结果进行响应面图的绘制,通过3D响应面图能直观地反映出各因素及因素之间的交互作用对黑木耳蛋白提取率的影响[29]。响应面分析结果见图2。
由图2a、图2e可以看出,AB、BD响应面曲面较陡峭,料液比和酶解温度的变化曲线比超声时间的变化曲线陡峭,说明料液比和酶解温度比超声时间的影响都更显著一些;由图2b、图2c、图2d可知,AC、AD、BC响应面曲线陡峭,根据曲面的陡峭程度,可得出料液比和酶解温度的交互作用对蛋白提取率的影响最大,料液比和酶解pH次之,超声时间和酶解pH两者相差不大且影响较小;由图2f可知,CD响应面曲面相对平缓,两者交互作用对蛋白提取率的影响不显著,与方差分析结果一致。
2.5 最佳工艺条件的确定及验证实验
Design-Expert 11.0软件对试验的优化结果为料液比1:88.34(g/mL)、超声时间30.45 min、酶解pH8.54、酶解温度65.78 ℃,该条件下的蛋白提取率预测值为57.19%。采用优化后的参数进行验证实验,为方便操作,条件参数设为料液比1:88(g/mL)、超声时间30.5 min、酶解pH8.5、酶解温度65.8 ℃,该条件下重复试验3次,测得黑木耳蛋白质平均提取率为57.11%±0.12%,与模型预测值57.19%无明显差异,说明该模型优化得到的黑木耳蛋白提取工艺参数可靠。
2.6 黑木耳蛋白等电点
探究黑木耳蛋白等电点,如图3所示。

图 2 各因素交互作用对黑木耳蛋白提取率影响的响应面图Fig.2 Response surface plots showing the interaction effects of various factors on the extraction rate of Auricularia auriculata protein
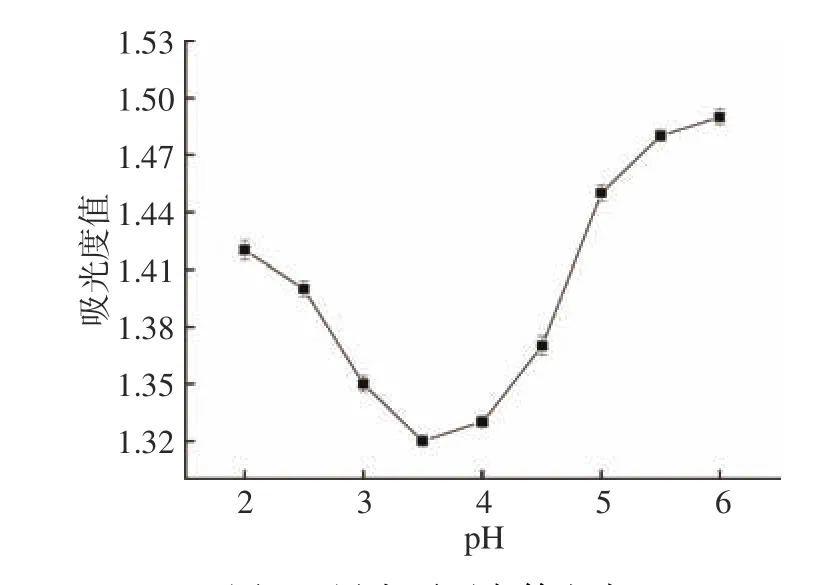
图 3 黑木耳蛋白等电点Fig.3 Isoelectric point of Auricularia auricular protein
由图3可知,随着溶液pH的增大,蛋白吸光度值呈先下降后上升趋势,当pH为3.5时,蛋白吸光度值达到最低值,此时蛋白正、负电荷数相等,净电荷为零,这可能是因为蛋白-水间相互作用和蛋白-蛋白间静电排斥作用均降低,从而引发了蛋白聚合沉淀[30]。即pH3.5为黑木耳蛋白的等电点。
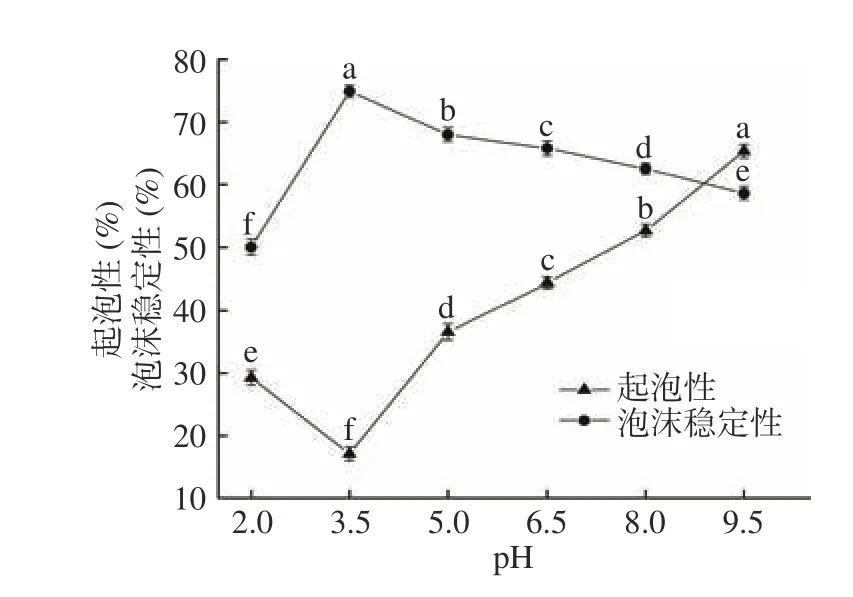
图 4 pH对黑木耳蛋白起泡性性及泡沫稳定性的影响Fig.4 Effect of pH on the foaming capacity and foam stability of Auricularia auricular protein
2.7 黑木耳蛋白的功能特性
2.7.1 pH对黑木耳蛋白起泡性与泡沫稳定性的影响
蛋白起泡性是指蛋白样品在高速搅打过程中通过降低水的表面张力,并扑捉气体最终形成泡沫的能力;保持蛋白泡沫产生后的稳定能力即蛋白的泡沫稳定性[31]。由于蛋白起泡性与蛋白溶解性有很大的关系,较高的溶解性、表面膜的强度和表面粘度、分子柔性、亲水性基团能够增强蛋白分子与空气的交互作用,故而对起泡能力产生一定的影响。
图4 显示,黑木耳蛋白起泡性随pH的增大先下降后上升,而泡沫稳定性正好相反。当pH为3.5时,黑木耳蛋白的起泡性最差(17.10%),泡沫稳定性最好(74.90%),随pH的不断增大,起泡性和泡沫稳定性呈相反趋势逐渐靠近,当pH达到9.5时,黑木耳蛋白的起泡性(65.34%)高于其泡沫稳定性(58.60%)。这可能是因为当pH在蛋白等电点附近时,蛋白容易聚集沉淀,参与形成泡沫的蛋白质量浓度较低,使其起泡能力最弱,起泡性最差,此时,由于溶液中不溶性颗粒通过静电作用不断吸附于气-液界面,从而增大蛋白膜的黏性和厚度,泡沫稳定性随之增加[21]。
2.7.2 pH对黑木耳蛋白溶解性的影响 可溶性蛋白在吸水后分散成胶体的性质即为蛋白溶解性[21]。不同pH下蛋白溶解性又有很大差异,蛋白的溶解性对其在食品工业中的稳定性、风味等有直接的影响。
从图5可以看出,蛋白溶解性随pH逐渐增大呈先下降后上升的U形线。当pH为3.5时蛋白溶解性最低(10.72%),归因于在等电点附近蛋白发生聚集沉淀,容易析出;当溶液体系pH大于或小于3.5时,黑木耳蛋白-蛋白以及蛋白-水分子之间相互作用增强,凝聚力下降,促进溶解,蛋白溶解性随溶液酸性或碱性的增强不断增大。
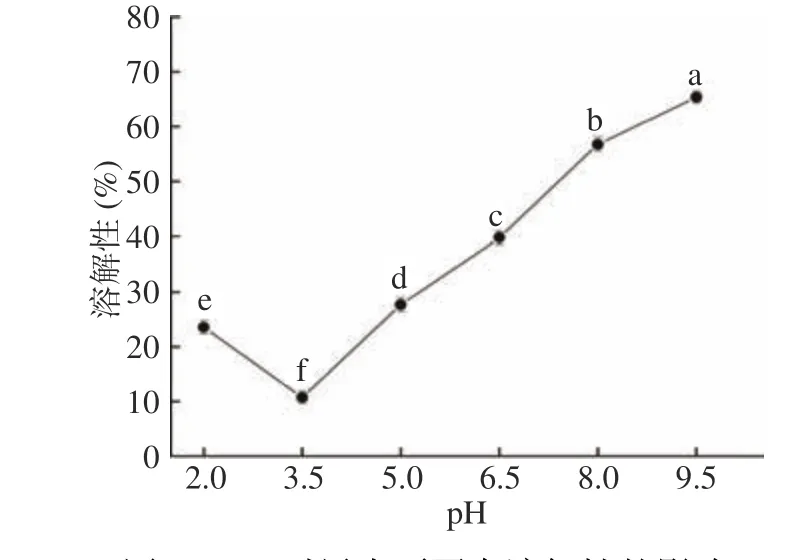
图 5 pH对黑木耳蛋白溶解性的影响Fig.5 Effect of pH on the solubility of Auricularia auricular protein
2.7.3 pH对黑木耳蛋白乳化性及乳化稳定性的影响
在高速搅拌下,蛋白使油被均匀分散在水中形成乳状液的能力叫蛋白乳化性;维持蛋白乳化液稳定且不出现油水两项明显分离的能力即蛋白乳化稳定性,溶液pH、离子浓度、温度和蛋白质浓度都对蛋白乳化性及乳化稳定性有不同程度的影响。
从图6可知,黑木耳蛋白的乳化性和乳化稳定性都随pH的增大呈先下降后上升的趋势。这是由于当pH为3.5时即黑木耳蛋白的等电点,此时净电荷为零,蛋白之间静电排斥力最小,蛋白溶解性最低,乳化性(20.56%)和乳化稳定性(54.56%)的能力都最小;但当pH在远离蛋白的pI时,黑木耳蛋白乳化性和乳化稳定性呈相同趋势增强,前者较后者增幅更明显,由于黑木耳蛋白与水分子之间相互作用增强,溶于体系溶液的能力增强,静电斥力增大,油/水界面的吸附能力增强,界面张力降低,蛋白乳化性和乳化稳定性都随之增强[32]。
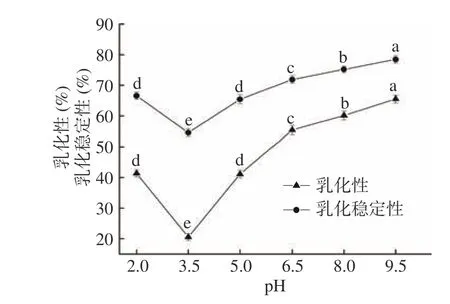
图 6 pH对黑木耳蛋白乳化性及乳化稳定性的影响Fig.6 Effect of pH on the emulsifying property and emulsifying stability of Auricularia auricular protein
2.7.4 pH对黑木耳蛋白持水性的影响 蛋白中亲水性基团与水结合即吸附水的能力为蛋白持水性,溶液体系的pH和温度对蛋白的持水性有一定的影响;良好的持水性有助于食品贮藏过程中的“保鲜”和“成型”,保持食品足够的水分,从而降低水分损失,防止食品收缩[32]。
图7 可见,黑木耳蛋白的持水性随pH的增大呈先下降后上升的趋势。pH在蛋白等电点3.5时,持水性(2.7 g/g)最小,这是因为处于等电点时的蛋白总电荷为零,分子间相互作用最大,缔合和收缩的蛋白质呈现最低的水化和膨胀[21];而当pH远离等电点时,蛋白以离子形式存在,使蛋白溶胀性能和黏度增加,持水性增强。
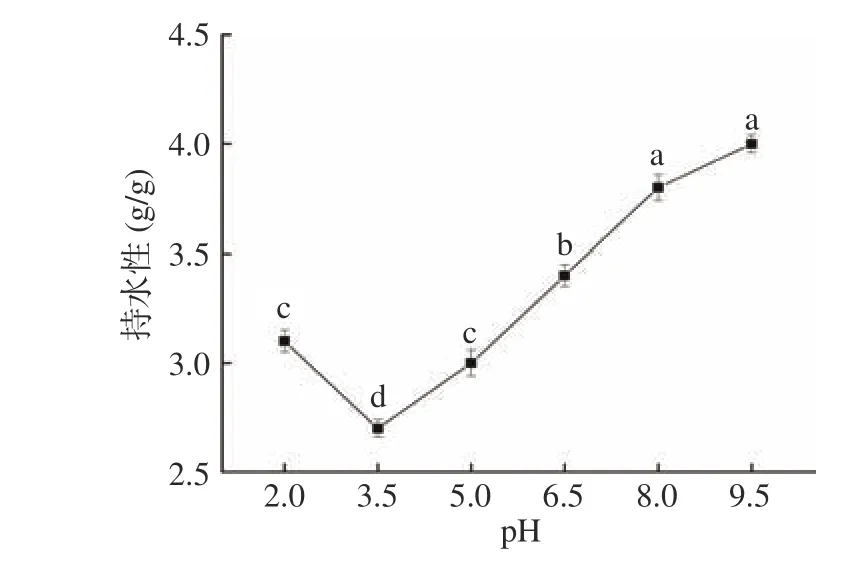
图 7 pH对黑木耳蛋白持水性的影响Fig.7 Effect of pH on the water holding capacity of Auricularia auricular protein
2.7.5 pH对黑木耳蛋白吸油性的影响 蛋白的吸油性是指在一定条件下,蛋白与油脂按一定比例混合后吸附油脂的能力。影响蛋白吸油性的因素有很多,如:蛋白种类、温度及油品,同时蛋白良好的吸油性在肉制品的加工生产中起着很重要的作用。
由图8可知,黑木耳蛋白的吸油性随pH的增大呈先下降后上升并趋于平缓的趋势。当pH为3.5时蛋白吸油性最小(2.38 g/g),pH继续升高,蛋白吸油性上升显著(P<0.05),当pH为9.5时达到最大值(2.90 g/g),原因可能是当pH在蛋白等电点附近时,蛋白容易聚集沉淀,吸油性最小;随pH升高,蛋白分子发生伸展、解离,内部非极性键暴露且油脂结合能力增大。pH继续升高,部分蛋白发生变性,结构发生改变,分子间的相互作用减小,吸附能力减弱[33]。

图 8 pH对黑木耳蛋白吸油性的影响Fig.8 Effect of pH on the oil absorption capacity of Auricularia auricular protein
3 结论与讨论
各因素对蛋白提取率影响的主次顺序为料液比>酶解温度>酶解pH>超声时间;最适提取工艺参数为料液比1:88(g/mL)、超声时间30.5 min、酶解pH8.5、酶解温度65.8 ℃,获得的理论值为57.19%,该条件下,经验证实际值为57.11%±0.12%,证明该模型准确可靠。张莉等[1]采用碱溶酸沉法提取黑木耳蛋白,提取率为64.8%;林洋[34]采用超声辅助碱法提取黑木耳蛋白,提取率为48.3%;与之相比,采用超声波-酶法提取黑木耳蛋白,提取率居中,由于实验条件限制,未能探究超声功率高于180 W以后对黑木耳蛋白提取率的影响,但依据结果可以认为超声波-酶法是一种有效的蛋白提取方法。
pH对黑木耳蛋白功能特性的影响显著。pH3.5时蛋白泡沫稳定性最好,达到74.90%;随pH增大(3.5~9.5),溶解性、起泡性、乳化性、乳化稳定性、持水性和吸油性显著提高(P<0.05),泡沫稳定性显著下降(P<0.05)。在适宜的pH条件下,黑木耳蛋白具有较好的溶解性、乳化性、乳化稳定性、泡沫稳定性,可将其添加至饮料、蛋糕、汤料等食品中。
后期实验可从以下几方面展开:探究黑木耳蛋白功能特性与温度、离子强度、蛋白质量浓度的关系和影响规律;通过脱色、超滤、离子交换色谱等技术分离纯化蛋白,以获得更高纯度的蛋白,进行其结构鉴定、理化性质研究;进一步研究黑木耳蛋白的抗氧化活性、功能性产品的开发等。本研究结果为今后黑木耳蛋白的提取工艺以及在食品加工中的应用提供了相应的实验支撑,同时也为黑木耳的精深加工提供新的思路,尽而有效的提升黑木耳的附加值。

