酒仙茅的微波炮制工艺建立及与传统炮制法的比较
李媛媛 王巍 鞠成国 贾天柱


中圖分类号 R283 文献标志码 A 文章编号 1001-0408(2021)18-2223-07
DOI 10.6039/j.issn.1001-0408.2021.18.08
摘 要 目的:建立酒仙茅的微波炮制工艺,并与传统炮制法进行比较。方法:采用高效液相色谱法测定酒仙茅中仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷的含量;在单因素实验的基础上,以加酒量、微波功率、闷润时间、微波时间为考察因素,以仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷及醇溶性浸出物含量为考察指标,采用正交实验结合综合加权评分法优化微波炮制的工艺并验证,同时比较生仙茅饮片和炮制品的含量。结果:最优微波炮制工艺为加酒量20%(生仙茅饮片质量的20%),微波功率300 W,闷润时间3 h,微波时间2 min。经3次实验验证,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷及醇溶性浸出物的平均含量分别0.095 6%、0.723 9%、0.406 6%、10.115 3%,RSD分别为0.71%、0.54%、0.99%、1.44%(n=3);平均综合评分为99.08分,RSD为0.69%(n=3)。除传统酒炙品中醇溶性浸出物含量外,传统酒炙品和微波炮制品中仙茅苷、苔黑酚龙胆二糖苷含量及微波炮制品中醇溶性浸出物含量均显著高于生仙茅饮片,且微波炮制品中仙茅苷、苔黑酚龙胆二糖苷含量均显著高于传统酒炙品(P<0.05);两种炮制品中苔黑酚葡萄糖苷均显著低于生仙茅饮片,但微波炮制品显著高于传统酒炙品(P<0.05)。结论:优化所得微波炮制工艺稳定、可行,可用于酒仙茅的炮制。
关键词 酒仙茅;微波炮制;高效液相色谱法;正交实验;含量测定
Establishment of the Microwave Processing Technology of Yellow Wine-processed Curculigo orchioides and Comparison with Traditional Technology
LI Yuanyuan,WANG Wei,JU Chengguo,JIA Tianzhu(College of Pharmacy, Liaoning University of TCM, Liaoning Dalian 116600, China)
ABSTRACT OBJECTIVE: To establish the microwave processing technology of yellow wine-processed Curculigo orchioides, and compare it with traditional technology. METHODS: HPLC method was adopted to determine the contents of curculigoside, orcinol glucoside and orcinol gentiobioside in C. orchioides. Based on the single factor tests, microwave processing technology was optimized and validated with orthogonal test combined with comprehensive weighted scoring method, with the amount of yellow wine,microwave power,wetting time and microwave time as factors, using the contents of curculigoside, orcinol glucoside, orcinol gentiobioside and ethanol soluble extract as the indexes. The contents of C. orchioides decoction pieces and processed products were compared. RESULTS: The optimal microwave processing technology included that the amount of yellow wine was 20% (the weight of C. orchioides decoction pieces was 20%), microwave power was 300 W,wetting time was 3 h, microwave time was 2 min. After 3 times of validation tests, average contents of curculigoside, orcinol glucoside, orcinol gentiobioside and ethanol soluble extract were 0.095 6%, 0.723 9%, 0.406 6%, 10.115 3%, and RSD were 0.71%, 0.54%, 0.99%, 1.44% (n=3). Average comprehensive score were 99.08 (RSD=0.69%, n=3). Except for the content of ethanol soluble extract in traditional wine-processed product, the contents of curculigoside and orcinol gentiobioside in traditional wine-processed product and microwave processed product as well as the content of ethanol soluble extract in microwave processed product were all significantly higher than C. orchioides decoction pieces; the contents of curculigoside and orcinol gentiobioside in microwave processed product were both significantly higher than traditional wine-processed product (P<0.05). The contents of orcinol glucoside in 2 processed product were significantly lower than C. orchioides decoction pieces, while the microwave processed product was significantly higher than traditional wine-processed product (P<0.05). CONCLUSIONS: Optimized microwave processing technology is stable and feasible, and can be used for the processing of yellow wine-processed C. orchioides.
KEYWORDS Yellow wine-processed Curculigo orchioides; Microwave processing technology; HPLC; Orthogonal test; Content determination
仙茅始载于《雷公炮炙论》,为石蒜科植物仙茅Curculigo orchioides Gaertn.的干燥根茎[1],其性热、味辛,有毒,具有补肾阳、强筋骨、去寒湿的功效,可用于阳痿精冷、筋骨痿软、腰膝冷痛、阳虚冷泻等症[2]。仙茅成分复杂,主要包括酚及酚苷类、皂苷类、木脂素类、黄酮类、生物碱类、脂肪族类及其他类成分[3-5]。现代药理研究显示,仙茅具有清除氧自由基、增强免疫、延缓生殖系统衰老、抗骨质疏松、保肝、保护心血管系统等作用,可用于临床治疗骨质疏松症、乳腺增生、绝经后关节炎、更年期综合征及阳痿、再生障碍性贫血、原发性高血压等疾病[6-8]。
目前,关于仙茅的炮制研究以酒炙为主,本课题组前期实验发现,仙茅经酒炙后能够增强其补肾助阳的功效[9]。传统酒炙法为加入黄酒闷润后于锅中炒干,但对炒制火候、炮制时间等条件仅凭经验控制,存在着火候难以控制、饮片表面易出现焦斑、色泽不均匀等弊端。微波炮制不仅操作简单、节能高效、工艺可控,还具有消毒杀菌的作用,可弥补传统炮制方法的不足[10-11]。仙茅以酚苷类化合物为主,其中仙茅苷属苯甲酸酯类酚苷,是2020年版《中国药典》(一部)中规定的仙茅质量控制的指标性成分,也是其补肝肾的有效成分之一[1];苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷属苔黑酚类酚苷,在仙茅中的含量较高,是其发挥强筋骨作用的有效成分[12]。基于此,本研究采用高效液相色谱法(HPLC)测定仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷的含量,同时以上述3种成分及醇溶性浸出物含量为评价指标,采用正交设计对酒仙茅的微波炮制工艺进行优选,旨在为其微波炮制工艺的规范化、标准化操作奠定理论基础,为酒仙茅饮片的工业化生产提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有:Waters e2695型HPLC仪(美国Waters公司)、KQ-250E型医用超声波清洗器(江苏昆山市超声仪器有限公司)、XMTD-8222型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、HZ-A6002型电子天平(瑞安市金讯贸易有限公司)、FA1004B型电子天平(上海精密科学仪器有限公司)、DFT-200型高速万能粉碎机(浙江温岭市林大机械有限公司)、S7G88C型微波炉(苏州三星电子有限公司)等。
1.2 药品与试剂
仙茅苷对照品(批号S0818AS,纯度>98%)、苔黑酚葡萄糖苷对照品(批号O0201AS,純度≥97%)、苔黑酚龙胆二糖苷对照品(批号J1014AS,纯度>98%)均购自大连美仑生物技术有限公司;黄酒(批号20190202,酒精度10%)购自浙江古越龙山绍兴酒股份有限公司;甲醇、乙腈、磷酸均为色谱纯,其余试剂均为分析纯,水为超纯水。
仙茅药材(批号1805002)购自安国市聚药堂药业有限公司,经辽宁中医药大学中药鉴定室李峰教授鉴定为石蒜科植物仙茅C. orchioides Gaertn.的干燥根茎。
2 方法与结果
2.1 仙茅饮片及其酒炙品的制备
2.1.1 生仙茅饮片 将仙茅药材除去杂质,洗净,切成2 mm厚片,于60 ℃电热恒温鼓风干燥箱中干燥,即得。
2.1.2 传统酒炙法 取上述生仙茅饮片20 g,置于密闭容器内,加入10%黄酒(即生仙茅饮片质量的10%,下同)拌匀,闷透,待黄酒被吸尽后,置于锅中,以文火炒干,取出,放凉,即得[13]。
2.1.3 微波炮制法 取上述生仙茅饮片20 g,置于密闭容器内,加入20%黄酒拌匀,闷透,单层铺于微波炉托盘上,微波功率450 W,微波时间3 min,干燥,取出,放凉,即得。
2.2 醇溶性浸出物的测定
以95%乙醇为溶剂,按2020年版《中国药典》(四部)通则“2201浸出物测定法”项下“醇溶性浸出物测定法——热浸法”测定[14]。
2.3 仙茅苷等3种成分的含量测定
2.3.1 色谱条件 ①仙茅苷——以Diamonsil plus 5(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈-0.1%磷酸溶液(24 ∶ 76,V/V)为流动相;检测波长为210 nm;流速为1 mL/min;柱温为30 ℃;进样量为10 ?L。②苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷——以Diamonsil plus 5(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~7 min,95%B→90%B;7~20 min,90%B);检测波长为220 nm;流速为0.6 mL/min;柱温为30 ℃;进样量为10 ?L。
2.3.2 对照品溶液的制备 精密称取仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷对照品适量,分别置于10 mL量瓶中,加甲醇溶解并稀释至刻度,混匀,制得仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷质量浓度分别为0.152 0、0.227 0、0.247 0 mg/mL的单一对照品溶液。
2.3.3 供试品溶液的制备 取“2.1.3”项下微波炮制酒仙茅样品粉末(过三号筛,下同)1.0 g,精密称定,加入甲醇50 mL,称定质量,加热回流2 h,取出,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过。精密量取上述滤液20 mL,蒸干,残渣加甲醇复溶并转移至10 mL量瓶中,加甲醇稀释至刻度,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得[1]。同法制得生仙茅饮片、传统酒炙酒仙茅的供试品溶液。
2.3.4 阴性对照溶液的制备 以甲醇为阴性对照溶液,经0.22 μm微孔滤膜滤过,取续滤液,即得。
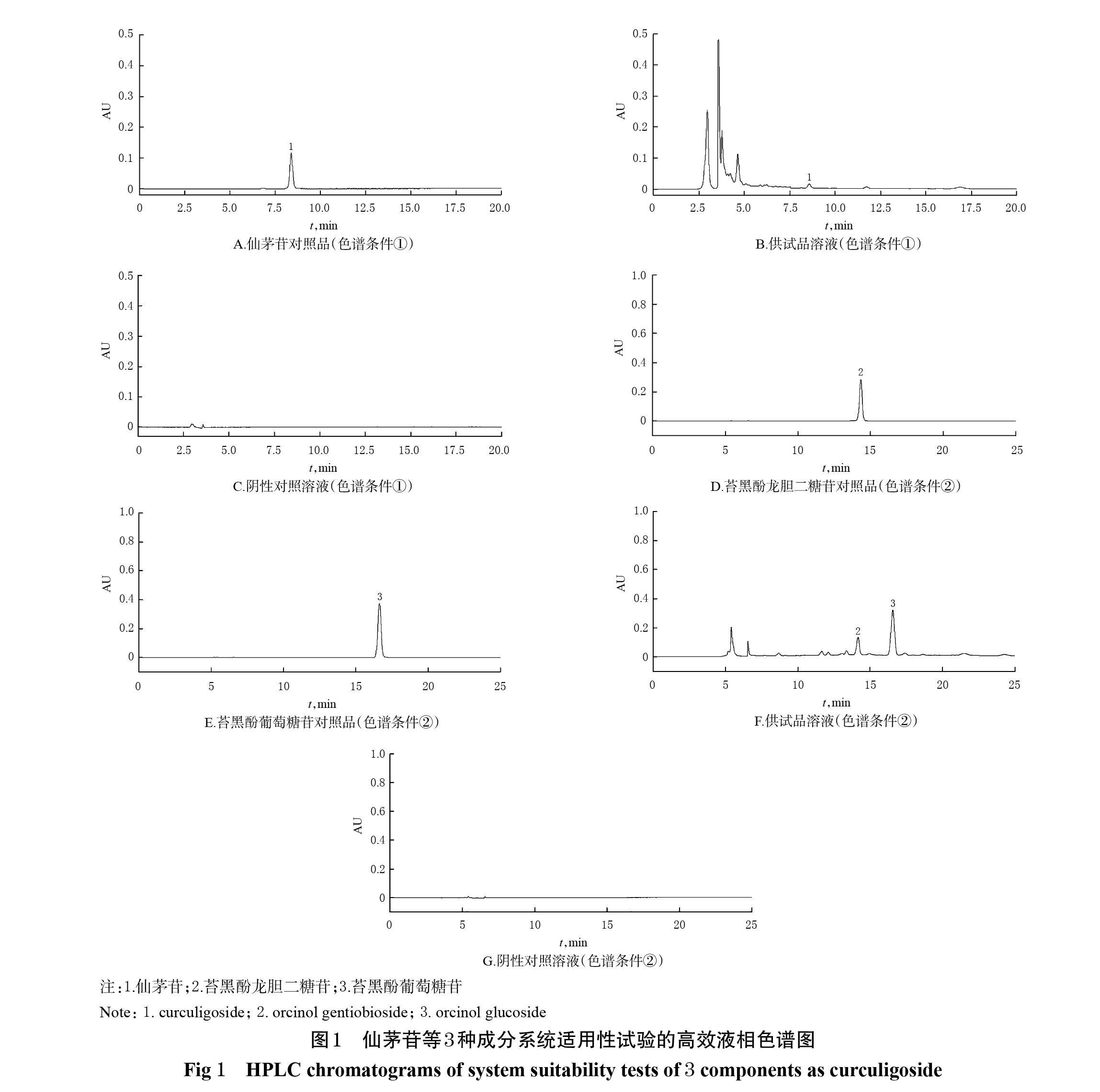
2.3.5 系统适用性试验 取上述各单一对照品溶液、供试品溶液(微波炮制酒仙茅)和阴性对照溶液适量,按“2.3.1”项下色谱条件进样测定,记录色谱图,详见图1。由图1可知,各色谱峰均基线分离,分离度均大于1.5,阴性对照对测定无干扰。
2.3.6 线性关系考察 分别精密吸取“2.3.2”项下各单一对照品溶液适量,用甲醇稀释,制成仙茅苷质量浓度分别为30.40、60.80、91.20、121.6、152.0 μg/mL,苔黑酚葡萄糖苷45.40、90.80、136.2、181.6、227.0 μg/mL,苔黑酚龙胆二糖苷49.40、98.80、148.2、197.6、247.0 μg/mL的各单一系列线性溶液,按“2.3.1”项下色谱条件进样测定,记录峰面积。以各待测成分进样量(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表1。
2.3.7 定量限和检测限考察 取“2.3.2”项下各单一对照品溶液,用甲醇逐级稀释,按“2.3.1”项下色谱条件进样测定,记录色谱图,分别以信噪比10 ∶ 1、3 ∶ 1计算定量限和检测限,结果见表1。
2.3.8 精密度试验 分别精密吸取“2.3.2”项下各单一对照品溶液适量,按“2.3.1”项下色谱条件连续进样测定6次,记录峰面积。结果,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷峰面积的RSD分别为0.81%、1.28%、1.55%(n=6),表明仪器精密度良好。
2.3.9 稳定性试验 取“2.3.3”项下供试品溶液(微波炮制酒仙茅)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龍胆二糖苷峰面积的RSD分别为0.84%、1.03%、1.22%(n=6),表明供试品溶液于室温下放置24 h内基本稳定。
2.3.10 重复性试验 取“2.1.3”项下微波炮制酒仙茅样品粉末1.0 g,共6份,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算各待测成分的含量。结果,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷的平均含量分别为0.089%、0.789%、0.423%,RSD分别为0.58%、1.42%、1.05%(n=6),表明该方法重复性良好。
2.3.11 加样回收率试验 精密称取“2.1.3”项下已知含量的微波炮制酒仙茅样品粉末0.1 g,共6份,分别加入“2.3.2”项下各单一对照品溶液适量,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.3.12 样品含量测定 分别取传统酒炙法、微波炮制法制得的酒仙茅样品粉末各适量,按“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算各待测成分的含量。每样品平行操作3次。
2.4 单因素实验
通过查阅相关文献[11]及微波炮制工艺与传统酒炙法之间的相互联系,本研究选择微波功率、闷润时间、微波时间、加酒量进行单因素实验;同时,参考相关文献[15-16]确定各因素的权重,3种酚苷类成分及醇溶性浸出物含量的权重均为25%。按以下公式计算综合评分:综合评分=(25%X/Xmax+25%Y/Ymax+25%W/Wmax+25%Z/Zmax)×100%。式中,X、Y、W、Z分别表示仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷、醇溶性浸出物的含量,Xmax、Ymax、Wmax、Zmax分别表示上述成分含量的最大值,综合评分越高表示样品质量越好[17]。
2.4.1 微波功率 取“2.1.1”项下生仙茅饮片,共6份,每份20 g,加入20%黄酒,闷润2 h后,单层铺于微波炉托盘上,设定微波时间3 min,考察不同微波功率(100、180、300、450、600、800 W)对综合评分的影响。结果,当微波功率为450 W时,综合评分最高,故选择微波功率300~600 W进行正交实验设计,详见表3。
2.4.2 闷润时间 取“2.1.1”项下生仙茅饮片,共6份,每份20 g,加入20%黄酒,闷润不同时间后,单层铺于微波炉托盘上,设定微波功率450 W、微波时间3 min,考察不同闷润时间(1、2、3、4、6、8 h)对综合评分的影响。结果,闷润2 h或3 h时的综合评分均较高且相差不大,故选择闷润时间1~3 h进行正交实验设计,详见表4。
2.4.3 微波时间 取“2.1.1”项下生仙茅饮片,共6份,每份20 g,加入20%黄酒,闷润2 h后,单层铺于微波炉托盘上,设定微波功率450 W,考察不同微波时间(1、2、3、4、6、8 min)对综合评分的影响。结果,当微波时间为3 min时,综合评分最高,故选择微波时间2~4 min进行正交实验设计,详见表5。
2.4.4 加酒量 取“2.1.1”项下生仙茅饮片,共6份,每份20 g,加入不同比例黄酒,闷润2 h后,单层铺于微波炉托盘上,设定微波功率450 W、微波时间3 min,考察不同加酒量(5%、10%、15%、20%、25%、30%)对综合评分的影响。结果,当加酒量为15%时,综合评分最高,故选择加酒量10%~20%进行正交实验设计,详见表6。
2.5 正交实验
2.5.1 正交实验设计 在单因素实验的基础上,本研究以加酒量(A)、微波功率(B)、微波时间(C)、闷润时间(D)为考察因素,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷和醇溶性浸出物含量的综合评分为评价指标,采用L9(34)正交表进行设计。酒仙茅微波炮制工艺的因素与水平见表7,实验设计方案与结果见表8,方差分析结果见表9。
由表8可知,各因素对3种酚苷类成分和醇溶性浸出物含量影响的大小顺序依次均为D>A>C>B,最优组合为A3B3C1D3。由表9可知,因素A、C、D对综合评分有显著影响(P<0.05),因素B无显著影响(P>0.05)。为节约能源,最终确定最优工艺为A3B1C1D3,即加酒量20%、微波功率300 W、闷润时间3 h、微波时间2 min。
2.5.2 验证 取3批“2.1.1”项下生仙茅饮片,每批100 g,按上述最优微波炮制工艺制备3批酒仙茅样品,再按“2.3.12”“2.2”项下方法分别测定含量。结果,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷和醇溶性浸出物的平均含量分别为0.095 6%、0.723 9%、0.406 6%、10.115 3%,平均综合评分为99.08分(RSD为0.69%),表明所得最优微波炮制工艺稳定、可行,详见表10。
2.6 生仙茅饮片与两种炮制品的含量比较
取“2.1.1”项下生仙茅饮片20 g,分别按“2.1.2”“2.5”项下方法分别制备传统酒炙品和微波炮制品,再按 “2.3.12” “2.2”项下方法分别测定生仙茅饮及两种炮制品中仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷和醇溶性浸出物的含量,每样品平行操作3次。采用SPSS 17.0软件对数据进行单因素方差分析,检验水准α=0.05。结果显示,除传统酒炙品中醇溶性浸出物含量外,传统酒炙品和微波炮制品中仙茅苷、苔黑酚龙胆二糖苷含量及微波炮制品中醇溶性浸出物含量均显著高于生仙茅饮片,且微波炮制品中仙茅苷、苔黑酚龙胆二糖苷含量均显著高于传统酒炙品;两种炮制品中苔黑酚葡萄糖苷含量均显著低于生仙茅饮片,但微波炮制品显著高于传统酒炙品(P<0.05),详见表11。
3 讨论
本课题组前期实验发现,在同时测定仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷等3种酚苷类成分时会出现色谱峰分离度较差、基线不平稳等现象。为此,本研究考察了不同色谱柱[Diamonsil plus 5(250 mm×4.6 mm,5 μm)、Xtimate C18(250 mm×4.6 mm,5 μm)]、流动相(甲醇-0.1%磷酸溶液、乙腈-0.1%磷酸溶液)在200~400 nm波长下的分离效果。结果,仙茅苷在210 nm波长处响应较强,苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷在220 nm波长处响应较强;采用 “2.3.1”项下色谱条件进行检测时,所得各色谱峰的峰形和分离度均较好。
中药成分较为复杂,且各个成分协同作用发挥药效,仅以单一成分作为质量控制的指标,不能体现整体的质量,故需对多个指标进行综合评价,以反映中药整体的质量[18]。酚苷类成分是仙茅补肾壮阳的物质基础,故本研究选择仙茅酚苷中含量较高的成分苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷和2020年版《中国药典》(一部)中的指标成分仙茅苷作为评价指标[1,13]。
在实际操作中,传统酒炙法的火候、炮制时间难以控制,太过易炒焦,不及则无法达到预期的炮制效果。因此,寻找一种节能、高效且操作工艺可控的新型炮制方法是保证炮制品质量的关键[19]。本研究采用微波炮制法,以加酒量、微波功率、闷润时间、微波时间为考察因素,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷和醇溶性浸出物含量为考察指标,结合综合加权评分对工艺进行优化,得到最优微波炮制工艺为加酒量20%、微波功率300 W、闷润时间3 h、微波时间2 min。经验证,仙茅苷、苔黑酚葡萄糖苷、苔黑酚龙胆二糖苷及醇溶性浸出物的平均含量分别0.095 6%、0.723 9%、0.406 6%、10.115 3%,RSD分别为0.71%、0.54%、0.99%、1.44%(n=3);平均综合评分为99.08分,RSD为0.69%(n=3),提示所得最优微波炮制工艺稳定、可行。仙茅经酒炙后,所得传统酒炙品和微波炮制品中仙茅苷的含量均有所增高,可能是在炮制过程中,其他部分化学成分转化为仙茅苷,使得炮制品中仙茅苷含量升高[20];同時,与传统酒炙法进行比较,微波炮制法所得酒仙茅中3种酚苷类成分及醇溶性浸出物的含量均略高于传统酒炙法,而经微波炮制和传统酒炙后的仙茅中苔黑酚葡萄糖苷成分含量均低于生仙茅饮片,但经微波炮制后苔黑酚葡萄糖苷含量的降低程度不如传统酒炙明显,推测仙茅在酒炙的过程中,苔黑酚葡萄糖苷的糖苷键可能发生断裂,进而转化成相应苷元[21];而在微波炮制过程中,由于微波穿透力强,在加热过程中吸收能量,分子间互相摩擦而生热,具有一定的膨化破壁作用,致使溶剂更易进入细胞内部溶解并释放成分,有利于有效成分的溶出[22]。
综上所述,本研究所得最优微波炮制工艺稳定、可行,可用于酒仙茅的炮制。虽然微波炮制法具有独特的热力学形态与能量传递转化规律,操作简单且炮制效率高、产品性状好、生产能耗低等综合优势[23],但由于炮制工艺变化较大,是否能替代传统的炮制方法,后续尚需化学成分分析、药理实验、临床研究等进一步验证。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:105-106.
[ 2 ] 曹晖,付静.全国中药炮制经验与规范集成:增修本[M].北京:科学技术出版社,2017:109-110.
[ 3 ] HEJAZI I I,KHANAM R,MEHDI S H,et al. Antioxidative and anti-proliferative potential of Curculigo orchi- oides Gaertn in oxidative stress induced cytotoxicity:in vitro,ex vivo and in silico studies[J]. Food Chem Toxicol,2018,115:244-259.
[ 4 ] YOKOSUKA A,SATO K,MIMAKI Y. Cycloartane glycosides from the rhizomes of Curculigo orchioides[J]. Phytochemistry,2010,71(17/18):2174-2181.
[ 5 ] 刘梦琴,张奇,朱露琳,等.仙茅苔黑酚类酚苷对去卵巢大鼠骨代谢和破骨细胞形成分化的影响[J].中国药学杂志,2021,56(2):99-107.
[ 6 ] WANG Y,ZHAO L,WANG Y,et al. Curculigoside iso- lated from Curculigo orchioides prevents hydrogen per- oxide-induced dysfunction and oxidative damage in calvarial osteoblasts[J]. Acta Biochim Biophys Sin,2012,44(5):431-441.
[ 7 ] WANG L,HE Y J,HAN T,et at. Metabolites of curculigoside in rats and their antiosteoporotic activities in osteoblastic MC3T3-E1 cells[J]. Fitoterapia,2017,117:109- 117.
[ 8 ] WANG N,ZHAO G,ZHANG Y,et al. A Network pharmacology approach to determine the active components and potential targets of Curculigo orchioides in the treatment of osteoporosis[J]. Med Sci Monit,2017,23:5113-5122.
[ 9 ] 杜中梅.仙茅炮制工艺及质量标准研究[D].沈阳:辽宁中医药大学,2008.
[10] 王斌,梁伟龙,林钦贤,等.酒制延胡索微波炮制工艺的优化研究[J].中国药房,2020,31(20):2503-2507.
[11] 李越峰,牛江涛,曹瑞,等.正交试验法优选红芪的最佳微波炮制工艺[J].中国医院药学杂志,2017,37(15):1475-1478.
[12] 张乃丹,蒋益萍,薛黎明,等.仙茅酚苷类成分促进成骨细胞骨形成和抑制破骨细胞骨吸收[J].第二軍医大学学报,2016,37(5):562-568.
[13] 贾天柱.中药炮制学[M].北京:中国中医药出版社,2015:177-178.
[14] 国家药典委员会.中华人民共和国药典:四部 [S]. 2020年版.北京:中国医药科技出版社,2020:232.
[15] 鞠成国,林长旭,史雅红,等.仙茅酒炙工艺的优化[J].中成药,2017,39(5):1081-1084.
[16] 吕彤彤,鞠成国,刘博男,等.仙茅盐炙工艺的优化[J].中成药,2019,41(10):2425-2429.
[17] 艾雪,鞠成国,贾坤静,等.酒仙茅炮制工艺的正交试验优选[J].时珍国医国药,2016,27(4):875-877.
[18] 张祺嘉钰,胡丽君,吴建华,等.响应面法优化酒炙续断微波炮制工艺[J].国际药学研究杂志,2018,45(7):548- 553.
[19] 宋艺君,郭涛,吕慧锋,等.响应面法优化甘草制款冬花微波炮制工艺[J].中国药学杂志,2020,55(22):1853-1860.
[20] 刘芳,祝宇,魏娟,等.不同炮制法对仙茅中仙茅苷含量的影响[J].中国药师,2018,21(12):2284-2286.
[21] HE Y,DONG X,JIA X,et al. Qualitative and quantitative analysis on chemical constituents from Curculigo orchi- oides using ultra high performance liquid chromatography coupled with electrospray ionization quadrupole time- of-flight tandem mass spectrometry[J]. J Pharm Biomed Anal,2015,102:236-245.
[22] 陈露梦,贺亚男,王芳,等.中药微波炮制技术的研究进展[J].中国中药杂志,2020,45(9):2073-2081.
[23] 黄潇,刘婧,付小梅,等.基于CRITIC法计算权重系数的Box-Behnken响应面法优化栀子炭微波炮制工艺研究[J].中草药,2017,48(6):1133-1138.
(收稿日期:2021-04-15 修回日期:2021-07-21)
(编辑:陈 宏)

