高温胁迫下杜鹃叶片AsA-GSH循环的亚细胞定位分析
刘晓青 赵晖 耿兴敏 李畅 肖政 苏家乐


摘要:为明确杜鹃AsA-GSH循环在亚细胞水平上对高温胁迫的响应机制,以耐热性不同的杜鹃品种胭脂蜜、红珊瑚、红月为试验材料,分析高温胁迫下AsA-GSH循环中还原型抗坏血酸(AsA)、还原型谷胱甘肽(GSH)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性在细胞溶质、叶绿体和线粒体中的变化。结果表明:胭脂蜜耐熱性高于红珊瑚和红月,高温胁迫后MDA含量仅在红月中显著升高。高温胁迫下胭脂蜜和红珊瑚的AsA、APX和GSH主要存在于细胞溶质中,其次是线粒体和叶绿体,GR的亚细胞分布为线粒体>叶绿体>细胞溶质。红月中4个AsA-GSH循环指标的亚细胞分布与其他2个杜鹃品种不同,APX和GR在叶绿体中活性最高,AsA主要存在于线粒体,GSH则主要存在于细胞溶质中。高温胁迫下,3个杜鹃品种AsA含量在3个亚细胞组分中都有所升高,仅在胭脂蜜叶绿体中显著下降;APX活性都有所升高,但仅在胭脂蜜和红月细胞溶质和红月叶绿体中升高显著;GR仅在胭脂蜜叶绿体中显著升高,在红月的细胞溶质和线粒体中显著下降;GSH在胭脂蜜叶绿体、红珊瑚和红月的细胞溶质中显著降低,在其他亚细胞中变化不显著。本研究未发现杜鹃耐热性强度与抗氧化指标亚细胞分布之间存在相关性。
关键词:杜鹃;高温胁迫;抗坏血酸-谷胱甘肽循环
中图分类号: S685.210.1 文献标志码: A
文章编号:1002-1302(2021)18-0128-06
收稿日期:2020-12-16
基金项目:国家自然科学基金(编号:31700627);江苏省自然科学基金(编号:BK20170607);中央财政林业科技推广示范资金(编号:苏 [2018]TG02);江苏省林业发展专项资金(编号:苏财资环[2020] 26号)。
作者简介:刘晓青(1970—),女,山东青岛人,研究员,主要研究方向为杜鹃花育种与栽培。E-mail:1376660436@qq.com。
通信作者:李畅,硕士,副研究员,主要从事观赏植物种质资源与遗传育种研究。E-mail:changli529@foxmail.com。
抗坏血酸-谷胱甘肽(AsA-GSH)循环是植物活性氧清除系统的重要组成部分[1]。APX和GR是AsA-GSH循环中重要的酶,以AsA和GSH为底物还原H2O2,并促进AsA和GSH的循环再生[2](表1)。有研究表明,叶绿体活性氧(ROS)可以通过超氧化物歧化酶(SOD)以及抗坏血酸-谷胱甘肽(AsA-GSH)循环进行清除[2]。叶绿体中AsA-GSH 循环在圆柏低温胁迫响应中发挥主要作用[3]。保持叶绿体AsA-GSH循环持续快速、有效运转,降低叶绿体膜系统受伤害程度,维持叶肉细胞较强的光合活性,是耐盐的菜用大豆维持较高的净光合速率的重要生理基础之一[4]。AsA-GSH循环在叶绿体ROS清除过程中发挥重要作用。同时,AsA-GSH循环也存在于细胞溶质、线粒体、质体和过氧化物酶体中[5-6],对维持大部分亚细胞组分氧化还原平衡起着重要作用。AsA-GSH循环中抗氧化酶及抗氧化物质在亚细胞分布上存在差异。三叶草在水胁迫下,AsA和GR的亚细胞分布为叶绿体>线粒体>细胞溶质,而APX的亚细胞分布为叶绿体>细胞溶质>线粒体[7]。高温胁迫后,烟草AsA、GSH、APX和GR的亚细胞分布都为细胞溶质>质体>线粒体[8]。
杜鹃花作为我国传统十大名花之一,具有很高的观赏和应用价值[9]。大部分杜鹃花属植物的原始生境都是较阴凉湿润的地区,忌炎热和强光,因此高温热害会导致植物发育停滞甚至死亡,是制约杜鹃花应用于园林中的一个重要因素[10]。目前杜鹃高温胁迫下活性氧清除系统研究主要集中于SOD、POD、CAT等抗氧化物酶活性的变化[11-14],对AsA-GSH循环中APX和AsA的变化虽也有报道[12-13,15-16],但针对AsA-GSH循环的研究以及其亚细胞定位分析尚未见报道。因此,本研究以前期筛选出的3种耐热性不同的杜鹃为研究对象,进行高温胁迫,分析高温胁迫后叶绿体、线粒体和细胞溶质等亚细胞组分中AsA-GSH循环的抗氧化酶及抗氧化物质的变化,以期能够在亚细胞水平上明确杜鹃AsA-GSH循环在高温胁迫下的活性氧调控机制。
1 材料与方法
1.1 材料与处理
选择耐热性不同的3个杜鹃品种胭脂蜜、红珊瑚、红月的当年生扦插苗(3月份扦插,7月份用于试验)进行试验。2018年7月在江苏省农业科学院智能温室中选择大小一致、生长健壮的杜鹃幼苗,进行胁迫处理。胁迫处理在实验室培养箱中进行,高温处理(HS)温度 42 ℃/30 ℃(昼/夜),对照(CK)组放置在通风的温室(25 ℃)中。为避免水分胁迫,盆底放置托盘补充水分,每个品种选取10株幼苗。处理72 h后取样,样品保存于-80 ℃冰箱中。
1.2 亚细胞提取的方法
参照于飞等的方法[3],对叶绿体、线粒体和细胞溶质进行分离提取,取10 g杜鹃叶片,用液氮迅速研磨成粉,加入预冷的提取缓冲液,过滤,滤液用冷冻离心机离心。利用差速离心法进行叶绿体(2 000 r/min,沉淀)、线粒体(12 000 r/min,沉淀)和细胞溶质(12 000 r/min,上清液)的分离提取。用 5 mL 提取缓冲液分别悬浮叶绿体和线粒体沉淀,可获得叶绿体和线粒体的提取液。
1.3 叶片亚细胞生理生化指标的测定
取亚细胞提取液0.5 mL,参照Kampfenkel等的方法[17],测定抗坏血酸(AsA)的含量:加质量浓度6%三氯乙酸(TCA)定容至8 mL,15 600 r/min,2 ℃离心10 min,上清液即为样品待测液,测525 nm处的吸光度。参照李玲的方法[18],测定谷胱甘肽(GSH)的含量:加入5 mL经4 ℃预冷的50 g/L TCA(含 5 mol/L EDTA),于4 ℃、12 000 r/min离心20 min,上清液即为样品待测液,迅速测定显色液在波长412 nm处的吸光度。参照汤绍虎等的方法[19],测定抗坏血酸过氧化物酶(APX)的活性:加入5 mL pH值7.0的磷酸缓冲液(25 mmol/L),在 10 000 r/min下离心15 min,上清液即为样品待测液,测定连续 1 min 内290 nm下的吸光度。参照李忠光等的方法[20],测定谷胱甘肽还原酶(GR)的活性:加入 5 mL 预冷的酶提取液,于4 ℃下 10 000 r/min 离心20 min,上清液即为样品待测液,测定连续4 min内340 nm下的吸光度。
采用Microsoft Excel 2016软件进行数据处理和作图,采用SPSS 19.0软件进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 杜鹃幼苗热害症状变化及过氧化损伤
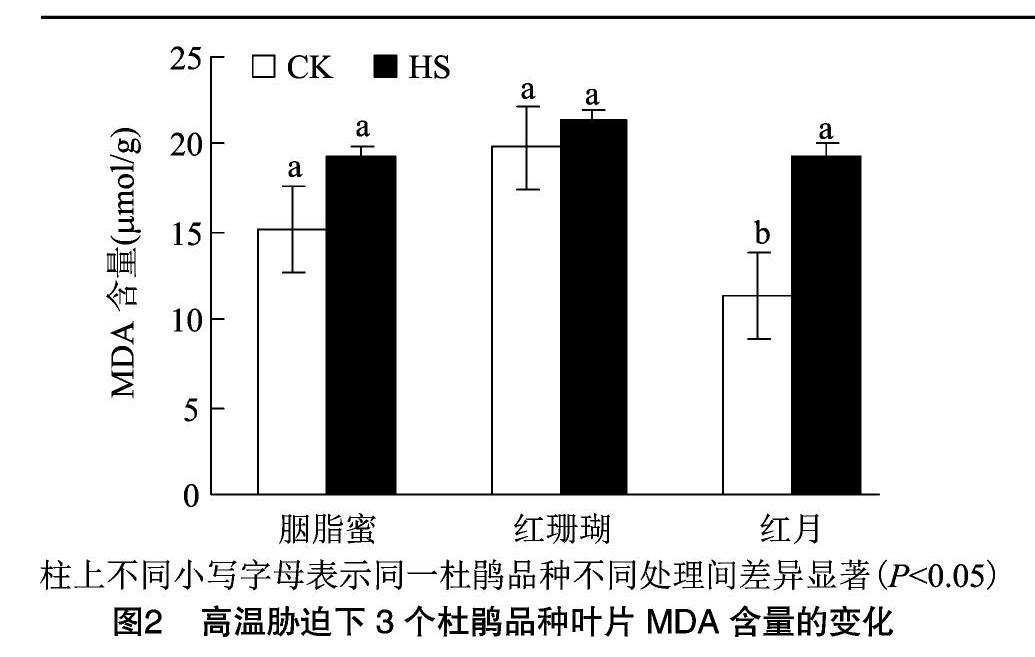
从图1中可以看出,高温胁迫处理3 d后,胭脂蜜叶片无明显变化;红珊瑚顶部个别幼嫩叶片出现轻度变黄;红月顶部个别幼嫩叶片边缘开始枯黄。结果表明,胭脂蜜比红珊瑚和红月有更好的耐热性,红月耐热性最差。
MDA是膜脂过氧化作用的最终产物[21]。高温胁迫后3个杜鹃品种MDA含量均呈上升趋势(图2)。高温胁迫后,MDA含量在红月中变化显著,在胭脂蜜和红珊瑚中变化不显著。红月的过氧化损伤程度比胭脂蜜和红珊瑚严重。
2.2 高温胁迫下3个杜鹃品种叶片各亚细胞中AsA含量的变化
由图3可知,高温胁迫后,胭脂蜜和红珊瑚AsA含量在3个亚细胞组分中从高到低依次为细胞溶质>线粒体>叶绿体,胭脂蜜AsA含量在线粒体和叶绿体中无显著差异,红珊瑚AsA含量在3个亚细胞间的分布差异显著;而红月AsA含量从高到低依次为线粒体>细胞溶质>叶绿体,细胞溶质和叶绿体中AsA含量差异不显著。
高温胁迫后,在细胞溶质中,胭脂蜜和红珊瑚AsA含量显著上升,而红月AsA含量无显著性变化,3个杜鹃品种中AsA含量从高到低依次为红珊瑚>胭脂蜜>红月。AsA含量在线粒体中的变化与细胞溶质中的变化一致,但3个杜鹃品种中AsA含量从高到低依次为红月>红珊瑚>胭脂蜜。在叶绿体中,胭脂蜜AsA含量显著降低,红珊瑚和红月AsA含量显著上升,3个杜鹃品种中AsA含量从高到低依次为红月>胭脂蜜>红珊瑚。
2.3 高温胁迫下3个杜鹃品种叶片各亚细胞中APX活性的变化
由图4可知,高温胁迫后,胭脂蜜和红珊瑚APX活性在3个亚细胞组分间从高到低依次为细胞溶质>叶绿体>线粒体,红月APX活性的亚细胞分布为叶绿体>细胞溶质>线粒体。APX活性在胭脂蜜和红珊瑚的叶绿体和线粒体中无显著差异,而红月细胞溶质和叶绿体APX活性无显著差异。
高温胁迫后,3个杜鹃品种APX活性除在胭脂蜜细胞溶质和红月细胞溶质和叶绿体中显著上升外,其余APX活性与对照相比均无显著性差异。细胞溶质、线粒体和叶绿体中3个杜鹃品种中APX活性从高到低依次为胭脂蜜>红珊瑚>红月、胭脂蜜>红月>红珊瑚、红月>红珊瑚>胭脂蜜。
2.4 高温胁迫下3个杜鹃品种叶片各亚细胞中GSH含量的变化
从图5可知,高温胁迫后,3个杜鹃品种GSH在细胞溶质中含量高于线粒体和叶绿体,GSH含量在胭脂蜜的3个亚细胞组分间的分布差异显著,红珊瑚的细胞溶质和线粒体GSH含量变化不显著,但显著高于叶绿体,红月细胞溶质中GSH含量显著高于线粒体和叶绿体,并且GSH含量在线粒体和叶绿体中变化不明显。
高温胁迫后,在细胞溶质中,GSH含量在红珊瑚和红月中显著降低,红月的下降幅度高于红珊瑚,在胭脂蜜中上升但并不显著。3个杜鹃品种细胞溶质中GSH含量从高到低依次为胭脂蜜>红月>红珊瑚。在线粒体中,与对照相比,3个杜鹃品种GSH含量在高温胁迫后均无显著性差异,3个杜鹃品种线粒体中GSH含量从高到低依次为胭脂蜜>红珊瑚>红月。在叶绿体中,胭脂蜜中GSH含量下降显著,其余2个品种无显著变化,3个杜鹃品种叶绿体中GSH含量从高到低依次为红月>胭脂蜜>红珊瑚。
2.5 高温胁迫下3个杜鹃品种叶片各亚细胞中GR活性的变化
从图6可知,高温胁迫后,胭脂蜜和红珊瑚的GR活性在线粒体中含量最高,显著高于细胞溶质和叶绿体,GR活性在红月的3个亚细胞组分间的分布从高到低依次为叶绿体>线粒体>细胞溶质,且在3个亚细胞组分间的分布差异显著。
高温胁迫后,在细胞溶质中,胭脂蜜和红珊瑚的GR活性上升不显著,胭脂蜜上升幅度高于红珊瑚,红月中GR活性显著下降,3个杜鹃品种细胞溶质中GR活性从高到低依次为红月>胭脂蜜>红珊瑚。在线粒体中,GR活性的变化与细胞溶质中一致,但3个杜鹃品种线粒体中GR活性从高到低依次为胭脂蜜>红珊瑚>红月。在叶绿体中,胭脂蜜中GR活性在高温胁迫后显著上升,红珊瑚和红月GR活性無显著性变化。3个杜鹃品种叶绿体中GR活性从高到低依次为红月>红珊瑚>胭脂蜜。
3 讨论与结论
高温胁迫导致杜鹃幼苗中积累过多活性氧,造成过氧化胁迫,耐热性强的杜鹃可以维持较高的抗氧化酶活性,清除过多的活性氧[15,22]。前期研究以2年生的杜鹃扦插苗为试验材料进行高温胁迫,发现胭脂蜜的耐热性比红月强,红珊瑚的耐热性最差[23]。而本研究中以杜鹃当年生扦插苗试验材料,进行热胁迫,发现胭脂蜜耐热性与以往研究相同,而红珊瑚的耐热性比红月强,这或许与幼苗苗龄以及自身营养状态相关。闫圆圆等[24]和贾志国[25]分别对结球甘蓝和仙客来的耐热性研究发现,苗龄与植物的耐热性具有相关性。从MDA含量变化也可以看出,红月耐热性最差,高温胁迫后,红月MDA含量变化显著,胭脂蜜和红珊瑚MDA含量没有显著变化。申惠翡等[26]和张乐华等[11]的研究表明,MDA含量与耐热性呈负相关。
3.1 高温胁迫后杜鹃AsA-GSH循环的亚细胞定位
APX、GR、GSH和AsA在杜鹃细胞溶质、线粒体和叶绿体中都有分布,但4个指标的亚细胞分布存在着品种间差异。耐热性强的胭脂蜜和耐热性较差的红珊瑚AsA、GSH含量和APX活性均在细胞溶质中含量最高,其次是线粒体和叶绿体,GR则主要分布在线粒体中。耐热性差的红月APX、GR在叶绿体中活性最高,AsA主要分布在线粒体,而GSH主要分布在细胞溶质中。抗氧化指标亚细胞分布的差异或许与基因型不同有关,也可能与胁迫类型以及耐受性不同有关。研究表明,AsA-GSH循环是叶绿体中主要的活性氧清除系统。白三叶在水胁迫后,MDA、H2O2以及AsA-GSH循环均主要分布在叶绿体中[27];圆柏进行低温胁迫发现,ASA-GSH 循环效率定位为叶绿体>线粒体>细胞溶质,表明圆柏属植物叶绿体中ASA-GSH 循环在低温胁迫响应中发挥主要作用[28]。
研究表明,胭脂蜜、红珊瑚和红月3个杜鹃品种H2O2含量的亚细胞分布为细胞溶质>叶绿体>线粒体,耐热性差的杜鹃红月和红珊瑚中MDA含量分布与H2O2的亚细胞分布相一致,耐热性强的杜鹃胭脂蜜细胞溶质中的MDA含量最高,但线粒体和叶绿体的排序发生了变化[23]。本研究中4个抗氧化指标的亚细胞分布与之进行比较,可以发现AsA-GSH循环与H2O2的亚细胞分布并不一致,但其中3个指标AsA、GSH和APX也都在细胞溶质中含量最高。另外,耐热最好的杜鹃胭脂蜜中MDA的亚细胞分布与这3个指标的排序完全一致,即细胞溶质>线粒体>叶绿体。GR的排序与H2O2、MDA完全不同,这可以在一定程度上说明,高温胁迫下AsA、GSH和APX在杜鹃抗氧化循环中起着重要作用。
3.2 高温胁迫下3个亚细胞中AsA-GSH循环的响应
高温胁迫下,在胭脂蜜细胞溶质中,4个抗氧化指标都有所升高,但仅APX和AsA升高显著;红珊瑚AsA显著升高,APX和GR变化不显著,GSH显著下降;耐热性最差的红月细胞溶质中的APX显著升高,AsA 变化不显著,GSH和GR显著下降。在细胞溶质中,通过提高AsA-GSH循环代谢中抗氧化物含量(ASA、GSH)和抗氧化酶(APX、GR)活性,使耐热性强的杜鹃有更好的对H2O2清除的能力。玉米细胞溶质中ASA、GSH含量和APX、GR活性在PEG胁迫(水胁迫)后都上升[27],使玉米对PEG胁迫有更好的耐受性。另外,3个杜鹃品种相比,高温胁迫后,耐热性强的胭脂蜜中发挥作用的抗氧化酶及抗氧化剂的种类多于耐性差的红珊瑚和红月。
高温胁迫后,在线粒体中,耐热性强的胭脂蜜和耐热性较强的红珊瑚AsA显著升高,耐热性差的红月线粒体中GR显著降低,3个杜鹃品种中其他指标的变化在线粒体不显著,但均在抗性强的品种胭脂蜜中含量(活性)最高。耐热性强的杜鹃线粒体AsA-GSH循环代谢中高的抗氧化物含量(ASA、GSH)和抗氧化酶(APX、GR)活性,促进线粒体 AsA-GSH循环对H2O2的清除作用。对枇杷幼果低温胁迫发现,通过提高幼果线粒体AsA-GSH循环代谢中的抗氧化物含量(ASA、GSH)和抗氧化酶类(APX、GR)的活性,促进幼果线粒体AsA-GSH循环对H2O2的清除作用,增强枇杷幼果在低温胁迫下的抗寒能力[29]。孙海平等对大豆种子PEG处理发现,种子线粒体中APX、GR增加,提高了大豆种子抗吸胀冷害的能力[30]。
在本研究中,叶绿体AsA-GSH循环中抗氧化酶活性和抗氧化物含量的变化与杜鹃的耐热性并不明确。3个杜鹃品种相比,红月叶绿体中抗氧化物含量(ASA、GSH)和抗氧化酶类(APX、GR)的活性均比胭脂蜜和红珊瑚中的要高。Gu等研究发现,叶绿体对高温的反应最为敏感,其中类囊体片层变得模糊,甚至在热敏性杜鹃属植物中降解[31]。耐热性差的杜鹃叶绿体更容易受ROS的损伤,其叶绿体中抗氧化机制更容易被激活。在叶绿体中,高温胁迫后胭脂蜜AsA和GSH呈显著下降趋势,有待进一步深入研究。
参考文献:
[1]Pang C H,Wang B S. Role of ascorbate peroxidase and glutathione reductase in ascorbate-glutathione cycle and stress tolerance in plants [M]//Ascorbate-glutathione pathway and stress tolerance in plants. Berlin:Springer Netherlands,2010:91-113.
[2]Das K,Roychoudhury A. Reactive oxygen species(ROS)and response of antioxidants as ROS-scavengers during environmental stress in plants[J]. Frontiers in Environmental Science,2014,2(53):1-13.
[3]于 飛,陈银萍,杨宗娟,等. 低温胁迫对两种圆柏属植物亚细胞抗氧化酶活性的影响[J]. 广西植物,2014,34(5):686-693.
[4]王 聪,杨恒山,刘艳华,等. NaCl胁迫下外源壳聚糖对菜用大豆叶绿体AsA-GSH循环的影响[J]. 江苏农业学报,2016,32(5):1141-1147.
[5]Jimenez A,Hernandez J A,Pastori G,et al. Role of the ascorbate-glutathione cycle of mitochondria and peroxisomes in the senescence of pea leaves[J]. Plant Physiology,1998,118(4):1327-1335.
[6]Meyer A J. The integration of glutathione homeostasis and redox signaling[J]. Journal of Plant Physiology,2008,165(13):1390-1403.
[7]Wang C Q,Zhang Y F,Zhang Y B. Scavenger enzyme activities in subcellular fractions of white clover (Trifolium repens L.) under PEG-induced water stress[J]. Journal of Plant Growth Regulation,2008,27(4):387-393.
[8]Locato V,de Pinto M C,de Gara L. Different involvement of the mitochondrial,plastidial and cytosolic ascorbate-glutathione redox enzymes in heat shock responses[J]. Physiologia Plantarum,2009,135(3):296-306.
[9]耿玉英. 中国杜鹃花属植物[M]. 上海:上海科学技术出版社,2014.
[10]庞新华,罗 清,池昭锦. 杜鹃耐热生理研究进展[J]. 北方园艺,2016(13):192-195.
[11]张乐华,孙宝腾,周 广,等. 高温胁迫下五种杜鹃花属植物的生理变化及其耐热性比较[J]. 广西植物,2011,31(5):651-658.
[12]周 广,孙宝腾,张乐华,等. 井冈山杜鹃叶片抗氧化系统对高温胁迫的响应[J]. 西北植物学报,2010,30(6):1149-1156.
[13]王凯红,凌家慧,张乐华,等. 两种常绿杜鹃亚属幼苗耐热性的主成分及隶属函数分析[J]. 热带亚热带植物学报,2011,19(5):412-418.
[14]Shen H F,Zhao B,Xu J J,et al. Effects of heat stress on changes in physiology and anatomy in two cultivars of Rhododendron[J]. South African Journal of Botany,2017,112:338-345.
[15]张乐华,周 广,孙宝腾,等. 高温胁迫对两种常绿杜鹃亚属植物幼苗生理生化特性的影响[J]. 植物科学学报,2011,29(3):362-369.
[16]刘 宇,宋希强,史佑海,等. 高温胁迫下海南杜鹃和白花杜鹃的生理响应比较分析[J]. 分子植物育种,2018,16(17):5827-5834.
[17]Kampfenkel K,van Montagu M,Inzé D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J]. Analytical Biochemistry,1995,225(1):165-167.
[18]李 玲. 植物生理学模块实验指导[M]. 北京:科学出版社,2009.
[19]汤绍虎,罗 充. 植物生理学实验教程[M]. 重庆:西南师范大学出版社,2012.
[20]李忠光,龚 明. 植物生理学综合性和设计性实验教程[M]. 武汉:华中科技大学出版社,2014.
[21]Mittler R. Oxidative stress,antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405-410.
[22]李小玲,雒玲玲,华智锐. 高温胁迫下高山杜鹃的生理生化响应[J]. 西北农业学报,2018,27(2):253-259.
[23]耿兴敏,肖丽燕,赵 晖,等. H2O2预处理及高温胁迫下杜鹃叶片活性氧及抗氧化酶亚细胞定位分析[J]. 西北植物学报,2019,39(5):791-800.
[24]闫圆圆,曾爱松,宋立晓,等. 结球甘蓝幼苗耐热性鉴定方法及耐热生理[J]. 江苏农业学报,2016,32(4):885-890.
[25]贾志国. 仙客来耐热性研究[D]. 保定:河北农业大学,2005.
[26]申惠翡,赵 冰. 杜鹃花品种耐热性评价及其生理机制研究[J]. 植物生理学报,2018,54(2):335-345.
[27]Tan M P,Lu J,Zhang A Y,et al. The distribution and cooperation of antioxidant (Iso)enzymes and antioxidants in different subcellular compartments in maize leaves during water stress[J]. Journal of Plant Growth Regulation,2011,30(3):255-271.
[28]于 飞. 低温胁迫下圆柏属植物抗氧化系统在叶片中的亚细胞定位研究[D]. 兰州:兰州交通大学,2013.
[29]黄志明,陈 宇,吴晶晶,等. 硝普钠对低温胁迫下枇杷幼果线粒体AsA-GSH循环代谢的影响[J]. 热带作物学报,2011,32(8):1469-1474.
[30]孫海平,汪晓峰. PEG处理对种子线粒体中抗坏血酸-谷胱甘肽循环的影响[J]. 现代农业科技,2009(6):135-136,138.
[31]Gu K,Geng X M,Yue Y,et al. Contribution of keeping more stable anatomical structure under high temperature to heat resistance of Rhododendron seedlings[J]. Journal of Faculty of Agriculture,Kyushu University,2016,61(2):273-279.

