禾谷镰刀菌拮抗菌ZQT-9的鉴定与抑菌活性
张艳茹 霍云凤 石红利 张强


摘要:为发掘对禾谷镰刀菌具有较好拮抗能力的细菌,从小麦植株残体中分离筛选得到1株细菌菌株ZQT-9,根据形态学特征、生理生化特征以及16S rDNA序列分析相结合的方法进行鉴定,并对其抑菌活性进行研究。结果表明,菌株ZQT-9为多黏类芽孢杆菌(Paenibacillus polymyxa),对禾谷镰刀菌(Fusarium graminearum)的抑菌率为(57.6±0.8)%。菌株ZQT-9无菌发酵液对禾谷镰刀菌的孢子萌发和菌丝生长具有明显抑制作用,并且当无菌发酵液浓度为50%时可以完全抑制禾谷镰刀菌孢子的萌发。PCR检测结果表明,菌株ZQT-9可能具有编码多黏菌素B、多黏菌素C、水解蛋白酶、β-葡聚糖及杀镰孢菌素等5种抗菌物质的相关基因。此外,菌株ZQT-9对链格孢菌(Alternaria alternata)、尖孢镰刀菌(F. oxysporum)、凸脐蠕孢(Exserohilum turcicum)、甜樱间座壳菌(Diaporthe eres)等4种植物病原真菌均具有明显的抑制作用。综上所述,多黏类芽孢杆菌ZQT-9具有潜在的生物防治应用前景。
关键词:禾谷镰刀菌;多黏类芽孢杆菌;生物防治;抑菌活性;菌株鉴定
中图分类号:S435.121.4+5 文献标志码:A
文章编号:1002-1302(2021)18-0111-05
收稿日期:2021-02-15
基金项目:河南科技学院自然科学基础研究计划(编号:208010617006)。
作者简介:张艳茹(1993—),女,河北南皮人,硕士,助教,主要从事植物病害生物防治研究。E-mail:920415575@qq.com。
通信作者:张 强,博士,讲师,主要从事禾谷镰刀菌基因功能及生物防治研究。E-mail:zhangqiang4503@163.com。
由禾谷镰刀菌(Fusarium graminearum)侵染引起的小麦赤霉病是我国小麦生产上的一种重要病害[1]。2010年以来,我国小麦赤霉病的流行频率明显高于20世纪[2-3]。仅河南省,小麦赤霉病年平均发生面积为126.17万hm2,产量年均损失26.72万t[4]。小麦赤霉病的发生不仅造成产量损失,而且病原菌还可以分泌多种真菌毒素,进而影响人畜健康[5]。除侵染小麦穗部以外,禾谷镰刀菌还可以导致小麦茎基腐病的发生[6]。目前,喷施化学药剂仍然是防治禾谷镰刀菌所致病害的重要措施,但随着化学药剂的长期使用,不仅导致耐药菌株在田间普遍出现,而且还会促进病原菌毒素的合成与积累[2,7-8]。
利用微生物或其代谢产物对植物病害进行生物防治已成为病害综合治理中的重要组成部分,并且对我国农业可持续发展具有重要意义[9-10]。在禾谷镰刀菌的众多生防菌中,芽孢杆菌的研究最为广泛,如枯草芽孢杆菌(Bacillus subtilis)[11]、解淀粉芽孢杆菌(B. amyloliquefacien)[12]、贝莱斯芽孢杆菌(B. velezensis)[13]、多黏类芽孢杆菌(Paenibacillus polymyxa)[14]等对禾谷镰刀菌都具有较好的抑制能力。本研究从田间小麦植株残体上分离到1株对禾谷镰刀菌具有明显拮抗作用的生防菌株ZQT-9,通过对该菌株进行研究,以期为禾谷鐮刀菌所致病害的生物防治提供微生物资源和理论基础。
1 材料与方法
1.1 供试菌株
禾谷镰刀菌(Fusarium graminearum)PH-1菌株,由西北农林科技大学-普渡大学联合研究中心惠赠;链格孢菌(Alternaria alternata)、尖孢镰刀菌(F. oxysporum)、凸脐蠕孢(Exserohilum turcicum)、甜樱间座壳菌(Diaporthe eres)均为笔者所在研究室保藏菌株;多黏类芽孢杆菌(Paenibacillus polymyxa)ZQT-9菌株,分离于田间小麦植株残体。
1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、水1 L。
牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂15 g、水1 L,pH值为7.4~7.6。
羧甲基纤维钠(CMC)培养基:羧甲基纤维素钠15.0 g、酵母提取物1.0 g、MgSO4·7H2O 0.5 g、NH4NO3 1.0 g、KH2PO4 1.0 g、水1 L。
酵母浸出粉胨葡萄糖(YEPD)培养基:酵母提取物3 g、葡萄糖20 g、蛋白胨10 g、水1 L。
1.3 细菌分离
于2019年6月在河南科技学院东区试验田采集小麦植株残体,并于资源与环境学院植物病理学实验室开展后续试验。样品用无菌水冲洗干净后,置于75%乙醇中浸泡3 min,再用无菌水冲洗3遍。处理后的样品放于研钵中研碎,然后将研磨液用 80 ℃ 水浴处理30 min,以杀死大多非芽孢细菌。取100 μL研磨液于牛肉膏蛋白胨培养基平板上涂布,28 ℃培养3 d。最后根据菌落特征挑取不同单菌落,划线纯化后进行后续试验。
1.4 禾谷镰刀菌拮抗细菌的筛选
采用皿内对峙法,将5 mm直径大小的禾谷镰刀菌菌饼接于PDA培养基平板中央,挑取待测细菌接种4点(距中心25 mm处),25 ℃条件下培养3 d后计算抑菌率。以不接禾谷镰刀菌菌饼,只接待测细菌的处理为对照。抑菌率=(对照组菌落直径-试验组菌落直径)/对照菌落直径×100%。
1.5 菌株ZQT-9分类鉴定
1.5.1 形态及生理生化鉴定
具体方法参照《常见细菌系统鉴定手册》进行[15]。
1.5.2 16S rDNA PCR扩增及系统发育分析
以基因组DNA为模板,利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对菌株ZQT-9的16S rDNA进行PCR扩增。扩增产物送至生工生物工程(上海)股份有限公司进行纯化测序。根据测序结果,在GenBank数据库下载相关菌株的16S rDNA序列,用ClustalX 1.83软件比对后,利用Mega 7.0软件采用邻接法构建系统发育树。
1.6 菌株ZQT-9无菌发酵液的获得
挑取菌株ZQT-9单菌落于10 mL牛肉膏蛋白胨液体培养基中,180 r/min、28 ℃条件下培养24 h,之后按照10%接种量2次摇培3 d,获得菌株 ZQT-9 发酵液。将发酵液置于12 000 r/min条件下离心15 min,再将上清液用0.22 μm微孔滤膜过滤,从而获得无菌发酵液。
1.7 菌株ZQT-9无菌发酵液对禾谷镰刀菌的抑制作用
1.7.1 对孢子萌发的影响
挑取禾谷镰刀菌1 cm×1 cm大小菌块于CMC培養基中,150 r/min、25 ℃条件下摇培5 d。培养液用滤布进行过滤,3 500 r/min离心10 min后收集孢子,然后用YEPD培养基重悬浮,并调整孢子浓度为1×106个/mL。按照10%、20%、50%的终浓度加入菌株ZQT-9无菌发酵液,摇培12 h后利用显微镜观察禾谷镰刀菌孢子的萌发情况。以不加菌株ZQT-9无菌发酵液为对照。
1.7.2 对菌丝生长的影响
在9 mL YEPD培养基中加入1 mL禾谷镰刀菌孢子悬浮液,150 r/min、25 ℃ 条件下摇培12 h,以获得菌丝体。之后按照10%、20%、50%的终浓度加入菌株ZQT-9无菌发酵液,摇培24 h后对禾谷镰刀菌的菌丝形态进行显微观察。以不加菌株ZQT-9无菌发酵液为对照。
1.8 菌株ZQT-9抗菌物质的PCR检测
菌株ZQT-9抗菌物质的类别利用已报道的抗菌物质合成相关基因的PCR扩增进行检测,引物序列见表1。
1.9 菌株ZQT-9对不同植物病原真菌的拮抗作用
将直径为5 mm的不同病原真菌菌饼置于PDA培养基平板中央,挑取菌株ZQT-9接种4点(距中心 25 mm 处),25 ℃条件下培养5 d后测量抑菌带宽度。抑菌带宽度为细菌菌落与平板中心方向,细菌菌落边缘至真菌菌落边缘的距离。
2 结果与分析
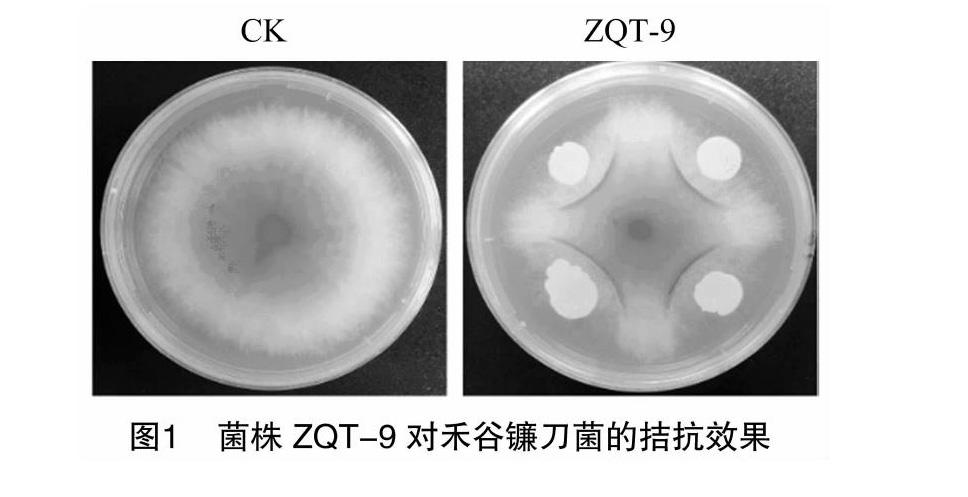
2.1 菌株ZQT-9对禾谷镰刀菌的拮抗效果
将菌株ZQT-9与禾谷镰刀菌PH-1菌株进行皿内对峙培养,结果表明,菌株ZQT-9对禾谷镰刀菌的菌落生长具有较强的抑制作用,抑菌率为(57.6±0.8)%(图1)。
2.2 菌株ZQT-9的分类鉴定
2.2.1 形态特征及生理生化特征
菌株ZQT-9在PDA培养基上的菌落呈乳白色,凸起,表面光滑,边缘规则,具有黏性,菌体杆状,革兰氏染色阳性。生理生化特征鉴定结果表明,菌株ZQT-9能够利用葡萄糖、蔗糖、甘油、甘露醇,不能利用半乳糖,可以水解淀粉和明胶,硝酸盐还原和V-P试验呈阳性,不产生硫化氢(表2)。
2.2.2 16S rDNA 序列分析及系统进化树的构建
以基因组DNA为模板,对菌株ZQT-9的16S rDNA进行PCR扩增,测序后获得1 500 bp左右的序列。经GenBank数据库比对后发现,菌株ZQT-9与多黏类芽孢杆菌(P. polymyxa)多个菌株的16S rDNA序列同源性达99%以上。采用邻接法构建16S rDNA序列系统发育树,结果表明,菌株ZQT-9与P. polymyxa VNRM51、VNRM47、PY7及1178聚类在一起,形成1个分支(图2)。结合形态和生理生化特征,将菌株ZQT-9鉴定为多黏类芽孢杆菌。
2.3 菌株ZQT-9无菌发酵液对禾谷镰刀菌孢子萌发和菌丝生长的抑菌作用
在YEPD中培养12 h后,对照组中的禾谷镰刀菌孢子能够正常萌发,并形成粗细均匀的菌丝。当溶液中分别含有10%、20%浓度的菌株ZQT-9无菌发酵液时,禾谷镰刀菌的孢子可以正常萌发,但是部分芽管生长出现畸形,顶端囊泡化。当菌株ZQT-9无菌发酵液浓度达到50%时,孢子结构出现明显变化,局部膨大变形,并且丧失萌发能力(图3)。分别用10%、20%、50%终浓度的菌株ZQT-9无菌发酵液处理禾谷镰刀菌的菌丝24 h后,不同浓度下禾谷镰刀菌的菌丝生长都出现畸形,顶端囊泡化。而对照组的菌丝能够正常生长(图4)。结果表明,菌株ZQT-9不同浓度的无菌发酵液都可以影响禾谷镰刀菌的孢子萌发及菌丝生长,并且高浓度的无菌发酵液还能够完全抑制孢子的萌发。
2.4 菌株ZQT-9拮抗物质基因的鉴定
利用5对拮抗物质基因的引物对菌株ZQT-9的基因组DNA进行PCR扩增,电泳结果显示,5种基因都被成功扩增(图5)。由此推测,菌株ZQT-9基因组中可能存在水解蛋白酶、β-葡聚糖、多黏菌素B、 多黏菌素C及杀镰孢菌素代谢合成操纵子序列,并产生相应的抗菌物质。
2.5 菌株ZQT-9对不同植物病原真菌的抑制效果
皿内对峙结果表明,菌株ZQT-9对4种植物病原真菌都具有明显的抑制作用,其中对链格孢菌的抑制作用最强,抑菌带宽度为7.6 mm左右。对尖孢镰刀菌、凸脐蠕孢及甜樱间座壳菌的抑菌带宽度均在 4~5 mm之间(表3)。表明菌株ZQT-9具有一定的抑菌谱。
3 结论与讨论
由于缺乏优质抗病品种、扬花期天气高温高湿、秸秆还田及病原菌抗药性的普遍出现,导致近年来我国小麦赤霉病的发生危害日益严重,从而给小麦安全生产带来巨大威胁[3]。另外,小麦茎基腐病的发生也逐渐出现加重的趋势[16]。利用有益微生物对禾谷镰刀菌所致病害进行防治,不仅能够有效减少化学农药的使用,而且符合绿色农业的发展要求。本研究从小麦植株残体上分离得到1株对禾谷镰刀菌具有明显抑制作用的拮抗菌株ZQT-9,综合培养特征、生理生化特性及系统进化分析,将其鉴定为多黏类芽孢杆菌。该菌株的不同浓度无菌发酵液都能够影响禾谷镰刀菌的孢子萌发过程,并且该菌株高浓度的无菌发酵液可以完全抑制禾谷镰刀菌的孢子萌发。另外,该菌株无菌发酵液对禾谷镰刀菌的菌丝生长也具有明显的抑制作用,可以导致菌丝出现畸形。此外,菌株ZQT-9对尖孢镰刀菌等4种植物病原真菌均有较好的抑制效果,说明该菌株具有防治多种病害的潜力。
多黏类芽孢杆菌在自然界分布广泛,不仅可以能够固氮,而且可以产生多种抗菌物质和植物生长素,从而对植物具有很好的防病促生作用[17-19]。研究表明,多黏类芽孢杆菌对大豆疫霉病菌[20]、油菜菌核病病菌[21]、辣椒炭疽病菌[22]、苹果树腐烂病菌[23]、海棠锈病[24]及南方根结线虫[25]等多种病原物都具有拮抗能力。李峰等发现,多黏类芽孢杆菌HB022无菌发酵液可以使禾谷镰刀菌的菌丝出现畸形、断裂等现象;另外,无菌发酵液浓度越高,对禾谷镰刀菌孢子萌发的抑制能力越强,当浓度为20%时就可以完全抑制孢子的萌发[26]。本研究结果表明,多黏类芽孢杆菌ZQT-9无菌发酵液也能够使禾谷镰刀菌的菌丝出畸形,但是只有当ZQT-9无菌发酵液终浓度为50%时才能够完全抑制禾谷镰刀菌孢子的萌发能力。推测造成这一试验结果不同的原因,可能与菌株来源或培养条件不同,从而产生的抑菌物质不同有关。
多黏类芽孢杆菌能够产生植物激素、胞外多糖等多种活性物质,如菌株A26的胞外多糖,尤其是糖醛酸盐的含量在对禾谷镰刀菌的拮抗中起到重要作用[27]。多黏类芽孢杆菌合成脂肽类抗生素是发挥其生防功能的重要原因之一[28]。本研究利用PCR检测发现,菌株ZQT-9具有水解蛋白酶、β-葡聚糖、多黏菌素B、多黏菌素C及杀镰孢菌素代谢合成相关基因,由此推测该菌株可能产生上述几种抗菌物质。
参考文献:
[1]程顺和,张 勇,别同德,等. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报,2012,28(5):938-942.
[2]陈 云,王建强,杨荣明,等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护,2017,43(5):11-17.
[3]黄 冲,姜玉英,吴佳文,等. 2018年我国小麦赤霉病重发特点及原因分析[J]. 植物保护,2019,45(2):160-163.
[4]于思勤,马忠华,张 猛,等. 河南省小麦赤霉病发生规律与综合防治关键技术[J]. 中国植保导刊,2019,39(2):53-60.
[5]Audenaert K,Vanheule A,Hfte M,et al. Deoxynivalenol:a major player in the multifaceted response of Fusarium to its environment[J]. Toxins,2013,6(1):1-19.
[6]张向向,孙海燕,李 伟,等. 我国冬小麦主产省小麦茎基腐镰孢菌的组成及其致病力[J]. 麦类作物学报,2014,34(2):272-278.
[7]黄婷婷. 多菌灵、氰烯菌酯对禾谷镰孢菌DON毒素合成的影响[D]. 南京:南京农业大学,2012:27-59.
[8]张 升,张 伟,王 丽,等. 氨基酸态氮对禾谷镰刀菌生长及DON毒素产生的影响[J]. 江苏农业学报,2020,36(6):1403-1410.
[9]邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010,36(4):15-18,35.
[10]Chen Y,Wang J,Yang N,et al. Wheat microbiome bacteria can reduce virulence of a plant pathogenic fungus by altering histone acetylation[J]. Nature Communications,2018,9(1):3429.
[11]郑小亮,董 超,牛瑞艳,等. 枯草芽孢杆菌Zl-2抗菌蛋白特性及对小麦赤霉病菌的抑制作用[J]. 黑龙江大学自然科学学报,2018,35(2):206-211.
[12]曹 坤,管 明,陈 康,等. 一株拮抗禾谷镰刀菌和降解呕吐毒素解淀粉芽孢杆菌的筛选及在饲料贮存中的应用[J]. 江苏农业科学,2019,47(8):179-183,190.
[13]Palazzini J,Roncallo P,Cantoro R,et al. Biocontrol of Fusarium graminearum sensu stricto,reduction of deoxynivalenol accumulation and phytohormone induction by two selected antagonists[J]. Toxins,2018,10(2):88.
[14]何 露. 小麥赤霉病菌拮抗细菌的筛选及拮抗机理初探[D]. 雅安:四川农业大学,2019:9-44.
[15]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[16]周海峰,杨 云,牛亚娟,等. 小麦茎基腐病的發生动态与防治技术[J]. 河南农业科学,2014,43(5):114-117.
[17]Grady E N,Macdonald J,Liu L,et al. Current knowledge and perspectives of Paenibacillus:a review[J]. Microbial Cell Factories,2016,15(1):203.
[18]Hao T Y,Chen S F. Colonization of wheat,maize and cucumber by Paenibacillus polymyxa WLY78[J]. PLoS One,2017,12(1):e0169980.
[19]汪城墙,戴 莉,刘 凯,等. 多黏类芽孢杆菌脂肽类抗生素合成与分泌机制研究进展[J]. 山东农业科学,2018,50(9):157-163.
[20]王 波,周涧楠,黄忠勤,等. 多黏类芽孢杆菌XZ-2的生物学特性及其对3种大豆病原菌的拮抗作用研究[J]. 西南农业学报,2018,31(6):1197-1202.
[21]祝久香,黎继烈,申爱荣,等. 油菜菌核病病菌拮抗菌的筛选及其生防效果[J]. 中国植保导刊,2019,39(9):11-20.
[22]申顺善,张 涛,王 娟,等. 多黏类芽孢杆菌HK18-8对辣椒炭疽病菌的抑制作用及其定殖能力[J]. 园艺学报,2019,46(3):499-507.
[23]李恩琛,张树武,徐秉良,等. 3株生防细菌间亲和性测定及其对苹果树腐烂病菌的抑制作用[J]. 甘肃农业大学学报,2020,55(5):94-100.
[24]杜 宾,闫 钊. 生防菌株KC24鉴定及发酵液防治海棠锈病效果[J]. 北方园艺,2020(11):19-24.
[25]杨景艳,程万里,曾 立,等. 抗植物病原线虫的多黏类芽胞杆菌KM2501-1发酵培养基和发酵条件优化[J]. 化学与生物工程,2018,35(6):57-63.
[26]李 峰,徐大勇,王光利,等. 一株拮抗赤霉病的小麦内生细菌的筛选和抑菌活性[J]. 生态学杂志,2011,30(8):1738-1743.
[27]Timmusk S,Copolovici D,Copolovici L,et al. Paenibacillus polymyxa biofilm polysaccharides antagonise Fusarium graminearum[J]. Scientific Reports,2019,9(1):662.
[28]Raza W,Shen Y R. Paenibacillus polymyxa:antibiotics,hydrolytic enzymes and hazard assessment[J]. Journal of Plant Pathology,2008,90(3):419-430.

