总胆红素冰冻人血清国家标准品的研制
于 婷, 沈 敏, 曲守方, 孙 楠, 孙 晶, 黄 杰
(1. 中国食品药品检定研究院体外诊断试剂所非传染病诊断试剂室,北京 100050;2. 美康生物参考实验室,浙江 宁波 315104)
胆红素是人体胆汁中的主要色素,由铁卟啉化合物代谢而来,80%由体内被破坏的衰老红细胞释放出的血红蛋白衍化生成。包括直接胆红素、间接胆红素、δ-胆红素。血清总胆红素是新生儿高胆红素血症和肝胆疾病的重要指标[1-2]。胆红素因其独特的分子特性,极易与自由基相结合,因此具有很强的抗氧化性,近年来的许多研究结果均表明其与2型糖尿病微血管并发症的发生、发展密切相关[3-4]。还有研究结果显示,冠状动脉粥样硬化与总胆红素的降低有明显联系[5-6]。因此,准确测定血清总胆红素浓度对于疾病的诊断具有重要意义。由于胆红素很不稳定,容易见光分解,研制和保存都存在一定难度。目前,还没有以人血清为基质的总胆红素国际标准品,我国仅北京航天总医院在2012年曾研制过1批,但数量较少,不能满足市场需求。为解决人血清基质的总胆红素标准品匮乏的现状,保证总胆红素量值溯源稳定可靠,本实验室开展了总胆红素冰冻人血清国家标准品的研制。
1 材料和方法
1.1 主要仪器和试剂
1.1.1 仪器 2XZ-1旋片式真空泵(临海谭氏真空设备公司)。78-1磁力搅拌器(常州国华公司)。XS205DU电子天平、S40 SevenMulti综合测试仪(瑞士梅特勒-托利多公司)。Cary 100 UV-vis分光光度计(美国安捷伦公司)。U-3900H紫外分光光度计、7180全自动生化分析仪(日本日立公司)。
1.1.2 试剂盒 (1)均匀性评价用试剂盒:总胆红素检测试剂盒(化学氧化法,批号171215102,宁波美康生物科技股份有限公司);(2)稳定性评价用试剂盒:总胆红素检测试剂盒(化学氧化法,批号180702101和180608101,宁波美康生物科技股份有限公司);(3)互通性评价用试剂盒:总胆红素检测试剂盒(化学氧化法,批号180702101,宁波美康生物科技股份有限公司);(4)总胆红素测定试剂盒(钒酸盐氧化法;批号18-0730,北京九强生物技术股份有限公司;批号20180612,上海科华生物工程股份有限公司;批号18061201,北京利德曼生化股份有限公司)。
1.2 方法
1.2.1 侯选品的制备 收集外观澄清,无溶血、黄疸和脂血的血清,且人类免疫缺陷病毒抗体、乙型肝炎病毒表面抗原、丙型肝炎病毒抗体和梅毒螺旋体抗体均为阴性;以20 μmol/L为界,合并成2个不同水平的大样(候选品Ⅰ、Ⅱ),混匀后依次进行初滤、0.45 μm滤膜过滤、0.22 μm滤膜过滤。将过滤好的血清分装入1.5 mL棕色冷冻玻璃瓶,0.5 mL/瓶,并于-70 ℃保存。
1.2.2 均匀性评价 按照文献[7-8]进行评价,方法为单因素方差分析法。在候选品分装的前、中、后阶段各抽取15、20和15支,采用7180全自动生化分析仪对抽样进行测定,每支候选品均测定3次。
1.2.3 短期稳定性评价 按照文献[8-9] 进行评价,分别在第1、2、3、5、7、12、20、30 d 8个时间点从候选品Ⅰ、Ⅱ中各随机抽取6支,置于20~25 ℃、2~8 ℃、-20 ℃条件下各2支。8个时间点的取样时间保持一致。采用7180全自动生化分析仪对抽样进行测定,每支候选品测定3次,取平均值,中间穿插测定2个水平质控品。以时间为横坐标,测定值为纵坐标作图,使用Excel 2010软件进行线性拟合回归分析,评价候选品测定值的趋势性变化,并计算斜率(k)、截距(b)和斜率的标准差(sk),计算公式为:
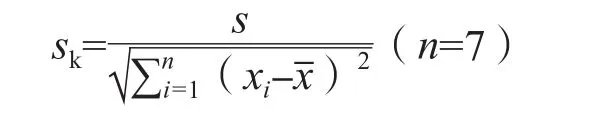
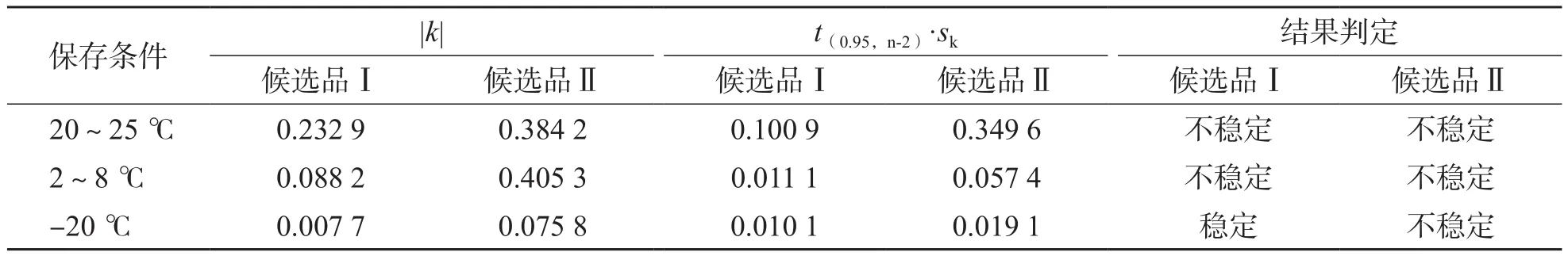
在自由度为n-2,置信水平p=0.95(95%的显著水平)条件下,查t-分布临界值表,得到对应的t(0.95,n-2)值。计算t(0.95,n-2)·sk的值,比较|k|与t(0.95,n-2)·sk的关系,如果|k| 1.2.4 联合定值 选择近3年参加总胆红素项目的参考实验室外部质量评价计划比对或国内参考实验室室间比对,结果达到国际或国内参考实验室及格标准的实验室进行联合定值,且参加实验室数量不少于3家。定值方法均采用检验医学溯源性联合委员会推荐的总胆红素参考测量方法(Doumas法)[10]。实验前采用正确度物质或国际临床化学与检验医学联合委员会-参考实验室外部质量评价计划样本验证本实验室建立的参考测量程序,同时测定质控物质。实验分3批(次),每批(次)依次测定有证标准物质、质控物质、2个水平候选品,每个样本至少测定5次,3批(次)每个样本共收集15个数据。按照以下标准判定数据是否有效:(1)样本测定结果应在范围内,且室内变异系数(coefficient of variation,CV)≤2.0%;(2)质控物质测定结果应在(靶值±3.0%)范围内,且室内CV≤2.0%。(1)中的和s是全部实验室所有结果的和s。不满足要求的数据为无效数据,直接剔除,取各实验室2个水平候选品有效数据的,合并计算总,作为该样本的最终靶值。由于本研究制备的2个水平候选品浓度较低,当因反应灵敏度不够高导致检测出现偏差时,采用低浓度样本检测方法[10]。 1.2.5 不确定度评估 以Guide to the Expression of Uncertainty in Measurement(GUM)为基础,按照文献[9]要求进行不确定度评估。不确定度来源包括定值、均匀性和稳定性3部分,候选品的合成标准不确定度(uCRM)计算公式为: 式中uchar为定值引起的标准不确定度,ubb为均匀性引起的标准不确定度,us为稳定性引起的标准不确定度。 1.2.6 互通性评估 参照文献[11],采用参考方法和常规方法(美康公司试剂盒、九强公司试剂盒、科华公司试剂盒和利德曼公司试剂盒分别与7180全自动生化分析仪组成4个常规系统)同时对选定的一系列具有代表性的40份临床样本[7-8]和候选品进行分析。以参考方法测定临床样本的值为X轴,以常规方法测定临床样本的值为Y轴,采用Origin 8.0软件绘制散点图,并确定95%可信区间。如果常规方法测定候选品的在该区间内,说明该候选品对常规方法无基质效应,表明其在参考方法和常规方法间具有互通性。 单因素方差分析结果显示,候选品Ⅰ、Ⅱ的F值均 表1 总胆红素侯选品均匀性评价结果 30 d稳定性评价结果显示,候选品Ⅰ在20~25 ℃和2~8 ℃下放置30 d均不稳定,但在-20 ℃下可稳定30 d;候选品Ⅱ在3种温度条件下放置30 d均不稳定;见表2。减少时间点数重新分析结果显示,候选品Ⅰ在20~25 ℃条件下只在当天稳定,2~8 ℃条件下,可稳定3 d(|k|=0.106 7,t(0.95,n-2)·sk=0.323 3);候选品Ⅱ 20~25 ℃条件下只在当天稳定,2~8 ℃条件下可稳定2 d(|k|=0.800 0,t(0.95,n-2)·sk=2.078 5),-20 ℃条件下可以稳定5 d(|k|=0.072 3,t(0.95,n-2)·sk=0.154 4)。根据以上结果,又开展了候选品Ⅰ、Ⅱ 20~25 ℃条件下24 h稳定性研究,结果显示,从-70 ℃取出后,在20~25 ℃条件下,候选品Ⅰ能稳定6 h,候选品Ⅱ能稳定4 h,见表3。 表2 总胆红素候选品30 d稳定性评价结果 表3 总胆红素候选品20~24 ℃条件24 h稳定性分析结果 有3家实验室参加联合定值,共得到独立的4组数据。总胆红素候选品Ⅰ、Ⅱ定值结果的实验室内CV均<1.0%,表明各实验室建立的参考方法重复性好、数据可靠。联合定值结果见表4。 表4 总胆红素候选品联合定值结果 μmol/L 2.4.1 定值引入的不确定度 定值引入的不确定度计算公式为: 式中s为所有实验室测定值的总s,p为实验室数。候选品Ⅰ、Ⅱ定值引入的不确定度分别为0.028 7、0.087 8 μmol/L。 2.4.2 均匀性引入的不确定度 根据表1中的方差分析结果,候选品Ⅰ均匀性引入的不确定度的计算公式为: 式中n为(有效)单元数,vwithin为组内均方的自由度。候选品Ⅱ均匀性引入的不确定度的计算公式为: 候选品Ⅰ、Ⅱ均匀性引入的不确定度分别为0.053 2、0.082 2 μmol/L。 2.4.3 稳定性引入的不确定度 稳定性引入的不确定度计算公式为: 式中sk为稳定性数据经线性拟合得到的方程的斜率的s,X为候选品的有效期。候选品稳定性引入的不确定度结果见表5。 表5 总胆红素候选品稳定性引入的不确定度 2.4.4 合成不确定度 根据候选品的定值、均匀性和稳定性引入的不确定度计算出候选品Ⅰ、Ⅱ的合成不确定度分别为0.141 5、0.270 7 μmol/L。经联合定值和不确定度评估,候选品Ⅰ、Ⅱ定值结果分别为(7.01±0.28)μmol/L(k=2)、(27.10±0.54)μmol/L(k=2)。 采用参考方法和4个不同常规方法对40份新鲜血清样本同时进行测定,利用临床样本测定结果得到线性回归方程,通过参考方法测定值的计算候选品的95%可信区间。结果显示,候选品常规方法测定值均可在该区间范围内,表明侯选品具有良好的互通性。见图1。 图1 总胆红素候选品4种常规方法互通性评估 临床上血清总胆红素的检测方法主要有重氮法、化学氧化法/钒酸盐氧化法、氧化酶法等。我国具有医疗器械注册证的总胆红素检测试剂盒超过200个,各品牌试剂盒因溯源途径、校准品基质、试剂组分来源等不尽相同,测定值之间存在一定差异。在这种情况下,通过各种方式促进总胆红素检测的标准化具有非常重要的意义。标准物质是实现检测结果准确、具有可比性的重要工具,也是保证量值传递的计量实物标准,故本实验室开展了总胆红素国家标准品的研制。 众所周知,不同基质来源的同一浓度样本,测定结果差异可能非常大,所以在制备标准物质的时候,应尽量采用与实际应用相同的基质。本实验室采用的是人源血清基质,未添加任何抗菌药物和防腐剂,因此候选品的互通性结果良好。均匀性、稳定性和定值准确是标准物质的三大特征。本研究制备的标准品经均匀性评估,显示候选品均匀性良好。在稳定性方面,因胆红素具有易见光分解的特性,在研制初期,我们筛选出合格血清后,-70 ℃避光静置1个月以上,待测定值稳定后分装,再进行后续研究。即便如此,本研究短期稳定性评价结果也验证了胆红素的不稳定性,尤其是20~25 ℃ 30 d的测定值呈现明显下降趋势;故本研究又开展了24 h的稳定性分析,结果表明,在20~25 ℃条件下,候选品Ⅰ能稳定6 h,候选品Ⅱ能稳定4 h。而通常来说,无论是参考方法,还是常规方法,血清中总胆红素的检测均可在30 min或者更短时间内完成,故该批候选品稳定性依然是满足要求的。但是,需告知临床实验室在使用前避光恢复至20~25 ℃,充分混合后,务必在4 h内完成检测。为了确保候选品的量值准确,本实验室缩短了候选品长期稳定性的评估间隔,以便及时监测到该候选品的稳定性变化。该候选品的定值采用的是参考方法,各实验室在定值前均要验证所建立方法的准确性,确保总胆红素检测能力的稳定,最终的定值结果令人满意,且各实验室内部的CV均<1.0%,表明重复性较好,数据可靠。 综上所述,本实验室研制的总胆红素候选品均匀性、互通性良好,定值结果准确,稳定性满足要求,可以作为国家标准品使用。这批标准品将主要用于总胆红素常规方法的校准和正确度评价,以保障对总胆红素体外诊断试剂的监管。同时,也将促进临床血清总胆红素检测结果的互认。
2 结果
2.1 均匀性评价结果

2.2 稳定性评价结果

2.3 联合定值结果

2.4 不确定度评估


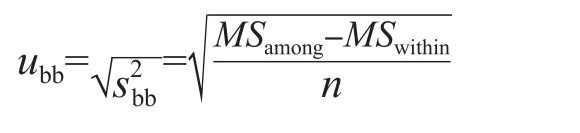


2.5 互通性评估

3 讨论

