响应面法优化洋紫荆花瓣花色苷提取工艺及其抗氧化活性
杨晓娜 陈自宏 姜龙云 徐 玲 谢雯颖 赵海云
(1 保山学院资源环境学院 云南保山 678000 2 大理州食品检验检测院 云南大理 67100)
洋紫荆(Bauhinia variegata)为苏木科羊蹄甲属半落叶乔木,是一种良好的观赏和蜜源植物[1]。在中国主要分布在福建、广东、广西、云南等地,同时还分布于越南、印度、古巴等地,且世界各国均有栽培[2]。洋紫荆花瓣较大,颜色鲜艳,略微带芳香味,花期为每年11月至次年4月,常作为行道树种植在道路旁,其自然飘落的花瓣,经常作为垃圾废弃,浪费了宝贵的天然色素资源。因此,挖掘洋紫荆花色苷的提取工艺,探究其抗氧化活性,对于开发新型染料,提高洋紫荆的综合利用具有重要意义。
花色苷属于黄酮类物质,存在于植物的果实、根、茎、叶、花等器官中。其作为一种天然食用色素,安全、无毒、资源丰富,具有一定的营养和药理作用,在食品、化妆品和医药领域有着巨大应用潜力[3]。花色苷对人体具有许多保健功能,例如,清除体内自由基、抗肿瘤、抗癌、抗炎、抑制脂质过氧化和血小板凝集、预防糖尿病、减肥、保护视力等[4]。国内、外对洋紫荆的研究主要集中在生物学特性[5]、种子繁殖[6-8]、无性繁殖[9-10]、观赏价值及药用价值[11-14]等方面。羊蹄甲属的红花羊蹄甲花瓣中的花色苷的提取方法包括有机溶剂法、微波法及超声波法,均以吸光度为评价指标。而以洋紫荆为实验材料,以花色苷含量为指标,且运用响应面优化花色苷提取工艺及抗氧化活性的研究鲜有报道。本研究采用有机溶剂法提取洋紫荆花瓣中的花色苷,讨论乙醇体积分数、料液比、提取温度和提取时间对花色苷含量的影响,通过单因素方差分析建立花色苷含量与单因素之间的关系,通过响应面法进行优化,同时对洋紫荆花色苷进行体外抗氧化能力分析。既能丰富和完善响应面法优化植物花色苷提取工艺的研究,又能促进天然色素的开发和利用,为实现洋紫荆综合利用奠定基础。
1 材料与方法
1.1 实验用品
材料:洋紫荆(花期为11月至次年4月)花瓣,材料来源于保山市潞江坝。将洋紫荆花瓣置于室内阴凉处自然晾干,粉碎机粉碎,分别过100 目、80 目、60 目、40 目、20 目筛,装袋封存,避光备用。
主要试剂:无水乙醇、醋酸钠、氯化钾、盐酸、乙酸、蒸馏水、邻苯三酚、硫酸亚铁、过氧化氢、双氧水等均为分析纯(国药集团化学试剂有限公司)。
主要实验仪器:XBLL-25Ak 快乐小贝食品料理机(上海帅佳电子科技有限公司)、标准筛(浙江上虞市道墟五四仪器厂)、CP114 电子分析天平[奥豪斯仪器(上海)有限公司]、UV-5100 紫外/可见分光光度计(安徽皖仪科技股份有限公司)。
1.2 实验方法
1.2.1 洋紫荆花色苷最大吸收波长的确定方法单因素的固定条件为浸泡时间2 h、提取剂的浓度为0.1%盐酸-乙醇溶液(乙醇体积分数60%)、提取时间40 min、提取温度40℃、筛目60 目、料液比1∶30 g/mL。准确称取筛目为60 目的洋紫荆花瓣粉末样品1 g,按照料液比为1∶30 g/mL 浸没洋紫荆花瓣粉末,浸泡2 h。2 h 后转移至温度为40℃的水浴锅中提取40 min,将提取液抽滤,得到花色苷粗提液。用紫外/可见分光光度计检测可见光区花色苷的最大吸收波长。
1.2.2 洋紫荆花色苷含量的测定方法 采用pH示差法测定花色苷含量[15]。取1 mL 的洋紫荆花色苷提取液,分别用0.025 mol/L 盐酸-氯化钾缓冲液(pH=1.0)和0.4 mol/L 醋酸钠缓冲液(pH=4.5)稀释至50 mL,避光放置20 min 后,在λmax(λ536 nm)和λ700 nm处测定吸光度值(A)。并按以下公式计算花色苷的含量。
花色苷含量:X=(ΔAVnM)/(εmL)
式中,ΔA=[Aλmax(pH=1.0)-Aλ700nm(pH=1.0)]-[Aλmax(pH=4.5)-Aλ700nm(pH=4.5)];M为矢车菊素-3-葡萄糖苷的摩尔质量449 g/mol;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数26 900 L/(mol·cm);V为稀释后的总体积(mL);n为稀释倍数(5 倍);m为红花样体积花瓣粉末质量(g);L为比色皿厚度1 cm。
1.2.3 浸泡时间对洋紫荆花色苷含量的影响准确称取5 份筛目为60 目的洋紫荆花瓣粉末各1 g,提取剂的浓度为0.1%盐酸-乙醇溶液(乙醇体积分数为60%),料液比为1∶30 g/mL,浸泡时间梯度分别设置为0 h、1 h、2 h、3 h、4 h,提取温度40℃,提取时间40 min。提取液抽滤并用pH 示差法计算花色苷的含量。按上述方法,重复3 次。
1.2.4 筛目对洋紫荆花色苷含量的影响 分别称取筛目为100 目、80 目、60 目、40 目、20 目的洋紫荆花瓣粉末各1 g,提取剂的浓度为0.1%盐酸-乙醇溶液(乙醇体积分数为60%),料液比为1∶30 g/mL,浸泡2 h,提取温度40℃,提取时间为40 min。提取液抽滤并用pH 示差法计算花色苷的含量。按以上所描述的方法,重复3 次。
1.2.5 乙醇体积分数对洋紫荆花色苷含量的影响 准确称取5 份筛目为60 目的洋紫荆花瓣粉末各1 g,提取剂的浓度为0.1%盐酸-乙醇溶液,提取剂中乙醇的浓度配比分别设置为20%、40%、60%、80%、100%,料液比为1∶30 g/mL,浸泡2 h,提取温度40℃,提取时间40 min。提取液抽滤并用pH 示差法计算花色苷的含量。按上述方法,重复3 次。
1.2.6 提取温度对洋紫荆花色苷含量的影响准确称取5 份筛目为60 目的洋紫荆花瓣粉末各1 g,提取剂的浓度为0.1%盐酸-乙醇溶液(乙醇体积分数为60%),料液比为1∶30 g/mL,浸泡2 h,提取温度分别设置成20℃、40℃、60℃、80℃、100℃,提取时间40 min。提取液抽滤并用pH 示差法计算花色苷的含量。按上述方法,重复3 次。
1.2.7 料液比对洋紫荆花色苷含量的影响 准确称取5 份筛目为60 目的样品各1 g,提取剂的浓度为0.1% 盐酸-乙醇溶液(乙醇体积分数为60%),料液比分别设置为1∶10 g/mL、1∶20 g/mL、1∶30 g/mL、1∶40 g/mL、1∶50 g/mL,浸泡2 h,提取温度40℃,提取时间40 min。提取液抽滤并用pH 示差法计算花色苷的含量。按上述方法,重复3 次。
1.2.8 提取时间对洋紫荆花色苷含量的影响准确称取5 份筛目为60 目的样品各1 g,提取剂的浓度为0.1%盐酸-乙醇溶液(乙醇体积分数为60%),料液比为1∶30 g/mL,浸泡2 h,提取温度为40℃,提取时间分别设置为20 min、40 min、60 min、80 min、100 min。提取液抽滤并用pH 示差法计算花色苷的含量。按上述的方法,重复3 次。
1.2.9 响应面法优化洋紫荆花瓣花色苷的实验方法 根据所得到的单因素的结果,利用Box-Behnken 中心组合实验设计原理,选取4 因素乙醇体积分数、料液比、提取时间、提取温度进行响应面实验的设计,自变量设置成3 个水平值:-1、0、1,以洋紫荆花色苷含量为响应值,利用Design-Expert V 8.0.6.1 软件进行数据拟合,进一步优化确定洋紫荆花色苷提取的最佳工艺参数,验证后的花色苷提取液进行体外抗氧化性分析。
1.3 抗氧化能力测定方法
1.3.1 超氧阴离子自由基清除能力测定 参照邻苯三酚法测定[16]。取6 支试管,加入0.05 mol/L Tris-HCl 缓冲液(pH=8.2)4 mL,置于25℃水浴中预热20 min,分别加入不同浓度的色素溶液2 mL,再加入3 mmol/L 邻苯三酚1 mL,在5 ℃水浴中反应5 min,立即加入3 滴10 mol/L HCl 终止反应,以Tris-HCl 缓冲液作空白,测325 nm 处吸光度A0。以VC(维生素C)作为阳性对照,按下式计算清除率。
清除率=[A0-(A1-A2)]/A0×100%
式中,A0为不加色素溶液的吸光度,A1为加入色素溶液后的吸光度,A2为不加邻苯三酚的吸光度。
1.3.2 羟基自由基清除能力测定 采用水杨酸法进行测定[17]。取6 支试管,分别加入8 mmol/L FeSO41 mL、5 mmol/L 水杨酸-乙醇溶液2 mL 和不同浓度的色素溶液2 mL,最后加入0.3% H2O21 mL 反应0.5 h,测510 nm 处吸光度。以VC 作为阳性对照,按下式计算清除率。
清除率=[A0-(A1-A2)]/A0×100%
式中,A0为不加色素溶液的吸光度,A1为加入色素溶液后吸光度,A2为不加H2O2的吸光度。
2 结果分析
2.1 洋紫荆花瓣花色苷可见光谱特征 由图1可知,将洋紫荆花色苷的提取液,在紫外/可见分光光度计400~650 nm 范围进行波长的扫描后,在可见光区536 nm 处峰值最高。唐佳丽[18]以黑树莓为原材料提取花色苷,其光谱特征表明,黑树莓花色苷在518 nm 处有最大吸收波长;赵垒[19]以平阴玫瑰为原材料提取花色苷,光谱特征表明,平阴玫瑰花色苷在520 nm 处有最大吸收波长。经查阅文献,花色苷及其色素元在可见光465~550 nm 波长范围内有吸收峰[20]。由此可判断洋紫荆色素属花色苷[21]。
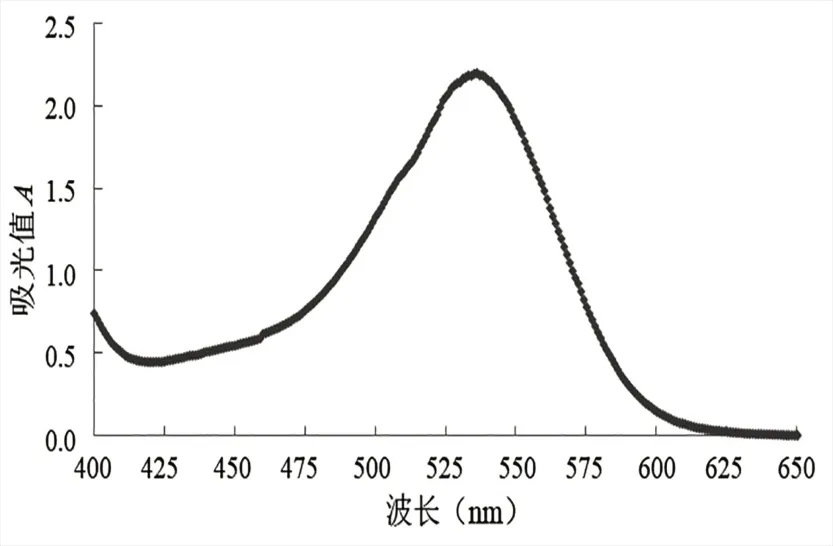
图1 洋紫荆花瓣花色苷吸收光谱图
2.2 各单因素对洋紫荆花瓣花色苷含量的影响
2.2.1 浸泡时间对洋紫荆花瓣花色苷含量的影响 由图2 可知,浸泡时间在0~3 h 时,花色苷的含量随着浸泡时间的增加呈现增长的趋势,浸泡时间为3 h 时,花色苷含量达到最大,此时花色苷的含量为1.835 mg/g。当浸泡时间超过3 h 后,花色苷的含量呈现下降的趋势,这可能是因为浸泡时间达3 h 时,就已将花色苷完全提取出,继续增加浸泡时间,可能会将多糖等可溶性物质溶解出,从而影响花色苷的含量。通过单因素方差分析,得出洋紫荆花色苷最佳浸泡时间为3 h。
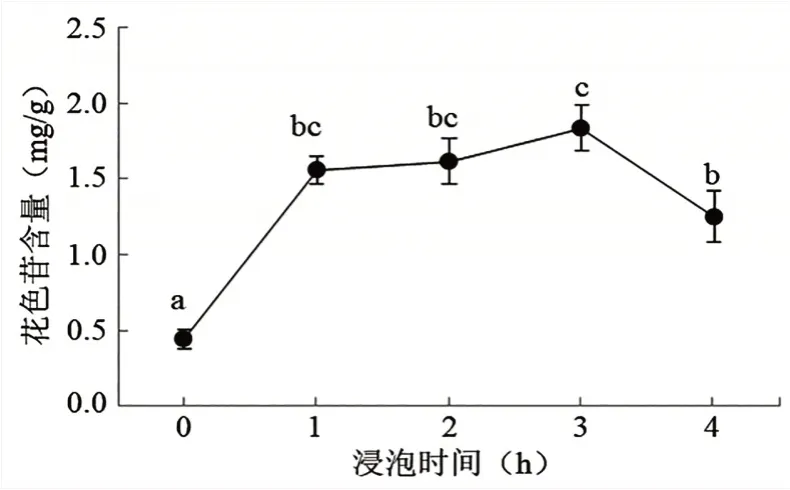
图2 不同浸泡时间对洋紫荆花色苷含量的影响(平均值±标准差)
2.2.2 筛目对洋紫荆花瓣花色苷含量的影响由图3 可知,当筛目为20~60 目时,花色苷的含量随着筛目的增加呈现增长的趋势,且筛目为60 目时,花色苷含量达到最大,此时花色苷的含量为1.618 mg/g。但超过60 目后,随着筛目数的增加,花色苷含量逐渐下降。这可能是因为随着筛目增加,导致花瓣粉末的颗粒直径逐渐变小,与提取剂的接触面积变大,导致在浸提过程中其他物质被溶解出,影响了花色苷含量的测定。通过单因素方差分析,得出洋紫荆花色苷最佳筛目为60 目。
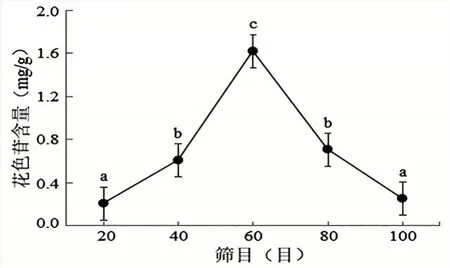
图3 不同筛目对洋紫荆花色苷含量的影响(平均值±标准差)
2.2.3 乙醇体积分数对洋紫荆花瓣花色苷含量的影响 由图4 可知,在20%~40%之间,洋紫荆花色苷含量随乙醇体积分数增大而增大,且在乙醇体积分数为40%时到达最大值,此时花色苷的含量为1.789 mg/g。乙醇体积分数超过40%后,花色苷含量随乙醇体积分数增大而减小,产生这样的原因可能是乙醇体积分数较大从而导致其他物质成分,例如,多糖被溶解出,而影响了花色苷含量。通过单因素方差分析,得出洋紫荆花色苷最佳乙醇体积分数为40%。
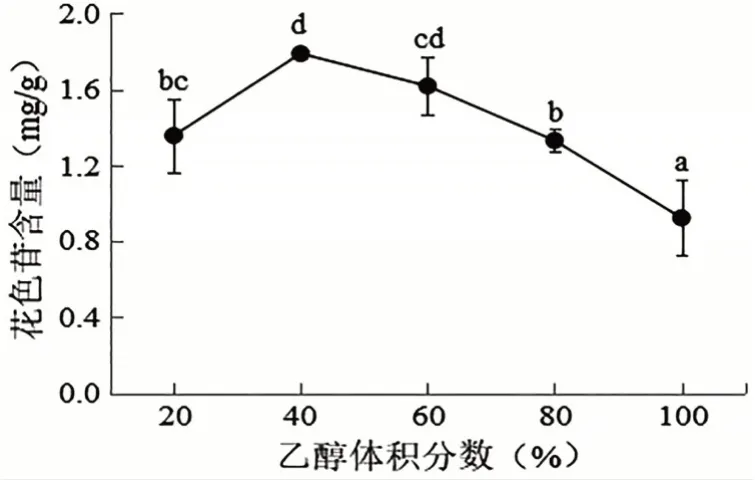
图4 不同乙醇体积分数对洋紫荆花色苷含量的影响(平均值±标准差)
2.2.4 提取温度对洋紫荆花色苷含量的影响由图5 可知,在20~40℃时,随着提取温度升高,花色苷含量增大,且在40℃时达到最大值,此时花色苷的含量为1.672 mg/g。但超过40℃后,花色苷含量就随着温度的增大而逐渐降低,导致此现象的原因可能是由于温度逐渐升高,导致花色苷不稳定,结构降解,进而影响花色苷含量。通过单因素方差分析,得出洋紫荆花色苷最佳提取温度为40℃。
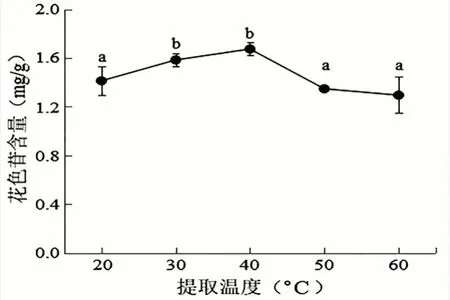
图5 不同提取温度对洋紫荆花色苷含量的影响(平均值±标准差)
2.2.5 料液比对洋紫荆花瓣花色苷含量的影响由图6 可知,在料液比为(1∶10)~(1∶30)g/mL 时,花色苷含量随料液比减小而增大,且在料液比为1∶30 g/mL 时,花色苷含量达到最大,此时花色苷的含量为1.624 mg/g。但低于1∶30 g/mL 后,花色苷的含量随料液比的减小而降低,这可能是因为随着料液比逐渐降低,提取液浓度逐渐下降,进而影响了花色苷的含量。通过单因素方差分析,得出洋紫荆花色苷最佳料液比为1∶30 g/mL。
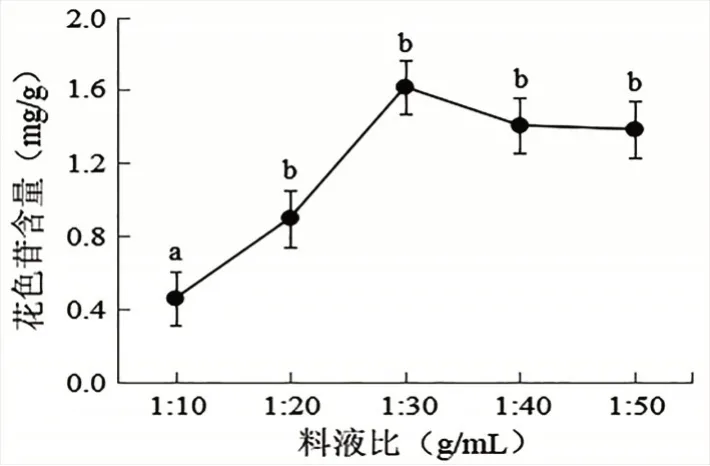
图6 不同料液比对洋紫荆花色苷含量的影响(平均值±标准差)
2.2.6 提取时间对洋紫荆花瓣花色苷含量的影响 由图7 可知,在20~60 min,花色苷含量随提取时间的增加而增大,且在提取时间为60 min时,花色苷含量达到最大,此时花色苷的含量为1.618 mg/g。但超过60 min 后,花色苷的含量随提取时间的增加而降低,这可能是因为时间延长导致其他物质溶解出,影响了花色苷的含量。通过单因素方差分析,得出洋紫荆花色苷最佳提取时间为60 min。
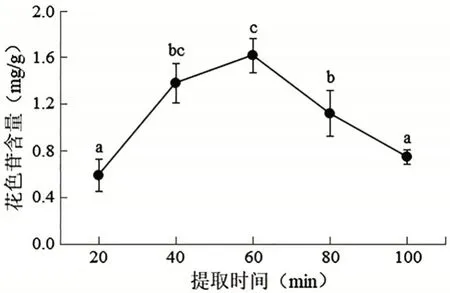
图7 不同提取时间对洋紫荆花色苷含量的影响(平均值±标准差)
2.3 响应面优化洋紫荆花色苷提取结果与分析
2.3.1 响应面分析因素水平的选取 根据中心组合实验设计原理,结合单因素实验的结果分析表明,由于筛目和浸泡时间对洋紫荆花色苷含量影响较小,故在使用响应面优化工艺时,选取4 个因素,分别为乙醇体积分数、料液比、提取时间、提取温度作为工艺优化的因素,以含量为响应值,利用Design-Expert V 8.0.6.1 软件进行数据拟合,实验因素水平见表1。

表1 响应面分析因素及水平
2.3.2 响应模型的建立与分析 利用Box-Behnken 设计响应面分析,确定最佳的提取工艺条件。利用Design-Expert V8.0.6.1 软件进行回归拟合。以乙醇体积分数、料液比、提取时间、提取温度为自变量,以花色苷含量为响应值,根据Box-Benhnken 实验设计原理设计4 因素3 水平共29 组响应面分析实验,实验设计及结果见表2。
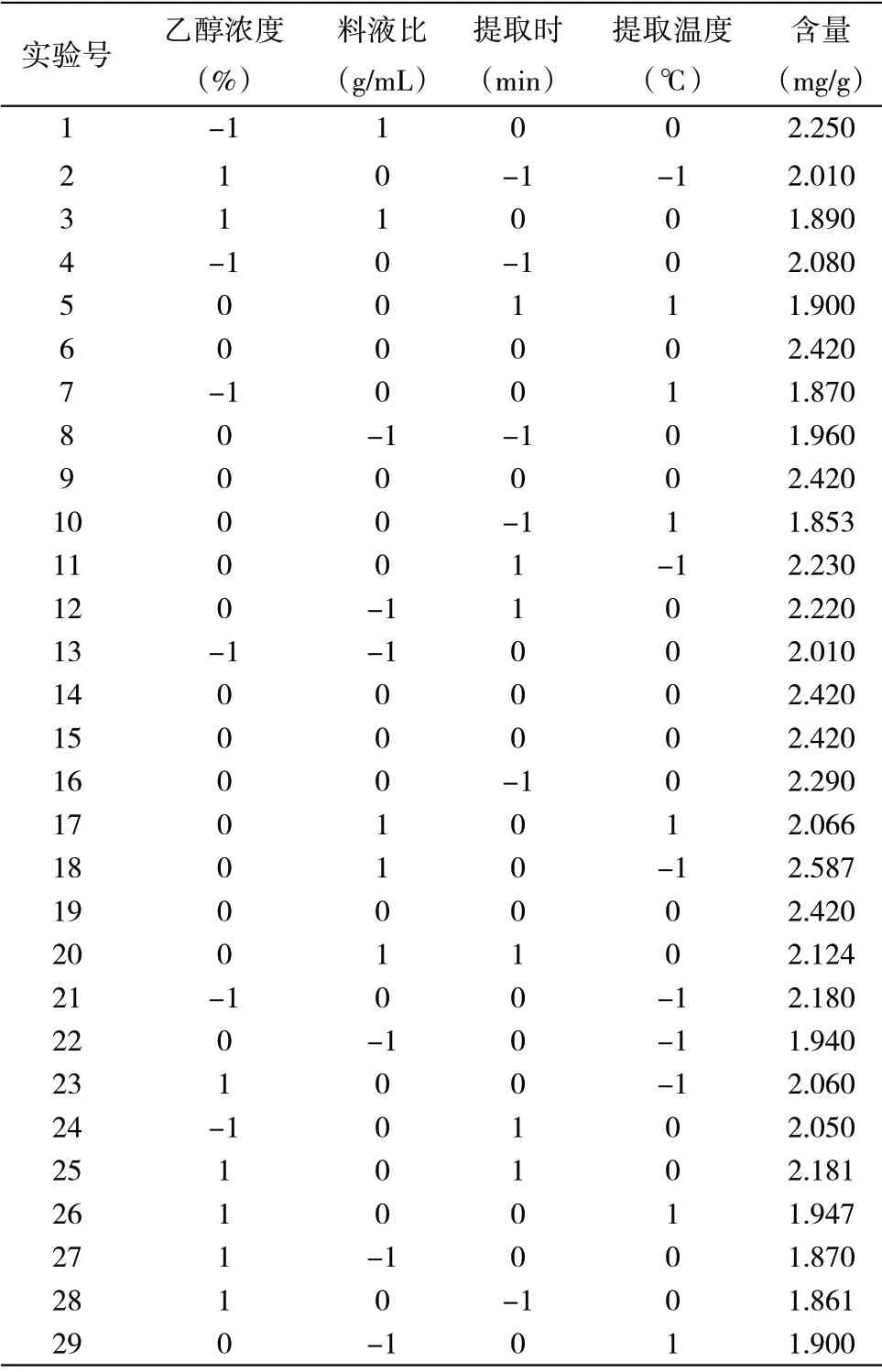
表2 响应值实验设计及结果
由表3 可知,B、D、A2、C2、D2对响应面的影响达到极显著水平,C、B2达到显著水平。4 因素两两交互项AC、BC、BD 的P<0.05,说明乙醇体积分数和提取时间、料液比和提取时间、料液比和提取温度的交互作用影响显著。从整体分析,模型的P<0.0001,表明该二次多项回归模型达到极显著水平。R2=0.9532,R2 Adj=0.9065,C.V=3.03%,说明方程对实验拟合较好。回归系数显著性检验表明,在所选取的各因素水平范围内,对洋紫荆花瓣花色苷含量影响排序为:料液比>提取温度>提取时间>乙醇体积分数。
2.3.3 各因素交互作用对花色苷含量的影响 等高线图可直观地反映2 个变量交互作用的影响程度,圆形表示2 因素交互作用不显著,而椭圆形与之相反。由图8 可知,乙醇体积分数与料液比之间交互作用较弱,料液比对花色苷含量的影响略大于乙醇体积分数。乙醇体积分数与提取时间之间交互作用显著,提取时间对花色苷含量变化的影响较大,表现为响应面图曲线较陡和等高线较密集。乙醇体积分数与提取温度之间交互作用较弱,提取温度对花色苷含量的影响略大于乙醇体积分数。料液比与提取时间之间具有显著的交互作用,料液比对花色苷含量变化的影响较大。料液比与提取温度之间具有显著的交互作用,料液比对花色苷含量变化的影响较大。提取时间与提取温度之间交互作用较弱,提取温度对花色苷含量的影响略大于提取时间。以上结果均与表3 回归分析结果吻合。
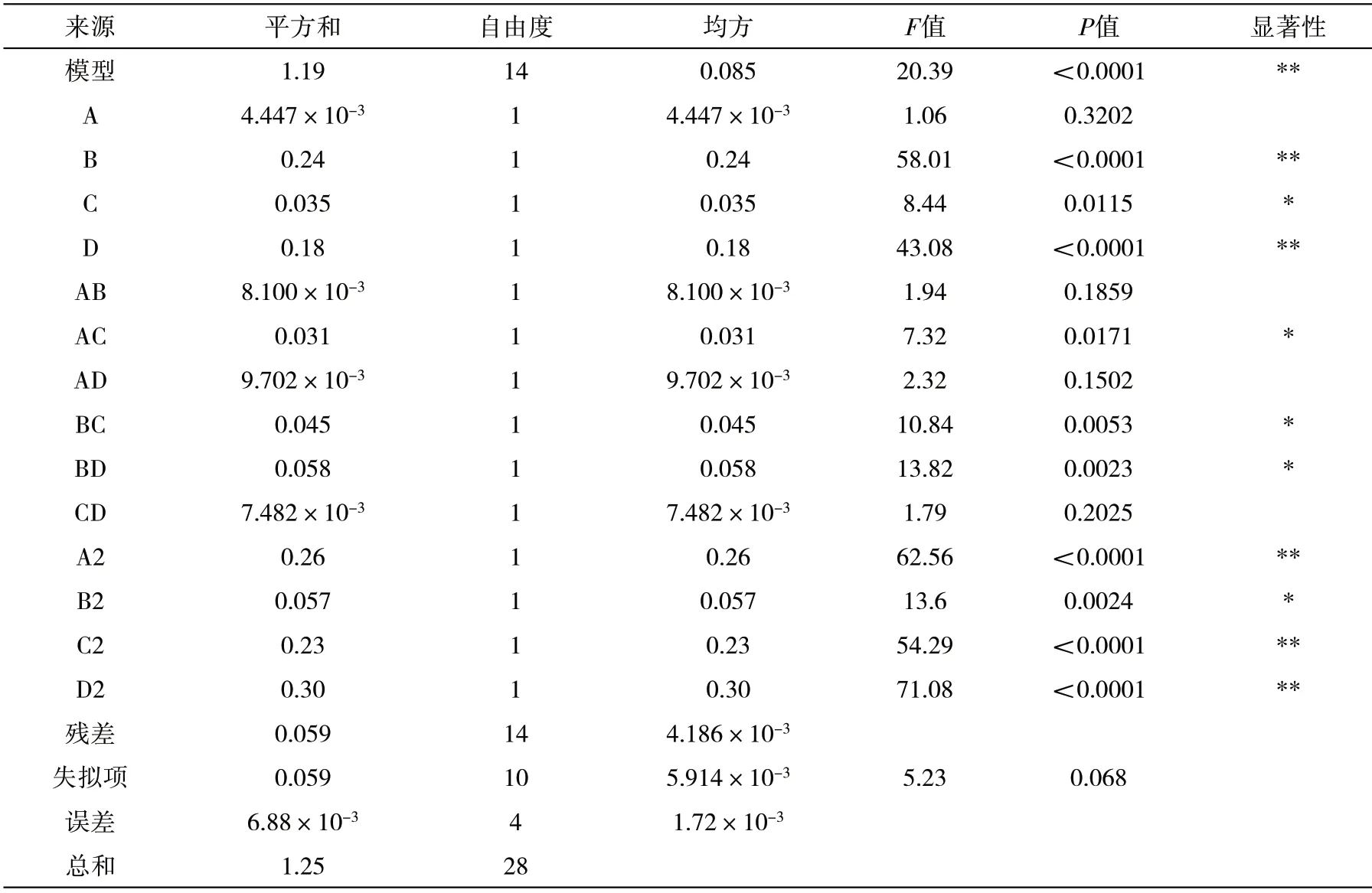
表3 二次响应面回归模型方差分析
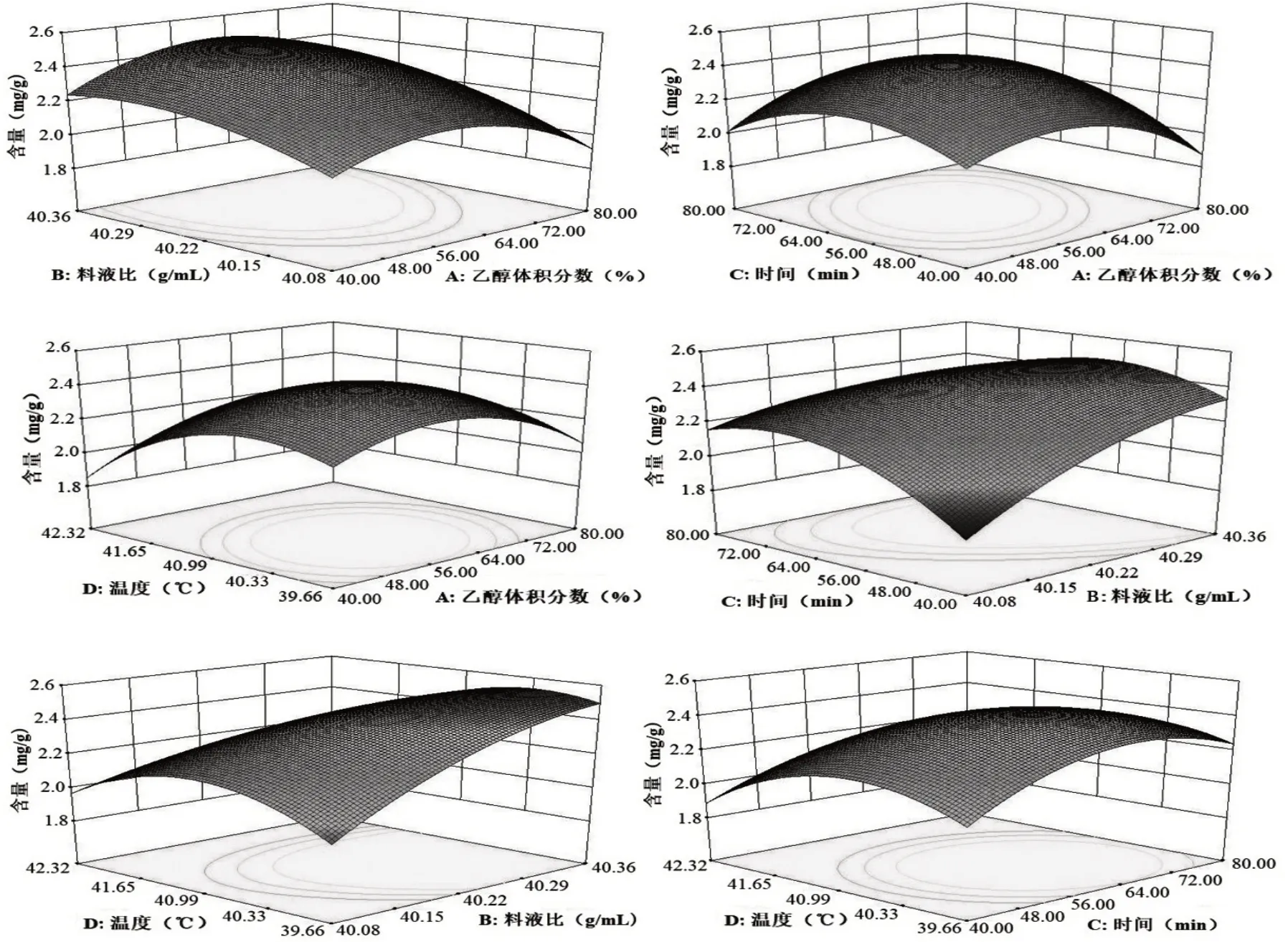
图8 各因素交互作用对花色苷含量影响的响应面图
2.4 洋紫荆花色苷提取工艺优化及验证结果 利用Design-Expert V 8.0.6.1 软件对实验数据优化预测,进一步确定提取条件工艺最佳条件,得到花色苷的提取最佳工艺条件为筛目60 目、浸泡时间3 h、提取温度20℃、料液比1∶50 g/mL、提取时间60 min、乙醇体积分数40%,预测得到洋紫荆花色苷提取量为2.547 mg/g,实际测得的花色苷含量为2.587 mg/g,与理论预测值符合度较高。因此,采用上述最适宜工艺条件进行验证实验,实际洋紫荆花色苷的提取工艺条件参数准确可靠。
2.5 洋紫荆花色苷抗氧化活性分析
2.5.1 花色苷对超氧阴离子自由基的清除作用通过邻苯三酚法对洋紫荆花色苷清除超氧阴离子自由基进行实验,结果见图9。由图可知,洋紫荆花色苷和VC 对超阴离子的清除率均随浓度的增加而增大,浓度低于1.5 mg/mL 时,VC 的清除效果优于洋紫荆羊蹄甲花色苷,当浓度超过1.5 mg/mL 时,花色苷的清除效果基本与VC 相当。实验结果表明,洋紫荆花色苷对超氧阴离子自由基的清除有较好的效果。花色苷结构中具有多个酚羟基,属于羟基供体,与游离的自由基结合形成稳定的自由基,阻碍了自由基发生链式反应[22]。
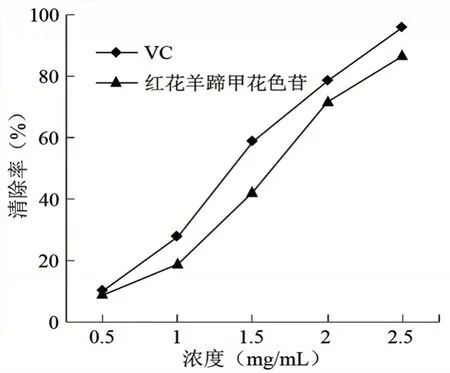
图9 VC 和花色苷对超氧阴离子自由基的清除率曲线
2.5.2 花色苷对羟自由基的清除作用 羟自由基清除法对洋紫荆花色苷的清除效果见图10。分析图10 可知,花色苷对羟基自由基的清除作用,随浓度的增加其清除能力增强,当浓度低于1.0 mg/mL 时,花色苷的清除效果基本与VC 相近,当浓度高于1.0 mg/mL 时,VC 的清除效果优于花色苷。虽然花色苷对羟基自由基的清除效果略低于VC,但对羟基自由基仍有一定的清除作用。
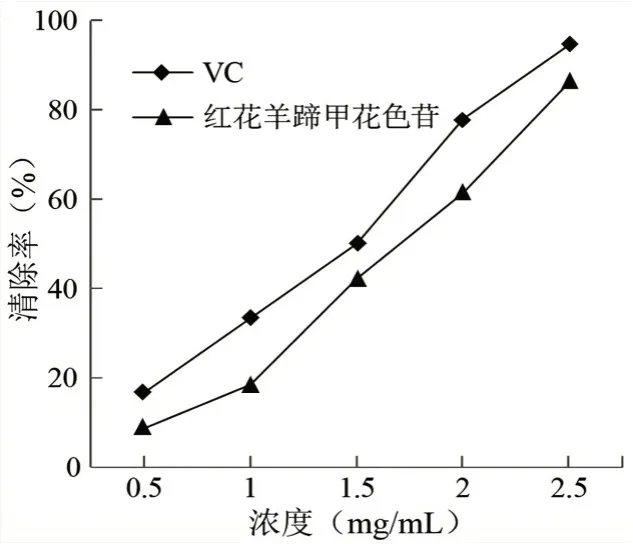
图10 VC 和花色苷对羟自由基的清除率曲线
3 讨论与结论
花色苷是花青素与糖以糖苷键结合而成的一类化合物,属酚类化合物中的类黄酮,是构成花瓣、果实等颜色的主要水溶性色素;花色苷作为一种天然食用色素,安全、无毒、资源丰富,且具有一定的营养和药理作用,在食品、化妆品和医药领域有着巨大应用潜力[3,23]。影响花色苷稳定性的因素有很多,pH 值、氧气、温度、花色苷浓度和结构、光、金属离子、酶,以及其他辅助因素等均能使花色苷的颜色产生变化[24],目前还没有标准化的提取方法。传统的花色苷提取工艺研究用单因素结合正交法,但随着科技的发展,目前主要采用单因素结合响应面进行论证提取工艺。洋紫荆是羊蹄甲属植物,对洋紫荆色素的研究鲜有报道,但同为羊蹄甲属的红花羊蹄甲色素的研究已有报道[25-27]。前人在对红花羊蹄甲花色苷提取工艺的研究中,主要以最大吸收波长下的吸光值为指标,用正交法探讨花色苷的提取工艺。通过与已有研究结果进行比较发现,本实验以含量为指标,在进行提取工艺的研究中,对单因素条件的考虑较为周全,并且采用了响应面的方法分别进行可交互作用的分析,同时进行优化工艺的实际验证,与理论预测值相差不大。在抗氧化活性方面,李容等[28]从超氧阴离子自由基清除能力、羟自由基清除能力2 个方面评价羊蹄甲花色素的抗氧化活性,并与抗氧化剂VC 进行比较。色素对超氧阴离子自由基的清除作用基本与VC 相当,对羟基自由基的清除作用略低于VC,以上都说明其抗氧化能力随着花色苷提取液浓度的增加而提高,这与相关研究报道结果一致。由此可见,洋紫荆具有较好的营养功效,合理开发利用洋紫荆花色苷的功能活性,可提高其综合利用价值。
响应面实验优化洋紫荆花色苷的工艺,最佳工艺条件为筛目60 目、浸泡时间3 h、提取温度20℃、料液比1∶50 g/mL、提取时间60 min、乙醇体积分数40%,实验测得的洋紫荆花色苷含量为2.561 mg/g。洋紫荆花色苷提取液在一定的浓度内,对羟自由基和超氧阴离子自由基的具有一定的清除能力,具有较强的体外抗氧化活性,为进一步研究洋紫荆花色苷及其副产品加工提供数据参考。

