一株胶红酵母Rhodotorula mucilaginosa YG14的筛选及混菌发酵提高梗丝品质
刘文莉, 张 娟*, 堵国成, 罗 诚, 李东亮
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江南大学 协同创新中心,江苏 无锡214122;4.四川中烟责任有限公司,四川 成都610000)
烟草中的烟梗是烟叶中相对粗硬的一部分,其质量约占叶质量的30%[1]。烟梗与烟叶相比,烟梗的细胞壁物质纤维素、半纤维素、木质素和果胶等含量较高,还原糖和总糖含量较低,糖碱比失调。将烟梗切丝后应用在卷烟中,燃吸时呈现出木质气息明显、刺激感和灼喉感较重,以及香气贫乏等问题,这些问题会严重影响卷烟的品质[2]。因此,烟梗目前多作为废弃物处理[3],这会造成环境的大量污染和资源的浪费。近年来,随着烟草减害降焦工作的持续发展和对梗丝处理工艺的提升,梗丝在卷烟中的应用越来越广泛。因此,对烟梗的品质提升和充分再利用也成为卷烟行业研究的热点之一[4]。
为了降低烟梗中的细胞壁含量,目前主要通过生物法来改善烟梗品质。陈兴等选取了中性蛋白酶、半纤维素酶、果胶酶、漆酶、纤维素酶和糖化酶6种生物酶作为复合酶制剂处理烟梗、梗丝[5]。张见对烟梗的酶降解应用进行了研究与评价[6]。同时也有人通过微生物制剂来改善烟梗品质。宋丽丽等利用白腐真菌液态发酵烟梗24 h后,烟梗中木质素成分降解了23.11%[7]。施林燕通过对烟梗进行黑曲霉发酵和外加酶处理,使得烟梗中纤维素、果胶和淀粉含量降低[8]。
目前已有利用微生物对烟梗发酵的研究只是针对细胞壁物质的降解,以及产香微生物单独或者菌剂复合发酵梗丝,但对于同时兼顾降解细胞壁物质和增香的共培养体系发酵以改善梗丝品质的研究很少。本研究中通过安全可靠的药食同源真菌灵芝菌结合定向筛选获得一株产香微生物胶红酵母共培养后,并进行梗丝固态发酵。灵芝菌作为药食用白腐真菌,能够产生漆酶和少部分纤维素酶、果胶酶,且本身同时合成多糖类、三萜类、腺苷类、生物碱等活性物质,并具有特有的香味[9-10],但单一灵芝菌固态发酵梗丝在细胞壁降解和香气提升方面效果有限。有研究表明,类胡萝卜素物质可促进白腐真菌漆酶基因的表达[11]。因此本研究中通过有目的地在烟梗上筛选出一株产类胡萝卜素的菌株,在对灵芝菌产漆酶具有诱导作用的同时,其所产生的类胡萝卜素物质作为烟草四大主要香气成分之一,与烟草的香气量和香气品质呈正相关关系[12];该菌通过与灵芝菌共培养混菌固态发酵梗丝来改善梗丝品质,在提高梗丝利用效率方面具有良好的应用前景。
1 材料与方法
1.1 材料与试剂
1.1.1 梗丝材料烟梗、梗丝:四川中烟责任有限公司梗丝生产车间提供(水分质量分数11%~13%)。
1.1.2 菌种灵芝菌(Ganodermalucidum,G.lucidum):作者所在实验室保藏;胶红酵母YG14(Rhodotorula mucilaginosaYG14):分离自烟梗。
1.1.3 培养基PDB培养基:葡萄糖20 g/L、土豆200 g/L;pH自然,121℃灭菌20 min。
发酵培养基:葡萄糖20 g/L、酵母粉5 g/L、蛋白胨10 g/L、MgSO4·7H2O 1 g/L、KH2PO41 g/L、Vb10.1 g/L;pH自然,121℃灭菌20 min。
YEPD液体培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母粉10 g/L;pH自然,121℃灭菌20 min。
产类胡萝卜素菌株筛选培养基:葡萄糖20 g/L、酵母粉5 g/L、蛋白胨10 g/L、MgSO4·7H2O 1 g/L、KH2PO41 g/L;pH 6.0,121℃灭菌20 min。
木质素固体培养基:木质素5 g/L、酵母粉10 g/L、MgSO4·7H2O 1 g/L、KH2PO41 g/L,琼脂20 g/L;pH自然,121℃灭菌20 min。
羧甲基纤维素钠(CMC-Na)固体培养基:CMC-Na 15 g/L、MgSO4·7H2O 1 g/L、KH2PO41 g/L,琼脂20 g/L;pH自然,121℃灭菌20 min。
1.2 方法
1.2.1 灵芝菌固态发酵梗丝灵芝菌液的制备:灵芝种子液经过PDB培养基活化5 d后,用玻璃珠打散菌丝体,以5%(体积分数)接种量接种于发酵培养基中,30℃、150 r/min培养7 d,玻璃珠打散菌丝体得到混合均匀的灵芝菌液;
梗丝的固态发酵:将制备的灵芝菌液分别以梗丝质量的10%、20%、30%、40%的接种量均匀喷洒至梗丝上,将梗丝装入密封袋中,并扎少量小孔,放置在温度30℃、湿度75%的恒温恒湿培养箱中发酵6 d,将温度升至80℃保持2 h高温灭活。固态发酵结束后将梗丝于40℃烘箱中烘至水分质量分数为11%~13%[13]。
1.2.2 梗丝细胞壁成分测定纤维素、半纤维素、木质素和果胶测定方法参照文献[14]。四川中烟责任有限公司所产烟梗中纤维素质量分数为28.91%,木质素质量分数为8.81%,半纤维素质量分数为7.9%,果胶质量分数为13.95%。
1.2.3 产类胡萝卜素菌株的筛选用无菌水在摇瓶中振荡洗涤烟梗,获得烟梗上的微生物,经过平板稀释涂布,挑选颜色为黄色、橙色或者红色的菌株进行分离纯化和鉴定,并对筛选到的10株带有颜色的菌株进行产类胡萝卜素能力的测定[15]。
类胡萝卜素质量分数测定方法:离心收集菌体,细胞破壁后用蒸馏水洗涤2~3次,加入等体积丙酮提取类胡萝卜素,离心后取上清液即为类胡萝卜素提取液,475 nm下测定吸光度。

式(1)中:I为类胡萝卜素质量分数(以干菌体质量计),μg/g;Aλmax为最大吸收波长475 nm下的吸光度;V为提取所用有机溶剂的总体积,mL;D为浸提液稀释倍数;W为菌的干质量,g;0.16,类胡萝卜素的消光系数。
对初筛得到的10株菌分别在木质素作为唯一碳源的固体培养基和CMC-Na作为唯一碳源的固体培养基上进行划板培养,放到30℃培养箱中培养2~4 d后观察菌株是否生长。
1.2.4 灵芝菌、胶红酵母YG14单菌和共培养混菌发酵液漆酶测定(ABTS法)
按照方法1.2.1获得灵芝菌液、按照方法1.2获得胶红酵母、共培养混菌菌液。
酶活测定方法:3 mL反应体系里含有0.5 mL 1 mmol/L ABTS溶液、2 mL 0.05 mol/L pH 3的磷酸氢二钠-柠檬酸缓冲液和0.5 mL粗酶液(发酵菌液8 000 r/min离心5 min取上清液),在45℃下反应5 min,沸水浴10 min终止反应,测定OD420nm。
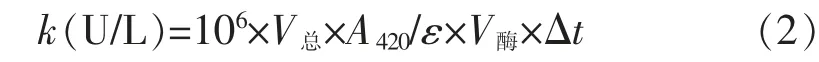
式(2)中:k为漆酶酶活,U/L;V总为漆酶酶活测定反应体系总体积,mL;V酶为添加酶液体积,mL;△t为反应时间,min;ε为3.6×104,L/(mol·cm)[16]。
1.2.5 胶红酵母YG14、灵芝菌和胶红酵母YG14共培养混菌固态发酵梗丝
1)胶红酵母菌液的制备 胶红酵母YG14经过YEPD液体培养基活化2 d后,以2%(体积分数)接种量接种于发酵培养基中,30℃、220 r/min培养2 d后得到胶红酵母YG14菌液。
2)灵芝菌与胶红酵母共培养菌液的制备 灵芝种子液经过PDB培养基活化5 d后,用玻璃珠打散菌丝体,以5%(体积分数)接种量接种于发酵培养基中,30℃、150 r/min培养2 d,随后将摇瓶培养2 d的胶红酵母YG14菌以5%(体积分数)的接种量接种至灵芝菌发酵摇瓶内,共同培养4 d,得到共培养菌液,其中胶红酵母活菌数约7×108CFU/mL,灵芝菌体干质量浓度约11 g/L。
3)梗丝的固态发酵 胶红酵母YG14固态发酵梗丝:将1)中制备的胶红酵母YG14菌液分别以梗丝质量的10%、20%、30%、40%的接种量均匀喷洒至梗丝上,将梗丝装入密封袋中,并扎少量小孔,放置在温度30℃、湿度75%的恒温恒湿培养箱中发酵6 d,将温度升至80℃保持2 h高温灭活。固态发酵结束后将梗丝于40℃烘箱中烘至水分质量分数为11%~13%。
共培养混菌固态发酵梗丝:将2)中制备的共培养菌液以梗丝质量的5%、10%、20%、30%的接种量均匀喷洒至梗丝上,将梗丝装入密封袋中,并扎少量小孔,放置在温度30℃、湿度75%的恒温恒湿培养箱中发酵6 d,将温度升至80℃保持2 h高温灭活。固态发酵结束后将梗丝于40℃烘箱中烘至水分质量分数为11%~13%。
1.2.6 梗丝挥发性香气成分测定
1)样品前处理 灵芝菌、胶红酵母YG14单菌和共培养混菌固态发酵后的梗丝在40℃烘箱中干燥,用粉碎机粉碎后过40目筛,准确称取1 g样品于顶空瓶内用顶空微萃取法进行萃取后进行GCMS分析,对照组为喷洒高温灭活的发酵液梗丝[17-33]。
2)GC-MS联用仪分析条件 顶空萃取头:DVB/CAR/PDMS(50/30μm);色谱柱:TG-5MS(30 m×0.25 mm×0.25μm)毛细管柱;进样口温度:260℃;载气:Methane,1 mL/min;程序升温:55℃保持1 min,5℃/min升至80℃,3℃/min升至200℃,5℃/min升至260℃保持5 min;进样量:2μL;分流比:20∶1;传输线温度:280℃;电离方式:EI;电离能量:70 eV;离子源温度:300℃;四级杆温度:160℃;质量范围(m/z):33~600。结果分析采用NIST05、Wiley275普库进行检索定性[28]。
1.2.7 梗丝感官品吸评价将空白处理梗丝,灵芝菌、胶红酵母YG14单菌和共培养混菌发酵的梗丝制成手工卷制的烟支,在(22±1)℃、(60±1)%相对湿度下平衡48 h,然后组织四川中烟责任有限公司相关评吸专家进行梗丝的品吸评价[29]。
1.2.8 数据处理用SPSS软件进行数据处理。
2 结果与分析
2.1 灵芝菌固态发酵梗丝结果
梗丝经过灵芝菌固态发酵6 d后,烘干并测定细胞壁纤维素、半纤维素、木质素和果胶的质量分数,通过计算得到细胞壁物质降解结果(见表1)。灵芝菌固态发酵梗丝,总细胞壁降解程度随着灵芝菌接种量(质量分数)的增加呈先上升后下降的趋势,在接种量为梗丝质量的20%时总细胞壁物质降解程度达到最高,降解率为16.40%,其中纤维素降解率为14.74%、木质素降解率为24.40%、半纤维素降解率为15.82%、果胶降解率为15.13%,灵芝菌固态发酵对梗丝的木质素降解效果较好,但是对其他物质的降解效果一般,使得梗丝总细胞壁物质的降解率较低。

表1 灵芝菌固态发酵梗丝细胞壁物质测定结果Table 1 Cell wall substance measurement results of G.lucidum solid fermentation stem silk
将灵芝菌发酵的梗丝进行品吸,结果见表2。灵芝菌接种量为梗丝质量的20%时品吸效果最好,其甜感提升明显,木质气息有所减轻,灼烧感较轻微,刺激感较轻微。灵芝菌固态发酵过程中产灵芝多糖和漆酶,因此对梗丝的甜感和木质气息改善较明显,但是对纤维素和果胶的降解效果不显著,因此在灼烧感和刺激感方面改善较不明显。而香气感在接种量加大后才有显著提升,猜测主要是加入的大量菌液中带入一些灵芝菌发酵液中的成香物质,但是接种量过多会导致因菌体过多在燃吸时产生异味。
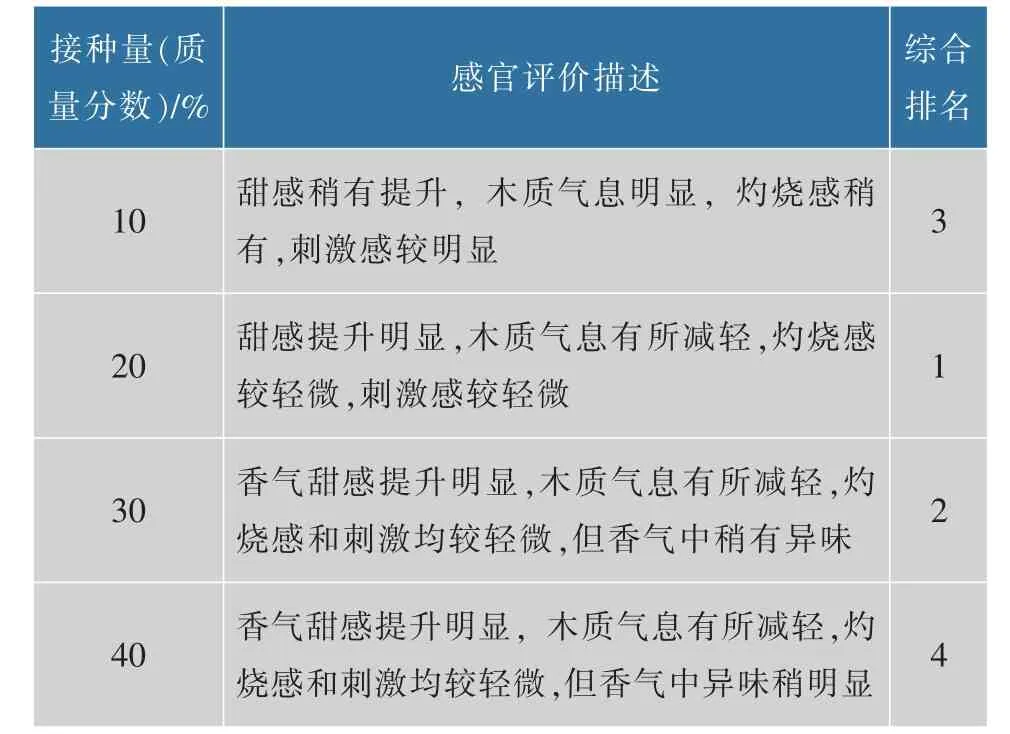
表2 灵芝菌固态发酵梗丝感官品吸评价Table 2 Sensory evaluation of G.lucidum solid fermentation stem silk
通过细胞壁物质降解和品吸评价,灵芝菌固态发酵梗丝最佳接种量为梗丝质量的20%,但是灵芝菌对于梗丝品质的提升效果有限,因此选择从烟梗上筛选一株菌进行复合固态发酵梗丝,来增强梗丝的降解效果和香气量的提升。通过查找文献发现类胡萝卜素能够促进白腐真菌漆酶的表达,另外类胡萝卜素物质也是烟叶中四大主要香气成分之一。因此选择筛选一株能够产类胡萝卜素物质,并且可同时降解纤维素和木质素等物质的菌株与灵芝菌共培养复合处理梗丝。
2.2 产类胡萝卜素菌的筛选
类胡萝卜素一般呈现红色至黄色,对烟梗上分离的45株菌进行产类胡萝卜素菌的筛选,初筛得到带有类胡萝卜素颜色特征的菌株共10株(见图1),通过序列分析比对和鉴定分别为Rhodosporidiobolus、Rhodotorula mucilaginosa、Methylorubrum、Planococcus、Mixta intestinalis、Sphingomonas、Franconibacter、Stenotrophomonas、Ochrobactrum、Microbacterium。分别命名为RhodosporidiobolusYG1、Rhodotorula mucilaginosaYG14、MethylorubrumYG17、PlanococcusYG19、Mixta intestinalisYG20、SphingomonasYG21、FranconibacterYG22、StenotrophomonasYG24、OchrobactrumYG25、MicrobacteriumYG27。对这10株菌进行产类胡萝卜素能力测定,结果如表3所示,产类胡萝卜素的共有5株菌,其产类胡萝卜素能力由大到小依次为:Rhodotorula mucilaginosaYG14、RhodosporidiobolusYG1、SphingomonasYG21、PlanococcusYG19、MethylorubrumYG17。
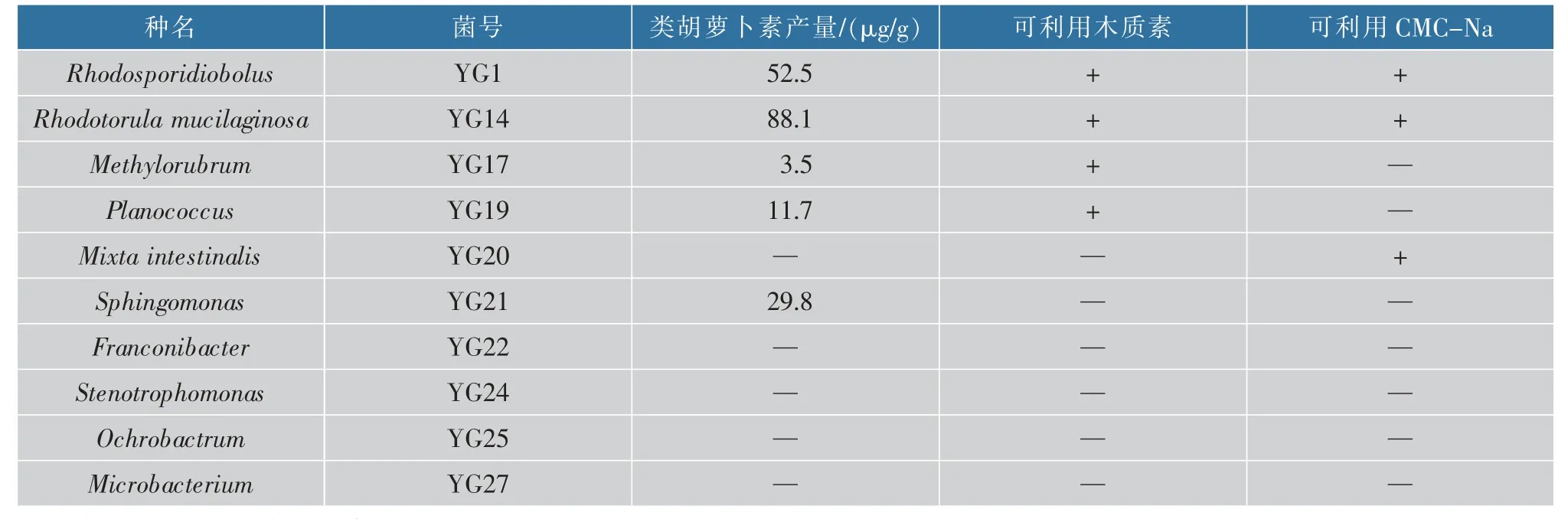
表3 烟梗上筛选的10株菌测定结果Table 3 Measurement results of 10 strains selected on tobacco stems
图1 烟梗上产类胡萝卜素菌的初筛Fig.1 Primary screening of carotenoid producing bacteria on tobacco stems
本次筛选一株产类胡萝卜素菌的目的是与灵芝菌共培养混菌固态发酵梗丝,因此在高产类胡萝卜素的基础上还能够降解细胞壁物质,因此考察了这10株菌对木质素和CMC-Na的利用情况,能够利用木质素的有4个菌株,菌号分别为YG1、YG14、YG17、YG19;能够利用CMC-Na的有3个菌株,菌号分别为YG1、YG14、YG20。
菌号YG14和YG1两株菌不仅产类胡萝卜素,同时可利用木质素和CMC-Na,而且YG14的类胡萝卜素产量最高。因此,选择烟梗上筛选到的一株胶红酵母YG14作为灵芝菌的共培养菌进行梗丝的混菌固态发酵。
2.3 胶红酵母YG14固态发酵梗丝
将胶红酵母YG14固态发酵处理梗丝6 d后,烘干并测定细胞壁纤维素、半纤维素、木质素和果胶的质量分数,通过计算得到细胞壁物质降解结果(见表4),胶红酵母YG14固态发酵梗丝总细胞壁降解程度随着接种量(质量分数)的增加呈先上升后下降的趋势,在接种量为梗丝质量的20%时总细胞壁物质降解程度达到最高,降解率为24.91%。其中纤维素降解率为32.83%、木质素降解率为12.03%、半纤维素降解率为33.54%、果胶降解率为11.76%,胶红酵母YG14对纤维素和半纤维素的降解效果较好。
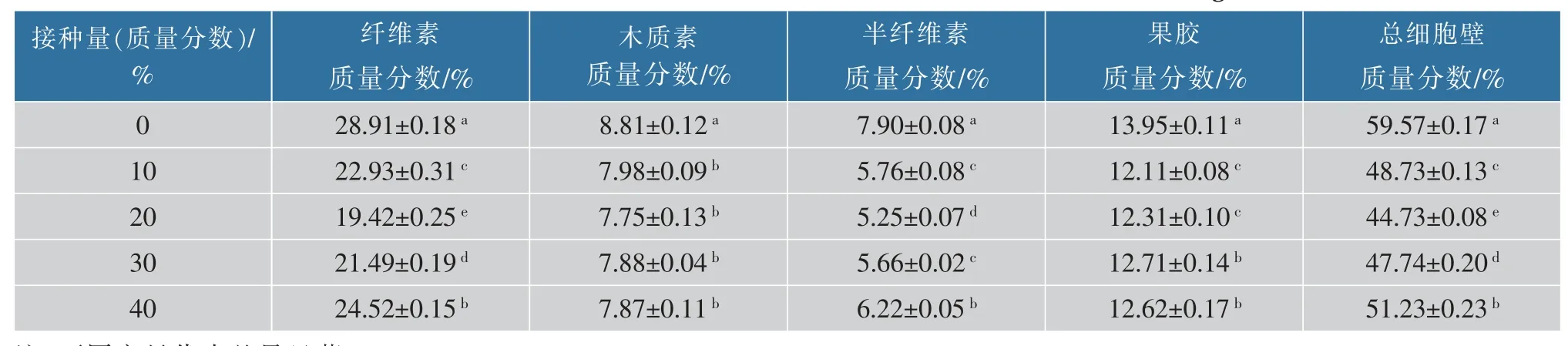
表4 胶红酵母YG14固态发酵梗丝细胞壁物质测定结果Table 4 Determination of cell wall material in solid fermented stem of R.mucilaginosa YG14
胶红酵母YG14固态发酵梗丝在以梗丝质量20%的接种量时梗丝品吸效果最好(见表5),与灵芝菌固态发酵梗丝相比,香气量提升的比较明显,但是烧纸气息和木质气息改善较不明显,猜测主要是因为胶红酵母YG14对梗丝木质素和果胶的降解效果不明显。

表5 胶红酵母YG14固态发酵梗丝感官品吸评价Table 5 Sensory evaluation of R.mucilaginosa YG14 solid fermentation stem silk
2.4 灵芝菌、胶红酵母YG14单菌和共培养混菌发酵液的漆酶测定结果
胶红酵母YG14单菌液态发酵2 d后取上清液测定漆酶酶活,经过测定可知胶红酵母YG14可产生少部分的漆酶,酶活为14.28 U/L。将灵芝菌液、灵芝菌与胶红酵母YG14共培养混合菌液离心后分别取上清液测定漆酶酶活,结果如图2所示。灵芝单菌发酵液在第7天时漆酶酶活达到最大,为499.87 U/L;灵芝菌与胶红酵母YG14共培养发酵液在第6天时漆酶酶活达到最大,为1 129.17 U/L,比灵芝单菌最高酶活(第7天)提高了1.25倍。灵芝菌与胶红酵母YG14共培养液态发酵,胶红酵母YG14能够促进灵芝菌漆酶的表达,共培养菌液中不仅含有胶红酵母YG14和灵芝菌两种菌,还含有大量漆酶、少量纤维素酶和果胶酶,比灵芝单菌液态发酵的酶系更全面协调,而且漆酶酶活提高,发酵产酶时间缩短。
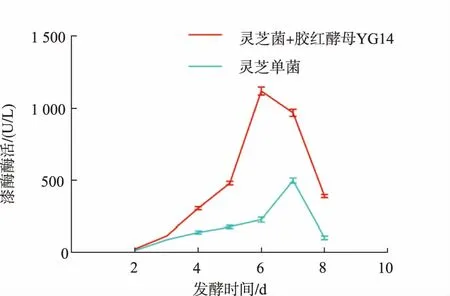
图2 漆酶酶活测定Fig.2 Laccase activity assay
2.5 共培养混菌固态发酵梗丝
灵芝菌和胶红酵母YG14液态共培养后混菌固态发酵梗丝6 d,烘干并测定细胞壁纤维素、半纤维素、木质素和果胶的质量分数,通过计算得到细胞壁物质降解结果(见表6)。在共培养菌液接种量为梗丝质量的10%时梗丝总细胞壁物质降解效果最好,降解率为37.20%,其中纤维素降解率为38.81%、木质素降解率为33.26%、半纤维素降解率为28.23%、果胶降解率为41.43%,灵芝菌与胶红酵母YG14共培养混菌固态发酵梗丝后细胞壁各物质降解相对比较协调,且降解效果明显,比单菌效果更好。
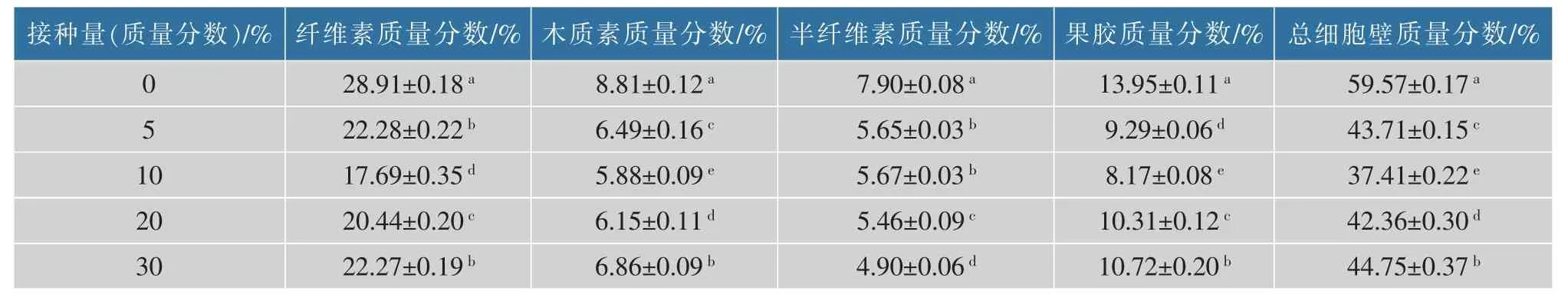
表6 共培养固态发酵梗丝细胞壁物质测定结果Table 6 Co-cultured solid fermented stem silk cell wall substance assay results
灵芝菌和胶红酵母YG14共培养混菌固态发酵梗丝后梗丝品吸结果见表7,共培养菌液接种量为梗丝质量的10%时,梗丝品吸效果最好,甜感提升明显,木质气息改善明显,香气量有一定提升,灼烧刺激感改善明显,并且香气更显圆润。共培养混菌固态发酵梗丝,在较少的接种量情况下降解效率提升明显,梗丝品质改善明显。
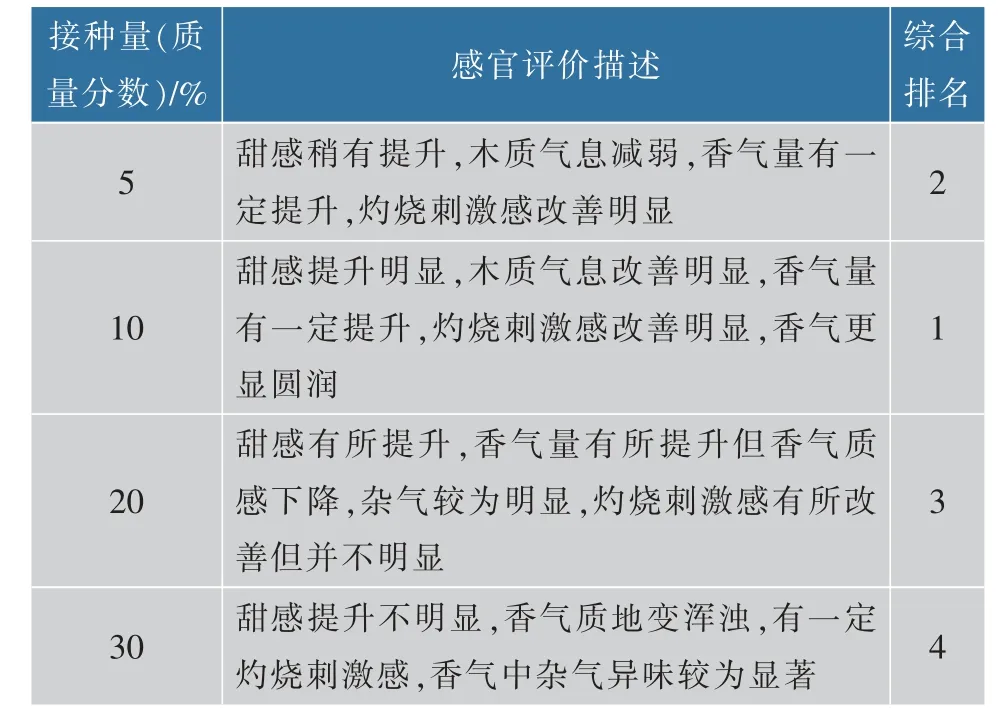
表7 共培养固态发酵梗丝感官品吸评价Table 7 Sensory evaluation of co-cultured solid fermented stems
2.6 梗丝固态发酵前后致香成分变化
通过GC-MS对不同处理条件下的梗丝进行致香成分含量变化检测,共检测到200多种成分,其中共检测到58种致香成分。对梗丝中性致香成分主要进行以下6种分类:苯丙氨酸转化产物、棕色化反应产物、类胡萝卜素转化产物、西柏烷类转化产物、新植二烯和其他物质。
选择灵芝菌、胶红酵母YG14单菌和共培养混菌固态发酵梗丝细胞壁降解效果和感官品吸效果最好的3个条件下处理的梗丝与对照组梗丝进行中性致香物质的测定,结果见表8。灵芝单菌固态发酵梗丝在以梗丝质量20%的接种量时总挥发性成分提升11.45%;胶红酵母YG14单菌固态发酵梗丝在以梗丝质量20%的接种量时梗丝总挥发性成分提升12.79%;灵芝菌和胶红酵母YG14共培养混菌固态发酵梗丝在以梗丝质量10%的接种量时总挥发性成分提升20.44%。共培养菌液在以梗丝质量10%的接种量发酵梗丝时,中性致香成分变化显著的物质为棕色化反应产物和新植二烯,其中棕色化反应产物主要起到改善梗丝气味,增加梗丝的香气、甜味,降低杂气和刺激性的作用;新植二烯会降低烟气中的刺激性和杂气产生,平衡烟气,使其更圆润。根据总挥发性致香成分质量分数变化可以得出灵芝菌和胶红酵母YG14共培养混菌比灵芝单菌、胶红酵母YG14单菌固态发酵梗丝效果明显更好。
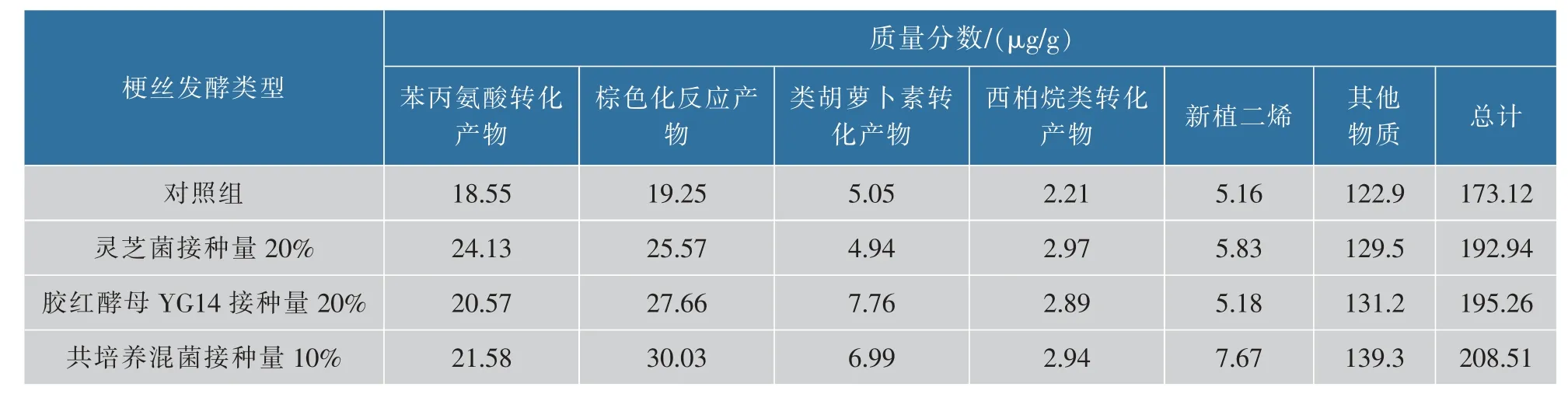
表8 梗丝处理前后中性致香物质的变化Table 8 Changes of neutral aroma components before and after tobacco stem treatment
2.7 梗丝综合感官品吸评价
通过对梗丝细胞壁成分测定和3组品吸结果分析,选择灵芝单菌接种量为梗丝质量的20%、胶红酵母YG14单菌接种量为梗丝质量的20%和共培养混菌接种量为梗丝质量的10%3组固态发酵后的梗丝与对照组梗丝制成手工卷制的烟支,感官品吸结果(见表9)表明:经过微生物菌液固态发酵后的梗丝甜感提升,木质气息改善,香气量也有一定的提升,灼烧感和刺激感减弱。经过排序结果表明接种质量分数10%的灵芝菌和胶红酵母YG14共培养混菌固态发酵后的梗丝品吸效果最佳。

表9 梗丝感官品吸评价Table 9 Tobacco stem sensation evaluation
3 结 语
本研究中从烟梗上筛选到一株辅助灵芝菌降解细胞壁物质并且有提质增香作用的胶红酵母菌。将两株菌进行液态共培养后混菌固态发酵梗丝,发酵结束后梗丝总细胞壁物质降解达到37.20%;中性致香成分质量分数提升20.44%;感官品吸评价为甜感提升明显,木质气息改善明显,香气量有一定提升,灼烧刺激感改善明显,香气更显圆润。综上所述,筛选获得的胶红酵母YG14与灵芝菌液态共培养后固态发酵梗丝细胞壁物质降解效果明显,感官品质改善明显,具有较好的应用前景。本研究可以为工业化应用奠定一定的技术基础。

