发生免疫检查点抑制剂相关心脏损害20例患者的临床特点分析
谢海静,韩志刚
(新疆医科大学附属肿瘤医院,新疆 乌鲁木齐 830000)
0 引言
近年来,免疫治疗已经成为治疗晚期恶性肿瘤的常用治疗手段之一。但免疫检查点抑制剂针对正常细胞也有一定损害作用。本研究通过收集2018年1月至2021年8月就诊于新疆医科大学附属肿瘤医院的20例明确诊断为免疫检查点抑制剂相关心脏毒性患者的临床资料、治疗方案等,探讨可能对预后产生影响的因素,为免疫检查点抑制剂相关心脏毒性的早期诊疗提供依据。
1 对象与方法
1.1 研究对象
收集2018年1月至2021年8月就诊于新疆医科大学附属肿瘤医院的20例患者的临床资料,纳入标准:治疗前有明确的病理或细胞学诊断。排除标准:原发肿瘤不明确,病理结果及临床分期不明确。
1.2 研究方法
回顾性分析本次研究入选20例患者的临床资料进行统计及归纳总结,为尽早诊疗免疫检查点抑制剂相关心脏毒性提供一定的临床参考。
1.3 统计学方法
患者的一般情况、辅助检查、治疗方法及预后情况采用描述性分析。采用SPSS 22.0进行数据处理,计量资料符合正态分布采用配对样本t检验进行比较,不符合正态分布应用非参数检验。利用ROC曲线下AUC评估相关指标对免疫检查点抑制剂相关心脏毒性的预测效果,AUC>0.7则认为是有用的预测因子,使用约登指数最大值来确定各危险因素在预测免疫检查点抑制剂相关心脏毒性中的最佳截断值。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
本组研究共纳入20例患者,男女比例3:2。最低发病年龄为36岁,最高为85岁,中位年龄为62.5岁。体重指数最低为18.69 kg/m2,最高达27.94 kg/m2。7人(35%)有吸烟史,均为男性,烟龄均在20年之上,至少20支/d,有4人(20%)同时有饮酒史,酒龄均在20年之上。8人(40%)有既往病史。
2.2 相关指标分析
本组研究治疗前后平均动脉压(MAP)、甘油三酯(TG)、总胆固醇(TC)、左室射血分数(LVEF)相比差异均无统计学意义。TG和TC分别有10人(50%)和8人(40%)较基础值升高。11例(55%)心脏彩超较基础值下降,3例(15%)降至60%以下(见表1)。
表1 相关指标( ±s)

表1 相关指标( ±s)
?
治 疗 前 后BNP、TnT、CK、CK-MB、LDH、AST、NLR、CRP差异均有统计学意义(P<0.05)(见表2)。
2.3 相关指标的预测效果
本组研究相关指标预测免疫相关性心脏毒性的ROC曲线下AUC如下(见图1、图2)。其中,BNP、TnT、CK-MB、LDH、AST、NLR、CRP的AUC均在0.7以上,被认为是有用的预测因子,ROC曲线截断值如下(见表3)。

表2 心脏相关指标
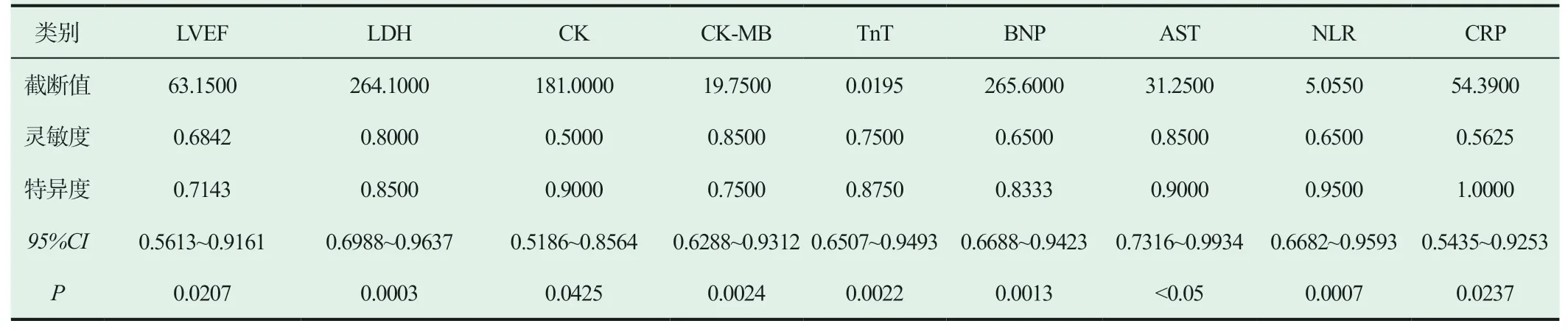
表3 相关指标的截断值
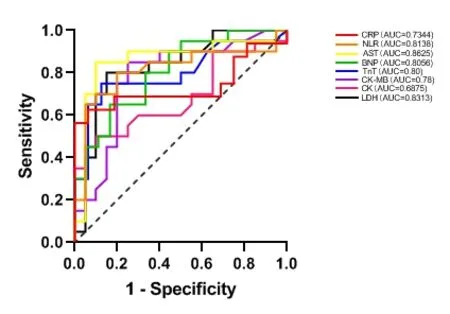
图1 心脏相关指标的ROC曲线

图2 LVEF的ROC曲线
2.4 本组患者的心电图情况
本组患者发生心脏毒性后心电图变化多样,4例窦速,3例期前收缩(1例房早,2例室早),1例房速,1例房颤,2例Ⅰ°房室传导阻滞,1例左前分支传导阻滞,2例右束支传导阻滞,2例异常Q波,1例R波递增不良,2例QT间期延长,1例肢导QRS低电压,9例ST-T改变。
2.5 本组患者合并其他irAEs情况
本组患者有6例(30%)患者合并其他irAEs,2例(10%)合并免疫相关性肌炎,3例(15%)甲功异常,2例(10%)肝功能异常,3例(15%)合并免疫相关性肺炎。1例(5%)既往有高血压、糖尿病及冠心病的患者合并有免疫相关性肺炎及甲功异常。
2.6 本组患者使用的免疫检查点抑制剂及周期数
本组有18例(90%)患者使用3周期以下(包含3周期)的抗PD-1/PD-L1抑制剂单药或联合化疗方案后出现心脏毒性,2例(10%)12周期以上(包含12周期)的免疫治疗后出现心脏毒性。
3 讨论
免疫相关心脏毒性的临床症状多样,鉴别困难,需借助相关辅助检查明确诊断。心电图检查出现PR间期延长、ST段压低等特征,心脏超声射血分数均有下降(LVEF分别为73%和50%)。有研究表明,在ICI治疗之前和治疗过程中测量CRP或NLR或是遗传因子如sPD-L1或ctDNA可能成为预后或预测标记物。本组研究中使用免疫检查点抑制剂前后BNP、TnT、CK、CK-MB、LDH、AST、NLR、CRP均有不同程度的升高(P<0.05)。并且根据此次研究发现,BNP、TnT、CK-MB、LDH、AST、NLR、CRP有一定心脏毒性的预测作用。研究表明,发生免疫相关心脏毒性患者的心电图变化多样,本研究治疗后出现冲动形成异常及冲动传导异常,完善心脏超声,11例(55%)LVEF较基础值下降。建议提前完善心电图、心脏超声等检查,排除免疫治疗禁忌证,除此之外,依然建议提前进行其他心血管相关检查,如TnI或TnT、脑钠肽或B型钠尿肽前体、肌酸激酶及心脏MRI等。
有研究表明免疫治疗引起的心肌炎中位发病时间为接受ICI治疗后的27~34 d[1]。2018年发表的两个大型病例系列[2]的ICI相关性心肌炎,其中一项为59名患者的研究显示,76%在治疗前6周内患有心肌炎(范围5~155 d),64%的患者在心肌炎发作前仅接受过一次或两次ICI治疗。本研究有18例(90%)患者使用3周期以下(包含3周期)的抗PD-1/PD-L1抑制剂单药或联合化疗方案后出现心脏毒性,2例(10%)12周期以上的免疫治疗后出现心脏毒性。且出现心脏毒性后的预后不同,其中有3名(15%)患者在使用2周期免疫检查点抑制剂后出现心脏毒性,并在依照指南要求的激素冲击治疗后死亡。本研究发现使用免疫检查点抑制剂周期数少的患者发生心脏毒性呈爆发式,致死性高。
除此之外,需要重视的是,当发生免疫相关性心脏毒性时,需警惕合并其他免疫相关不良反应,目前考虑免疫相关心脏损害合并其他免疫相关不良反应的患者预后差,本研究有6例(30%)患者合并其他irAEs,2例(10%)合并免疫相关性肌炎,3例(15%)合并免疫相关性甲状腺炎,2例(10%)合并免疫相关性肝炎,3例(15%)合并免疫相关性肺炎。1例(5%)既往有高血压、糖尿病及冠心病的患者合并有免疫相关性肺炎及免疫相关性甲状腺炎。其中有1例患者合并免疫相关性肌炎和免疫相关性肝炎导致死亡[3]。
综上所述,老年、男性、长期吸烟饮酒史、肥胖和既往心脑血管疾病需警惕免疫相关心脏毒性的发生,提前完善免疫治疗前的相关辅助检查如心脏血清学相关指标可以帮助预判发生免疫检查点抑制剂相关心脏毒性的可能。如果心脏功能指标出现异常,建议提前做好干预治疗,且需警惕合并其他免疫相关不良反应的发生。

