聚乳酸基复合骨组织修复材料的研究现状及进展
韦宗辰,郗悦玮,2∗,翁云宣,2∗∗
(1.北京工商大学化学与材料工程学院,北京 100048;2.塑料卫生与安全质量评价技术北京市重点实验室,北京 100048)
0 前言
随着经济的发展、科学技术的进步、医学水平的不断提高,医用材料越来越受到人们的重视。骨是人体重要组织,起到支撑、防护与运动功能。疾病、外伤等引起的骨组织缺损严重危及人类健康,给患者造成极大的痛苦。人工骨替代修复效果有限[1],尽管手术技术、骨移植材料发展迅速,仍有5%~10%骨折患者因为手术的延迟和不完善造成残疾,给社会和家庭造成经济负担[2-3]。大多数组织,如骨组织、韧带、半月板、软骨、骨膜和皮肤[4],是由组成物质的两相结合形成的,两相分别是以纤维或颗粒形式存在的增强相和被称为基质的连续相。以骨骼和牙齿为例,其基本组分构成分别是由胶原蛋白(16%)组成的有机基质、由羟基磷灰石(HA)晶体(50%~60%)组成的无机增强介质、水(22%)以及蛋白质、多糖、粘多糖(2%)[5]。骨是一个高度复杂、组成多样的组织,它具有提供机械支持、支持肌肉收缩、矿物储存,以及支撑负荷和保护内部器官等功能[5-7]。
人们在生产生活或运动的过程中,很容易因意外造成骨组织缺损,尤其是老年人容易在活动中造成一些如骨折、骨裂等创伤;另外有部分患者患有先天性骨骼疾病。为了治疗这些患者骨缺陷、骨坏死等疾病,人工骨材料应运而生,目前已有多种人工骨材料应用于外科手术。人工骨是指代替天然人骨的一种用于修复骨组织缺损的生物材料。理想的人工骨材料应该具有良好的生物相容性,具有仿生的力学性能及高效的骨骼诱导、传导性能。另外在诱导成骨细胞分化、促进新骨组织生长的基础上,还需具备一定的加工性能,易于加工成患者所需的大小、形状。人工骨的生物相容性和可降解性,既可以减少二次手术给病人带来的伤害,也可以减少患者因二次手术带来的经济损失[8-9],因此生物相容性好、降解速率可控一直是人工骨材料研究的目标和方向。
目前可以将人工骨材料按照材料类型分为以下3类:金属基、无机非金属基、高分子基骨组织修复材料。金属基骨修复材料也可以认为是第一代骨修复材料,随着它植入人体,主要为骨缺损处提供一个力学支撑,金属基骨修复材料的力学性能良好,有耐磨、耐腐蚀、易加工等诸多性能,但其缺点也十分明显:金属基骨修复材料普遍具有生物惰性,会引发机体的炎症反应,也不能被细胞吞噬或当做异物排出体外,需要通过二次手术取出人体。无机非金属基骨修复材料可以认为是第二代骨修复材料,无机非金属基骨修复材料与人体的生物相容性很好,无毒,不容易引起机体排异反应,但是其自身的缺点主要体现在:不易加工成患者所需的形状和大小,成型性能较差。高分子基骨修复材料的出现很好地解决了上述缺点,高分子基骨修复材料既可以通过多种成型加工手段满足患者所需的形状和尺寸,有些高分子材料又可以被人体吸收降解成CO2和水等排出体外。因此性能优良、功能全面的高分子基复合材料是近些年来骨组织工程材料领域的研究重点。
常用的高分子基骨修复材料主要为PLA基骨修复材料,PLA的加工性能优良,可通过多种加工成型手段按需制作成骨缺损处所需的形状,且与人体的生物相容性能好,可以在人体内分解成CO2和水排出体外,不需要患者面对二次手术的风险。因此PLA基骨修复材料在骨外科手术上应用广泛。
本文主要综述了目前由PLA作为基体研究出来的PLA/有机复合材料、PLA/无机复合材料、PLA/有机/无机复合材料3种骨修复材料,它们的制备方法、特点、功能以及使用范围,PLA基复合材料性能与结构的关系,可以为PLA基复合骨修复材料的设计与构建提供参考。
由表1可知,单一的有机或无机材料都难以完全满足骨修复材料的需求,如PLA骨修复材料,虽有易加工和化学稳定性能,但是缺少了生物活性,依然限制了其在骨组织工程中的应用。在骨组织工程材料的设计与构建中,如能将无机非金属的生物活性与PLA基材料的易加工性及生物相容性相结合,同时具备多种优势,更适宜广泛应用于骨缺损的治疗中。因此复合材料应运而生,复合材料是由2种或2种以上材料复合而成的多功能材料,充分利用了不同材料的优点从而制成的较单一材料更理想的材料。制备具有仿生结构性能的人工骨,是骨修复材料领域追求的目标。复合材料可以分为无机-无机复合材料、有机-无机复合材料及有机-有机复合材料,不同性能的材料经复合后可以充分发挥自身的优势,扬长避短,更加全面满足患者需求。本文概述了多种PLA/有机骨修复材料、PLA/无机骨修复材料、PLA/有机/无机骨修复材料的制备、性能及结构与性能的关系,为PLA基复合骨修复材料的设计与构建提供参考。

表1 常见生物医用材料的分类、优势和缺陷Tab.1 Classification,advantages and disadvantages of common biomedical materials
1 PLA
PLA是一种重要的可降解材料,又称为聚丙交酯,是乳酸相互聚合或与丙交酯开环聚合而生成的高分子聚合物[10]。根据PLA旋光性的不同,可分为外消旋聚乳酸(PDLLA)、左旋聚乳酸(PLLA)、右旋聚乳酸(PDLA)3种异构体。
PLA的合成主要有2种途径:一是乳酸直接聚合。另一种是由乳酸预聚生成低分子量物质,其解聚得丙交酯,丙交酯 重结晶后开环聚合得到PLA。具体合成过程如图1所示。
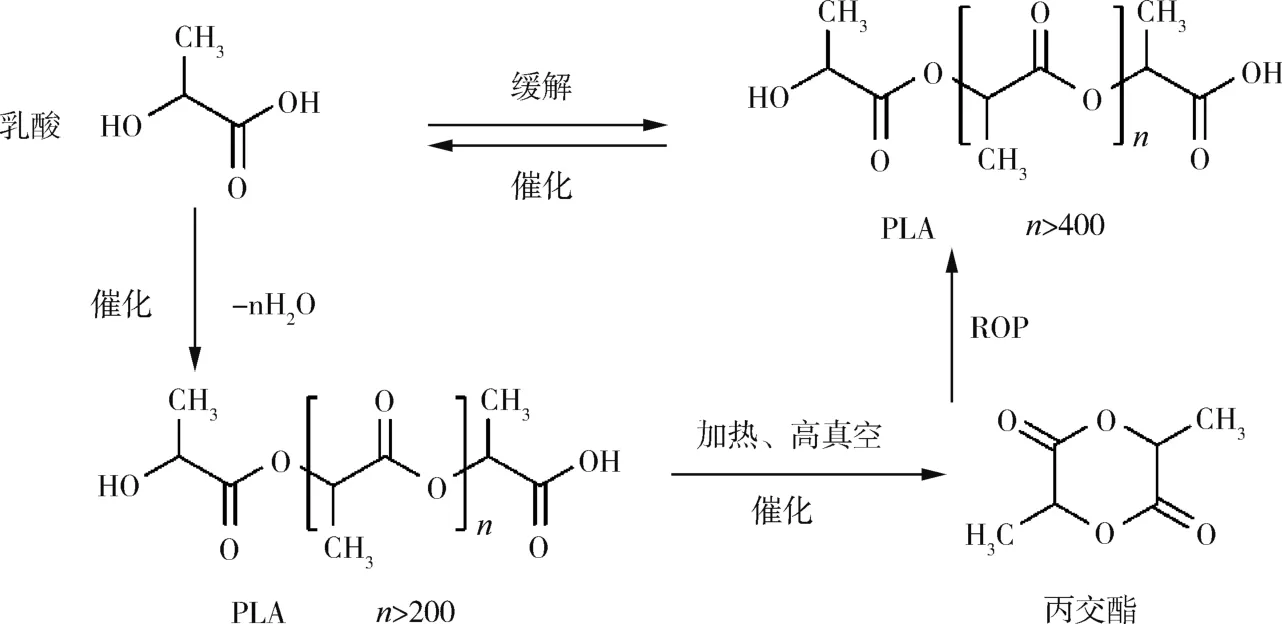
图1 PLA的合成线路Fig.1 Synthesis of PLA
PLA可使用农业废料如麦麸、米糠和甘蔗渣[11]等发酵、聚合生产,目前在骨组织工程中研究日益广泛。PLA的生物相容性好,成本较为低廉,在生物医学领域如药物输运系统(DDS)、组织工程等具备极大的应用潜力,目前已有多种PLA基产品如手术缝合线、医用敷料、微胶囊微球类药物缓释材料等被美国食品药品监督管理局批准应用于临床中。
在骨组织修复材料方面,单一的PLA有生物活性较差等缺点,其功能单一,难以满足各类患者的不同要求。所以PLA常与其他功能性材料复合,制备具有生物活性和可控降解性的复合组织工程支架用于骨内固定和骨缺损的修复。PLA基生物材料可调控的降解速率、良好的生物相容性和易于加工的性能使其在生物医药领域具有极大的研究前景,PLA与其他材料复合制成的骨修复材料既具备一定的生物活性,又具备易加工性和良好的生物相容性,在植入体内的初期可以填补受损的骨组织,同时促进骨细胞的黏附、分化、增殖,随骨细胞的生长、增殖,PLA基骨修复材料可在体内缓慢降解,避免了二次手术取出给患者带来痛苦,可以按需调节,治疗不同部位的骨缺损和骨疾病,因此PLA基复合材料是近些年研究的热点与难点。
2 PLA/有机复合材料
PLA成型性能优良,可通过多种加工手段制成不同形状满足患者需求,但是由于PLA脆性大、亲水性差、降解速率不可控,且其生物活性差,不适合单独应用于组织工程中。与金属基骨修复材料和无机非金属基骨修复材料相比,PLA基骨修复材料可以和多种材料复合使用增强其生物活性、调控其降解速率。PLA与有机材料的复合,在满足生物活性及治疗骨疾病、改善PLA基骨修复材料的生物相容性等多种性能方面均有较大提升。
Wang等[12]用PLA和聚乙二醇(PEG)-聚己内酯复合制备了两亲性聚合物用于骨组织工程。疏水片段增强了聚合物的稳定性和生物降解性,亲水性PEG片段提高力学强度的同时可以调节聚合物在体内降解速率。嵌段共聚结合了每种聚合物的优势,更适合应用于骨组织工程。虽然这些嵌段共聚物目前只有少数被批准应用于临床[13],但其在骨修复领域具有巨大的应用潜力。
Wang等使用不同的方法合成两亲性嵌段共聚物后对其性能进行测试,研究证实不同的聚合方法与技术手段对聚合物的性能有较大影响,因此可以通过选择合适的聚合手段制备具有不同特性的聚合物,合成方法如图2所示[12]。
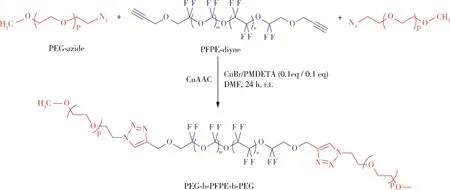
图2 合成两亲性嵌段共聚物Fig.2 Synthesis of amphiphilic block copolymers
Wang等研究证实PEG片段对材料特性的影响主要集中在两亲性、自组装性能、力学强度和降解性能等方面。如上所述,PEG的长度和组成对聚合物的最终性能起到至关重要的作用。通常情况下,胶束化、溶胶-凝胶转变等表面性质会受到PEG含量的影响,PEG含量越高,亲水性越好,接触角越小,临界胶束浓度越高,溶胀比越高。同样,更高的PEG组成也导致更快的降解速率,另外,PEG片段的增加也会影响材料的力学性能。基于PEG共轭聚合物的特性,其可应用于骨和软骨的修复,另外聚合物可作为支架包裹生长因子和药物以刺激骨组织再生。但是在两亲性聚合物的设计与构建中,仍存在一些问题有待系统地解决。例如,理想的亲疏水含量比尚未得到充分阐明,炎症反应的产生和复合支架引起并发症的原因仍不明确。此外,即使使用了足够多种的动物模型进行长期研究,动物模型研究和人体临床试验的效率仍存在差异。此外,再生骨和原有骨组织的功能差异也尚不明确。因此,应进一步设计构建新型两亲性材料,并对其促进骨缺损修复的机理进行探索研究,最大限度提升其促进缺损组织修复再生效果。
Gritsch等[14]研究证实,生物活性玻璃和体液接触形成磷灰石的过程如图3所示:首先,生物活性玻璃和体液交换离子(第一~第三阶段),钙和磷酸盐离子形成一层无定型磷酸钙(第四~第五阶段),最后层层堆叠,形成磷灰石结晶(第六阶段)。

图3 在生物活性玻璃和体液接触的表面形成磷灰石(HCA)Fig.3 HCA on the surface of bioactive glass in contact with body fluids
生物活性纳米颗粒的添加不仅促进了生物矿化,改善了复合材料的力学性能,同时增加了细胞与材料之间的相互作用,促进了细胞的黏附。细胞的刺激是一个复杂的课题,其中涉及多种不同的化学和物理现象[10]。Gritsch等研究证实通过超顺磁性氧化铁纳米粒子磁刺激或通过碳纳米管电刺激可以有效增强组织和材料之间的相互作用。另外经多种生物活性分子(如生长因子、重组蛋白)等修饰后,PLA表面具备更多活性基团,材料的生物活性显著提高。Gritsch等研究证实,掺杂生物活性玻璃(BGs)后,BGs分解产生的碱性物质可以有效中和PLA分解时产生的酸性环境,使炎症不易产生。近期有关BGs的文献表明,其应用不应局限于骨组织工程[15-16]。掺杂活性离子后BGs具备调节血管生成和基因表达的性能,因此Gritsch等预计未来将会有越来越多关于PLA/BGs应用于软组织工程的研究。这些用于提高PLA生物活性的材料为PLA基组织工程支架的构建与制备打开了新的大门,其可以充分利用PLA的诸多优势,如成本较低、易于加工等,同时可使组织和组织工程支架之间的相互作用最大化,促进细胞黏附与增殖,从而促进组织的修复。
利用有机复合材料可以改善PLA基材料的性能,起到互补的作用。Xiao等[17]采用溶剂蒸发法制备了PLA/柠檬酸钙(CC)多孔复合支架。所得的多孔复合支架孔隙分布均匀,孔径约为100~500 μm。CC的加入提高了复合材料的整体力学性能。其压缩强度为1.76~4.08 MPa,弹性模量为 29.10~49.49 MPa。X射线衍射技术(XRD)、扫描电子显微镜(SEM)和热分析结果证实,由于CC有机组分的亲脂性,CC在PLA基体中分散均匀。此外,CC的亲水性提高了复合材料的润湿性,柠檬酸盐降低了PLA与早期磷灰石的界面能,从而具备高矿化活性,引导了磷灰石的形成。此外,CC的引入有效中和了PLA降解带来的酸性环境,防止了酸性产物引起的部分炎症。PLA/CC复合材料可能是一种有前途的、可行的、有效的骨修复材料。
纳米复合生物材料是一种相对较新的材料,其结构包括高分子聚合物和基质结构,其中基质结构是生物可降解且具有生物活性的纳米级填料。Bharadwaz等[18]发表了关于天然和合成高分子、纳米复合材料的最新趋势,概述了聚己内酯(PCL)、聚(乳酸-乙醇酸)(PLGA)、PEG、PLA和聚氨酯(PU)基纳米复合材料近期研究进展。引入纳米纤维膜的复合材料具有诸多优势,如比表面积大、力学强度高、稳定性高、细胞易于黏附、增殖等。此外,纳米纤维膜的加入为细胞构建了类细胞外基质(ECM)结构。Bharadwaz等研究证实纳米材料掺入复合结构可以有效提高碱性磷酸酶(ALP)活性,Runx-2蛋白活性以及促进胶原蛋白(Col)I型基因表达。这种混杂结构具有最佳的孔隙率和力学性能,增强了养分和生长因子在纳米复合支架中的输运,从而促进新骨组织的发育。纳米复合生物材料的性能可通过调节聚合物与纳米粒子或纳米纤维比例以及制备方式等调控。与普通3D支架相比,水凝胶基聚合物支架具有显著的优势,水凝胶基聚合物支架可以作为嵌入纳米粒子或纳米纤维的可注射支架。以水凝胶纳米颗粒为基础的可注射支架是减少支架植入过程侵入性的理想材料,可广泛应用于颅面缺损的治疗。支架的降解性能与聚合物基质的交联程度密切相关。在生物相容性和降解性方面,天然聚合物相比合成聚合物具有明显优势,而合成聚合物可通过物理、化学和制备方法等增强材料性能,促进细胞增殖和组织生长。但是由合成聚合物降解产生的副产物可能会引起周围组织中酸的积累等不良反应。因此,优化聚合物复合支架,是获得促进骨组织再生的支架材料的关键。由于纳米复合生物材料的细胞相容性和生物活性增强,可以促进骨组织修复与再生,因此在骨组织再生领域具有重要的研究意义。
仿生骨组织工程支架的构建是骨组织工程面临的严峻挑战之一,其具备与骨组织相似的力学性能和多孔结构。虽然静电纺丝技术可用于制备具有类细胞外基质结构的纳米纤维网络,但其形状和孔径的限制阻碍了其发展。在此,Chen等[19]结合冷冻干燥和交联技术制作了一种新型三维PLA/再生纤维素(RC)支架。由于随着RC纳米纤维的引入,支架的亲水性和生物活性得到了提高。柠檬酸作为无毒交联剂参与RC纳米纤维的酯化交联反应,其未反应的羧基基团也可以赋予三维支架促进磷灰石的成核能力,从而进一步提高成骨潜力。由此产生的PLA/RC纳米纤维重构支架具有高吸水率、类细胞外基质结构。另外,具有大量羟基和羧基的PLA/RC支架在模拟液体(SBF)溶液中表现出优异的生物矿化能力。而形成骨状的磷灰石不仅可以对PLA酸性降解产物起到中和作用,同时也有利于促进植入支架的骨整合。整个制备过程安全、环保、经济,能很好地满足生物医用材料的需求,PLA/RC支架在骨组织工程领域具有广阔的应用前景。
Deval等[20]使用静电纺丝法成功制备了以PLA/骨形态发生蛋白2(PLA/BMP2)为核,PLA/牛磺熊去氧胆酸(TUDCA)为壳的同轴纳米纤维支架用于骨组织支架的应用,如图4所示。

图4 PLA同轴纳米纤维的制备示意图Fig.4 Schematic diagram of preparation of PLA coaxial nanofibers
TUDCA和BMP-2在内皮细胞和间充质细胞中表现出增强的血管生成和骨生成作用。用人骨髓间充质干细胞(hMSCs)和人脐静脉内皮细胞(HUVECs)对PLA和同轴纳米纤维支架进行细胞相容性测试,两者均表现出良好的细胞相容性,但同轴纳米纤维支架表现出更优异的细胞相容性。细胞培养实验证实hMSCs和HUVECs具有良好的成骨和血管生成活性。组织学染色图片显示,负载TUDCA/BMP 2同轴纤维支架在骨形成和新血管形成中具有良好的效果。同轴纳米纤维支架可以长期缓释TUDCA和BMP2用于血管形成和成骨,从而促进缺损部位骨组织修复。因此,负载TUDCA/BMP2的PLA基同轴纳米纤维支架可作为一种有前景且更有效的骨组织工程支架。
骨膜来源于中胚层的间质,由间质细胞和无定形基质组成。在骨骼发育过程中,间质首先集中形成软骨模型和富含间质细胞的纤维膜,也称为软骨膜。随着软骨膜的血管化,间质细胞增殖并分化为成骨细胞,然后包裹在软骨周围形成一层原始骨组织,称为骨领。随着骨领的形成,软骨膜逐渐发育形成骨膜结构[21-22]。随后,由于骨膜中的血管和成骨细胞侵入软骨,软骨细胞发生变性和凋亡,最终软骨基质钙化,实现软骨内成骨过程。骨膜成骨细胞分泌骨基质和纤维,逐渐矿化,最终以膜内成骨[26]的形式嵌入钙化基质。
骨膜在骨的发育和损伤愈合过程中起着重要的作用。Wu等[23]制备了一种可持续释放血管内皮生长因子VEGF的微米/纳米纤维仿生骨膜,作为外源性血管化骨膜纤维层,通过胶原自组装和微溶胶静电纺丝技术,诱导体内内源性形成层完全再生形成骨膜和骨组织[24]。VEGF是一种广泛应用的生物活性因子,是一种强有力的血管生成蛋白,参与内皮祖细胞的聚集、增殖和分化。此外,它还直接或间接参与膜内成骨和软骨内成骨[25-26]。然而,由于VEGF的生物半衰期较短,因此VEGF的有效给药通常依赖于高剂量或多次注射,且存在潜在的副作用[27]。因此,有必要开发一种局部给药系统来持续释放VEGF。通过微溶胶静电纺丝技术,Wu等成功合成了以溶胶包覆VEGF颗粒为核心,PLA为外壳的核-壳结构。将透明质酸在静电纺丝混合液中分散形成乳状液,乳状液中的微滴称为微溶胶颗粒,这样的乳液不仅可以在有机溶剂中形成一个隔离系统来保持VEGF的生物活性,还可以起到缓慢释放VEGF的作用。此外,PLA纤维核心的透明质酸是结缔组织细胞外基质的重要成分,具有抗炎、抗菌和成骨作用[28],因此,选择透明质酸溶液作为VEGF的载体。VEGF在纤维内的持久释放诱导了内皮细胞的成熟,并在早期缺氧环境中形成血管,带来了大量的营养物质、生长因子和自体血源干细胞。此外,成熟的内皮细胞还可释放BMP-2、BMP-4等成骨活性物质,进一步促进骨修复[25-26,28]。
肌腱是束状纤维结缔组织,通过提供压力转移和稳定关节,在肌肉骨骼活动中起着至关重要的作用[36]。然而,肌腱组织极易受到各种体育锻炼、肌腱疾病和事故的损伤,其固有的愈合能力较差[29-30]。传统的临床治疗方法包括自体移植、异体移植和异种移植[31]。自体移植增加了患者的痛苦,异体移植和异种移植存在不良反应风险[32-33]。
组织工程(TE)被认为是一种很有前景的再生肌腱修复策略[34-36]。许多研究都强调了适当设计纤维支架的重要性[37-38],其可以模拟天然肌腱细胞外基质(ECM)的纤维微结构和功能特征[29,39-40]。目前,各种纤维制造技术和纺织工艺已被用于设计和构建纤维结构[41-42]。通常包括2个步骤,通过湿纺纱或干纺纱工艺生产微米级纱线,随后通过纺织技术组装成性能可调控的2D或3D结构[43-44]。如图5所示,Wu等[45]设计了一种改进的静电纺丝装置[45]。

图5 混纺纱制备图Fig.5 Preparation diagram of blended yarn
PLA基医用材料也可以通过制备工艺改善其性能,复杂的层次结构的构建可以增加天然材料的强度与韧性,然而,完全复制天然结构材料的构架已被证明是困难的。受致密骨的层次结构的启发,He等[46]使用一种创新的方法,在工业规模上构建了具备模拟骨结构的PLA支架,其同时具有超强韧性(90.3 kJ/m2)、高刚度(2.15 GPa)、平衡强度(52.6 MPa)和显著的抗热变形性能(在163℃下保持1 h),这些优异的性能使其在人工骨和组织支架等领域具有巨大的应用潜力。
3 PLA/无机复合材料
PLA/无机复合材料不仅具备良好的生物活性、生物相容性和合适的降解性,同时可以提高人工骨材料的力学性能、物理性能、可加工性能等,另外,无机材料的添加可以通过改变无机物的种类赋予PLA/无机复合材料不同的生物活性,例如:通过掺杂生物活性玻璃,PLA/无机复合材料在体内降解过程中可以缓慢释放钙、磷等元素,为骨生长提供必要的微量元素,在满足患者不同骨缺损部位的力学性能要求的同时,具备生物活性,可以促进骨缺损处骨组织的生长。
PLA和HA的复合材料已经广泛运用于生物医用材料中,Bankole等[47]将PLA与5%和20%磷灰石(cHA)复合构建3D打印支架。通过SEM和能量分散x射线(EDX)技术对支架进行了表征,证实HA在支架中分散均匀。通过计算机断层扫描成像技术对支架进行微观结构分析,以确定粗糙度、孔径分布的形态参数、孔隙率。此外,使用体外和微量分析测试评估不同几何形状的PLA/cHA支架的生物相容性,以评估其形貌对物理化学和力学性能的影响。这些结果和发现适用于许多生物材料工业的生物材料的发展,已与生物系统工程相结合,以满足医疗目的。
Wu等[48]将可降解聚合物PLA和HA的复合材料用作骨丝。评估了3种HA含量为5%、10%、15%的PLA/HA复合配方,并使用这些材料打印了放大的人类骨小梁模型。通过微计算机断层扫描、压缩和螺钉轴向拔出力实验对打印模型的形貌和力学性能进行了评价。结果表明,可以使用熔融沉积(FDM)法将PLA制备骨小梁结构,HA颗粒的加入降低了3D打印精度,但制备所得的支架具备更高的力学性能。与常用的聚合泡沫合成骨模型(即锯骨)相比,放大后的模型显示出了略微增强的强度。通过3D打印的PLA/HA复合材料制备模拟骨小梁形貌的组织工程支架极具发展潜力。
近些年来,已有数种由PLA制成的用于骨折固定的螺钉应用于临床,然而,PLA降解时间长且缺乏与骨骼结构的骨整合作用,因此使用降解速度更快的聚合物(如PLA-羟基乙酸共聚物(PLGA))和生物陶瓷来提高PLA基骨组织工程支架的生物活性是目前研究的热点。加入生物陶瓷后,PLGA板的热性能和力学性能都得到了改善,更适合应用于骨组织修复与重建中。
4 PLA/有机/无机复合材料
PLA/有机复合材料可以改善其生物活性和增加生物相容性,针对性地治疗骨骼类疾病等,PLA/无机复合材料主要是在改善骨修复材料的力学性能的同时提供给骨生长必须的微量元素,促进骨缺损处地修复。而PLA/有机/无机复合材料是在上述2种复合材料上更进一步地使人工骨组织材料性能得以提升的一种材料,PLA/有机/无机复合材料是有机和无机物之间的复合,取长补短,其优异且全面的生物相容性、可加工性、无毒性、可控的降解性、生物活性等为理想的骨组织修复材料提供了更大的发展空间。
PLA纳米填充材料也常常被用来满足一些特定的需求,Fahad等[49]采用熔融纤维制备技术构建了磁性和导电填料增强的可生物降解PLA和PLA纳米复合材料,并对其生物活性和生物降解特性进行了研究。热分析证实存在约18%的碳纳米结构(CNF)和石墨烯纳米片(GNP)和~37%的磁性氧化铁(Fe2O3)颗粒。在体外降解实验中,在培养基浸泡2周和4周后,支架出现了多孔和断裂,但质量损失可以忽略不计。与纯PLA相比,加入磁性氧化铁(Fe2O3)颗粒的PLA和加入碳纳米结构的PLA降解速率增加。体外细胞活性研究表明,PLA、PLA/CNF及PLA/Fe2O3均具备良好的细胞相容性。压缩试验结果表明,PLA/CNF和PLA/Fe2O3的刚度分别从680 MPa下降到533 MPa和425 MPa,支架中孔隙的存在,降低了其力学强度。因此,添加导电填料的PLA纳米复合材料的生物活性更强且生物降解速率更快,在骨组织修复与再生领域具备极大的潜在价值。
在生物聚合物中,几丁质是第二大天然聚合物,其不但具备无毒、良好的生物相容性和生物降解性,同时也具备促进伤口愈合的特性[50-52]。几丁质被广泛应用于食品和农业、纺织、化妆品、废水处理等许多领域[53-56]。几丁质作为生物材料主要应用于伤口敷料和受控药物释放材料[57-59]。其他常用于组织再生的可生物降解聚合物包括聚乙醇酸(PGA)、PLA、PGA-PLA共聚物、聚羟基烷酸(PHA)和聚己内酯(PCL)[60-64]。PLA是一种线性脂肪族热塑性聚酯具有广泛的可用性且易于加工[60,65-67]。基于PLA的生物降解性、生物相容性,其已被广泛地用于外科植入材料、药物传递系统以及组织工程支架[68-70]领域。PLA具有较高的弹性模量(3.5~3.8 GPa)和拉伸强度(48~110 MPa),然而,聚合物固有的脆性和低韧性限制了其应用[65-67]范围。HA被认为是骨的主要无机成分,广泛用于人工骨替代研究[71-72]。商业化的HA在化学和结构上都与人骨[73]的无机相相似,可以提高多种高分子材料的力学性能[74-76]。以HA纳米粒子为基础的生物纳米复合材料在生物医学应用领域具有极大的发展潜力[77]。HA可以刺激成骨细胞的生长和分化,然而,纯HA易碎,缺乏柔韧性和硬度,难以形成特定形状,强度太低,不适于组织替代应用[77-79]。基于上述性质,共混聚合物是一种有效优化材料性能的方法。
Chakravarty等[80]证实由PLA和HA增强的几丁质具有良好的力学性能和热性能,在生物医学方面具有发展潜力。以离子液体1-乙基-3-甲基咪唑乙酸([C2 mim][OAc])为溶剂,制备几丁质/PLA/nHA复合材料,探究聚合物浓度对复合材料导电性能的影响。利用SEM、力学试验机等对其力学、热性能和表面形貌进行了详细的评价。当PLA在复合材料中的含量从20%增加到80%时,材料的拉伸强度提高了77%,断裂伸长率和韧性显著下降。HA的加入可以使复合材料的拉伸强度提高140%,断裂伸长率提高465%。细胞毒性实验证实,复合材料利于骨细胞OCY454的生长和增殖,这些材料对骨细胞基因表达没有影响,而且具有最小的细胞毒性和适合的生物降解性。这些结果表明,相比于纯几丁质等材料,复合材料更合适应用于骨再生。PLA和HA的加入显著提高了材料的力学性能和生物活性,有助于骨细胞的生长和增殖,是骨再生的理想材料,具有广阔的医学应用前景。
5 结语
PLA具备优异的细胞相容性、良好的生物降解性、易于加工等优势,但其脆性较大、无生物活性等缺陷限制了其在骨组织工程领域的应用,因此PLA改性、复合支架的研究是国内外研究的热点与难点,设计构建具备生物活性、合适力学性能及降解性能的PLA基复合支架具有重要的意义。总结了近些年来PLA基复合支架在骨组织工程领域的应用,并对PLA支架力学、生物学性能的影响因素进行了分析与讨论,为PLA基复合支架的设计与构建提供了理论基础。通过与有机、无机材料的复合,PLA基复合支架在具备易加工、可降解等优势的同时可具备多种生物活性:药物的添加可治疗骨骼类疾病;生长因子的添加可促进细胞分化、血管生成,从而促进骨组织的修复与再生;生物活性玻璃的添加可以缓慢释放骨组织生长所需的微量元素。因此,PLA基复合支架通过个性化的设计,可以实现多种骨骼类疾病的治疗、骨缺损部位的快速修复。另外PLA基复合支架可在体内降解,患者不需进行二次手术,减少了患者身心痛苦及经济负担。PLA基复合材料具有巨大的发展前景,随着科技进步,个性化设计的PLA基复合材料将会更多地应用于骨外科手术中。

