多羧酸基MOFs及其衍生物作为锂离子电池负极的研究进展
杨道祥,张宇航,史发年
(沈阳工业大学 环境与化学工程学院,辽宁 沈阳,110870)
锂离子电池因具有较大的能量密度、较长的使用寿命以及环境友好等特点,广泛用于便携电子设备、新能源汽车和大规模储能电站等领域[1-2]。随着科技的进步以及储能设备的日益普及,推动了对低成本、高容量和长循环寿命充电电池的需求[3-4]。目前常用的锂离子电池负极材料为石墨,其理论容量较低(372 mAh·g-1)和倍率性能较差[5]。因此,开发具有优异倍率能力和长循环稳定性的锂离子电池负极材料具有重要的意义[6]。
金属有机骨架(Metal-Organic Frameworks, MOFs)材料是指有机配体与金属离子或金属簇通过配位键和氢键自组装形成的具有周期性网络结构的晶体材料[7-9],也称之为配位聚合物(Coordination Polymers)[10-11]。MOFs具有超高的比表面积和孔隙率、高的热稳定性和化学稳定性、可调控的孔道结构等优点,其多孔结构能够提供更多的Li+扩散通道及嵌入量,提高了锂离子电池的能量密度和循环性能[12]。对于大多数的MOFs材料,配位作用对构建骨架结构最为关键,选择不同种类和尺寸的有机配体、或者对配体上的官能团进行修饰,可以获得不同孔结构和比表面积的多孔材料[13-14],这种组成和结构的多样性也导致了MOFs功能的多样性和可调性[15]。近年来大量的MOFs是利用含羧基的配体合成的,此类型的有机配体可以作为氧化还原活性中心与Li+结合。一般而言,在锂的嵌入/脱出过程中,金属离子参与了转换机制,从而导致MOFs框架的破坏,以羧酸基团为配体合成的MOFs能减少中心金属离子直接参与氧化还原过程,提高其结构稳定。MOFs材料具有绝缘性质使其在锂离子电池上的应用受到了一定的限制,因此研究者将其与导电性材料结合形成具有特殊结构的MOFs复合材料,该材料具有好的导电性、倍率性能以及循环稳定性,这归功于MOFs复合材料的特殊结构以及理论容量高的MOFs和高导电性材料的协同效应。
MOFs具有纳米大小的空腔和开放的通道,为小分子的进入和脱出提供了途径,这种独特的结构特性使其可以作为牺牲模板制备具有特殊形貌的金属氧化物作为负极材料。因此许多研究者以惰性气体热解、空气退火、微波照射或溶液溶解等方法对MOFs进行处理,以MOFs材料为前驱体合成具有高比表面积、多孔纳米结构的金属氧化物[16-18]。MOFs衍生金属氧化物具有许多独特的优点,包括控制化学成分、可调孔隙度、高表面积、缩短电子和离子传输距离等[19-20]。同时金属氧化物也具有导电性差和在循环过程中体积变化大的缺点,因此,研究者将MOFs衍生的金属氧化物与各种功能性材料相结合的复合材料来提高其电化学性能。研究表明MOFs衍生的金属氧化物与碳基材料(如石墨烯、碳纳米管、氮掺杂的碳基材料等)的复合可以缓解锂离子嵌入/脱出过程中的体积膨胀、提高电子电导率[21]。
不同结构的MOFs材料及复合材料在锂离子电池、锂硫电池以及超级电容器等电化学储能设备中都有较为广泛的应用(图1)[22]。其中以羧酸基团为有机配体与金属离子合成的多羧酸MOFs作为锂离子电池负极材料较商用石墨具有更好的倍率性能和循环稳定性,其主要原因是羧酸基团可为锂离子的快速扩散提供结合位点;部分共轭羧酸基团中芳香核的存在具有强的π-π相互作用,提高了MOFs材料骨架结构的稳定性。同时多羧酸有机配体的种类和用量、金属原子的种类、反应条件以及合成方法的不同能够影响多羧酸基MOFs的结构,从而影响其作为锂离子电池的电化学性能。因此,基于多羧酸基MOFs在电极材料中的最新研究进展,对多羧酸基MOFs、多羧酸基MOFs的复合材料、多羧酸基MOFs衍生的金属氧化物及其复合材料进行了分类综述,主要阐述了它们的合成方法、形貌特征及其电化学性能,为广大研究者提供相关方面的文献总结。

图1 MOFs及其复合物在LIBs、Li-S和SCs中的应用[22]Fig.1 Application of MOFs and their composites in LIB, Li-S and SCs[22]
1 多羧酸基MOFs材料作为锂离子电池负极材料
1.1 单金属MOFs
2006年,LI等[23]就首次提出了单金属MOFs作为锂离子电池电极材料的可能应用,作者通过溶剂热法合成了MOF-177(ZnO4(1,3,5-三(4-羧基苯基)苯)2)。由于MOF-177结构中存在大量的孔洞使其在第一次放电过程中表现出较高的不可逆容量(400 mAh·g-1),但在随后的循环过程中由于锂的脱嵌使其结构遭到破坏,进而导致其容量衰减(105 mAh·g-1)。虽然MOF-177的电化学性能并不高,但是单金属MOFs在锂离子电池电极材料上的应用依然具有较好的前景,因为其反应位点多、合成法简单以及在结构上与其他电极材料相比也具有一定的优势。随后研究者们开发出了具有二维、三维框架结构的单金属MOFs,将其作为锂离子电池负极材料,并研究其电化学性能。HU等[24]用PbNO3与4-(4-羧基苯基)吡啶-N-氧化物合成了具有菱形通道的三维骨架结构Pb-MOF(图2a),其菱形通道相互连接贯通使锂离子的扩散和转移更加容易,因此具有较高的放电比容量(首次放电比容量为1 522 mAh·g-1)。同时其刚性有机配体和共轭体系使Pb-MOF骨架结构在长时间循环后仍然具有较好的稳定性(在电流密度为100 mA·g-1的条件下,循环500次后,放电比容量为489 mAh·g-1)。在X射线光电子能谱(XPS)的研究中,发现有机配体中的N-氧化物、羧酸根、苯环、吡啶环都可作为Li+的结合位点,有机配体在锂存储机制中起着关键的作用。GOU等[25]用对苯二甲酸与金属钴合成了具有三维框架结构的Co-MOF,其在50 mA·g-1的电流密度下能够接受约16Li+,因此其首次放电比容量高达1 385 mAh·g-1;在电流密度为100 mA·g-1条件下,循环50次后,放电比容量为650 mAh·g-1,这相对于其他由苯二甲酸合成的单金属MOFs来说电化学性能有了显著的提高。LIU等[26]认为从二维金属配位聚合物中寻找锂电池电极材料可能是一条新的途径,作者利用可变价的金属离子和低分子量有机配体进行配位,获得了具有良好电化学性能的二维金属配位聚合物(Mn-LCP)。该MOF由2,3,5,6-四氟对苯二甲酸、4,4′-联吡啶与四水合醋酸锰在水溶液中反应合成,具有八面体结构(图2b),其首次放电比容量为1 807 mAh·g-1,但在第二次循环后其容量降至552 mAh·g-1,其巨大的容量损失主要是第一次循环后电解液的分解所致。在XPS测试结果中发现Mn-LCP在第一次放电后形成了金属锰,这为今后的可变价金属离子在锂脱嵌过程中的变化提供了参考价值。铁基结构的MOFs由于其相对较高的热稳定性,低成本和低毒性是最有前途的MOFs材料类型之一。HU等[27]用Fe与1,3,5-苯甲酸(H3BTC)配位合成了一种新型Fe-MOF,其形貌为均匀分散的颗粒并聚集在一起。Fe-MOF的高孔隙率为框架内的锂离子迁移提供了开放结构,并为充电和放电过程中锂离子的嵌入/脱出提供了活跃的反应位点,因此其具有较高的放电比容量(首次放电比容量为1 765 mAh·g-1)。通过粉末X射线衍射(PXRD)的结果表明Fe-MOF骨架结构具有较好的稳定性,可以实现锂离子多次的嵌入与脱出。纳米尺度大小的Fe-MOF缩短了锂离子和电子的扩散途径以及其较大的外表面积可以促进锂离子在电极和电解质界面的快速传输,提高了倍率性能(在电流密度为100 mA·g-1的条件下,循环100圈后,放电比容量为1 021 mAh·g-1)。
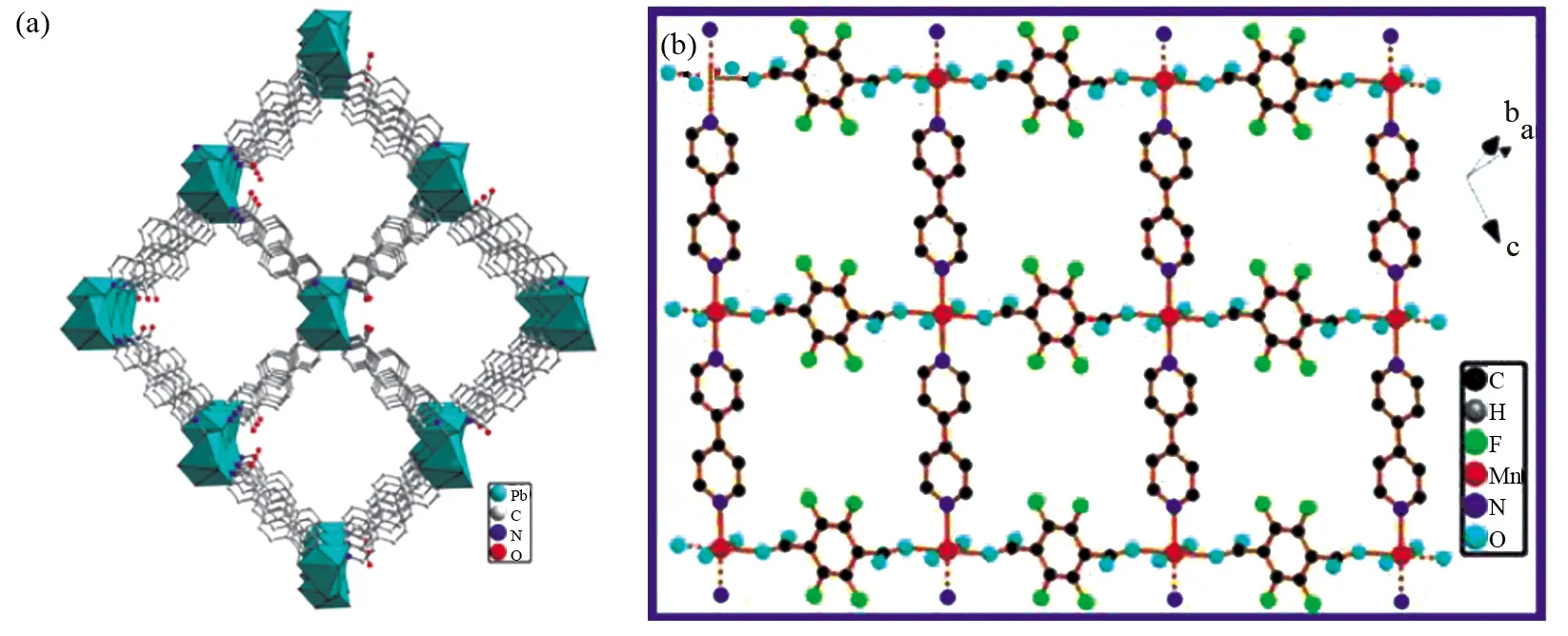
图2 Pb-MOF的三维框架结构图(a)[24]和Mn-LCP的二维层结构(b)[26]Fig.2 Three-dimensional frame structure of Pb-MOF (a)[24] and two-dimensional layer structure of Mn-LCP (b)[26]
影响MOFs结构的因素除了金属离子和配体的选择外,反应条件及合成方法对MOFs的多维结构也起到至关重要的作用。最初HAN等[28]以1,4,5,8-四羧酸基萘为配体,Li或Ni为金属原子,采用流变相反应法合成了Li-NTC MOF和Ni-NTC MOF(图3a和图3b)。Ni-NTC MOF因其结构中存在未成对电子展现出良好的导电性以及较高的初始比容量(1 823 mAh·g-1)。但Ni-NTC MOF结构稳定性较差,充放电循环80次后比容量下降至238 mAh·g-1。Li-NTC MOF则展现出较好的结构稳定性,但其比容量较Ni-NTC MOF低(首次放电比容量为568 mAh·g-1,在电流密度为100 mA·g-1条件下,循环80次后仍有468 mAh·g-1的比容量)。LI等[29]采用Co与1,3,5-苯三甲酸(BTC)进行配位并通过溶剂热法合成了Co-BTC,其中选用了三种不同的反应溶剂(EtOH、DMF、EtOH/DMF)使合成的Co-BTC具有三种不同结构。扫描电镜图(SEM)的结果表明Co-BTC的形态和尺寸很大程度上依赖于反应溶剂,当反应溶剂为EtOH时,Co-BTC是由3~8 μm的单分散微球组成;反应溶剂为DMF时,其具有二维层状结构;在EtOH和DMF的混合溶剂中其表现出更明显的层流形态,侧壁由长50~300 nm、宽50 nm的纳米棒组成。三种不同结构的Co-BTC在100 mA·g-1电流密度下的循环稳定性无明显差异;但当电流密度达到2 A·g-1时,CoBTC-EtOH在500次恒电流充放电循环后,保持了473 mAh·g-1的可逆容量,而CoBTC-DMF和CoBTC-EtOH/DMF仅有257 mAh·g-1和285 mAh·g-1的可逆容量,这是由于具有空心微球结构的CoBTC-EtOH可以促进离子或电子的快速传输和电解液的注入,且在锂插入/脱出过程中能够适应体积的膨胀/收缩并保持结构和界面稳定。此外在CoBTC-DMF和CoBTC-EtOH/DMF中的DMF可能对电化学性能有害,导致可逆容量低于没有配位溶剂的CoBTC-EtOH。通过对Co元素在循环过程中氧化状态的非原位软X射线吸收谱(sXAS)的研究表明,在充放电过程中,Co离子的能量位置没有明显变化,这意味着在充放电过程中Co离子基本保持在Co2+状态不变,此外通过1H魔角旋转核磁共振(1H MAS NRM)测试表明锂离子在电化学循环过程中被插入到Co-BTC的有机部分(包括羧基和苯环),没有Co离子的直接参与。GE等[34]采用溶剂热法将Co与BTC反应合成了具有锯齿状结构的Co-BTC,作者将聚乙烯吡咯烷酮(PVP)溶解于DMF和乙醇的混合溶液中,并将其作为反应溶剂,由此合成的Co-BTC作为锂离子电池负极材料具有高的锂储存容量(在电流密度为100 mA·g-1的条件下,首次放电比容量为1 739 mAh·g-1)和库仑效率(循环199次后库仑效率为99%)。Co-BTC中大量的空腔及客体分子(DMF、H2O等)的存在有助于提高第一次放电容量。此外,研究发现,其连接体的结构促进了电荷的有效可逆转移,共轭羧酸具有更强的π-π相互作用,这两者都在锂离子的储存机制中发挥了关键作用。通过对两种不同的Co-BTC进行比较,我们可以得到不同的反应条件对MOFs的结构起着重要的作用,从而影响其电化学性能。

图3 Li-NTC晶胞分子堆积图(a)[28];Ni-NTC晶胞分子堆积图(b)[28];分别用三种不同溶剂制备Co-BTC的原理图(c)[29]Fig.3 Li NTC cell molecular packing diagram (a)[28], Ni NTC cell molecular packing diagram (b)[28], and schematic diagram of Co-BTC prepared with three different solvents respectively(c)[29]
关于单金属MOFs材料电化学性能详细总结于表1中。

表1 单金属MOFs材料电化学性能Table 1 Electrochemical properties of single metal MOFs materials
1.2 双金属MOFs
通常情况下,单金属MOFs循环性能好的比容量较低,比容量高的结构稳定性差,因此为了平衡这两个性能参数,研究者们尝试采用不同金属离子制备双金属MOFs,从而利用不同金属离子间的协同效应获得更为优异的综合电化学性能。
在最初的研究中,HAN等[28]将比容量高的Ni-MOF与结构稳定性好的Li-MOF以1∶1的质量比研磨混合得到Li/Ni-MOF,红外光谱图显示Li-NTC MOF与Ni-NTC MOF在混合的过程中没有发生化学反应,这种通过简单地研磨混合而成的Li/Ni-MOF虽然采用的不是化学合成的方法,但是却结合了Li-NTC MOF与Ni-NTC MOF各自的优点,大大提高了材料的整体电化学容量和循环稳定性。随后研究者们采用水热法、溶剂热法等合成了双金属MOFs。李天[37]在Mn-BTC单金属MOF的基础上进行改进,向其中掺杂金属钴,合成了具有更高比容量以及更好的电化学稳定性的双金属有机框架材料MnCo-BTC,在100 mA·g-1的充、放电倍率下进行充放电,150圈后仍然拥有901 mAh·g-1放电比容量。将充、放电倍率增大到500 mA·g-1时,100次循环后容量仍可达到445.3 mAh·g-1。通过扫描电子显微镜观察到MnCo-BTC是由多个片层无序堆叠而成的(图4a和图4b)。其较好的导电性以及循环性能可能归因于均匀的片层堆叠可以在层与层间形成多个离子缓冲池,这不仅给电解液与电极材料提供了足够大的接触面积,同时也大大减少了锂离子向内部扩散的距离,从而提高其电化学性能。同时作者采用水热法合成了CoZn-MOF,并研究了金属配比、反应时间以及热处理脱溶剂等条件对最终产物电化学性能的影响。实验结果表明当Co/Zn金属比例为2∶1时合成的CoZn-BTC具有较高的容量,在100 mA·g-1的电流密度下进行测试,可以获得994.7 mAh·g-1的放电比容量,且具有优越的循环稳定性。关于双金属MOFs材料电化学性能详细总结于表2中。

图4 MnCo-BTC低倍率SEM图(a)和MnCo-BTC高倍率SEM图(b)[64]Fig.4 SEM of MnCo-BTC with low ratio(a) and SEM of MnCo-BTC with high ratio(b)[64]

表2 双金属MOFs材料电化学性能Table 2 Electrochemical properties of bimetallic MOFs materials
2 多羧酸基MOFs的复合材料作为锂离子电池负极材料
MOFs材料的导电性差使其在锂离子电池上的应用受到了一定的限制,因此研究者将其与导电性材料结合形成具有特殊结构的MOFs复合材料,该材料具有好的导电性、倍率性能以及循环稳定性。JIN等[39]采用简单的溶剂热法合成了不同配比的Fe-MOF/RGO复合材料。该结构呈现为二维RGO纳米薄片很好地包覆着八面体的Fe-MOF颗粒(图5a)。研究表明不同含量的RGO对Fe-MOF/RGO复合材料的电化学性能影响很大,在电化学性能测试中Fe-MOF具有较高的容量(首次放电比容量为2 213 mAh·g-1),但Fe-MOF具有较大的不可逆容量(首次库仑效率为35.5%),这是因为SEI膜的形成与其他不可逆反应的发生[40-41]。Fe-MOF/RGO(5%)和Fe-MOF/RGO(10%)的首次放电比容量分别为2 055.9 mAh·g-1和1 889.9 mAh·g-1,首次库仑效率分别为43.3%和39.7%。复合材料首次库仑效率的提高可能是由于RGO在Fe-MOF上有足够的涂层,从而避免了电极与电解液的直接接触。Fe-MOF/RGO(5%)与Fe-MOF/RGO(10%)相比具有更高的首次库仑效率,可能是由于锂与还原氧化石墨烯发生反应,过量的还原氧化石墨烯导致锂的损失。此外,Fe-MOF/RGO(5%)复合材料也表现出高容量和良好的循环稳定性。在电流密度为500 mA·g-1下循环200次后仍具有1 010.3 mAh·g-1的比容量,这可能归功于高理论容量的Fe-MOF与高电导率RGO的协同效应。LI等[42]认为RGO的金属螯合能力较弱,导致Fe-MOF/RGO电化学性能并没有明显的提高。因此他们采用羧基石墨烯(CGr)与基于锂离子与芳香螯合配体之间发生嵌入/脱出反应的Co2(OH)2BDC复合。CGr不同含量的Co-BDC/CGr(CGr分别占总质量的2%、5%、10%)中,Co-BDC/CGr(5%)具有较好的倍率性能和稳定性,在电流密度为100 mA·g-1时100次循环后具有1 368 mAh·g-1的可逆容量,这主要归功于Co2(OH)2BDC和CGr之间的协同效应以及高自旋Co2+的局域化和离域化之间的跃迁触发Co2(OH)2BDC中高效有机部分主导锂离子的穿插机制。CGr过高含量的Co-BDC/CGr(10%)并没有展现出好的倍率性能和稳定性,可能是由于过量的CGr减少了复合材料中氧化还原活性位点,阻止了电解液离子到电极表面的扩散。同时实验结果表明Co-BDC/CGr(2%)、Co-BDC/CGr(10%)与Co-BDC/CGr(5%)相比具有较少的比表面积和孔隙体积,这不利于在电化学循环过程中向Co-BDC/CGr内部活性中心提供大量的锂离子。
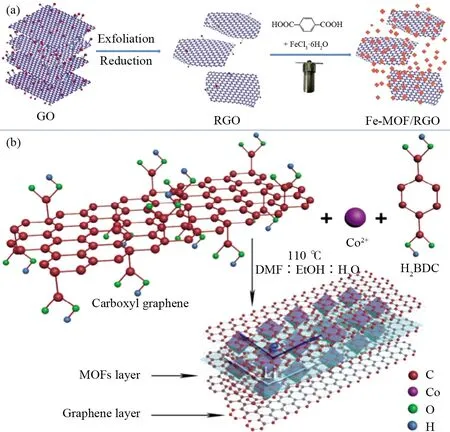
图5 Fe-MOF/RGO的合成示意图(a)[39];Co-BDC/CGr的合成示意图(b)[42]Fig.5 Schematic illustration for the fabrication of Fe-MOF/RGO (a)[39],and schematic illustration for the fabrication of Co-BDC/CGr (b)[42]
关于羧酸基MOFs复合材料的电化学性能详细总结于表3中。
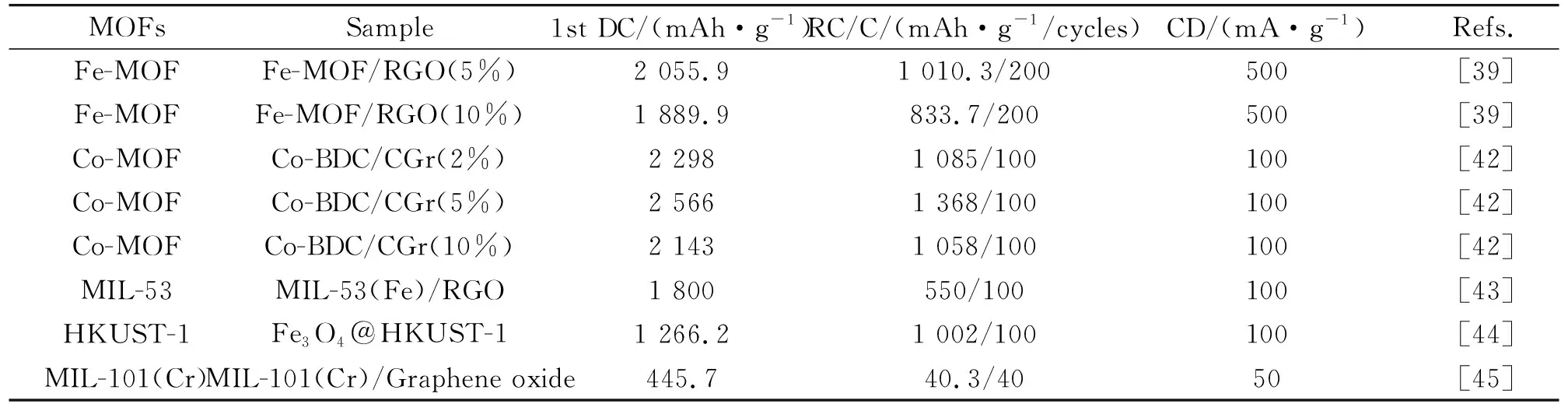
表3 多羧酸基MOFs复合材料的电化学性能Table 3 Electrochemical properties of MOFs composites
3 多羧酸MOFs衍生的金属氧化物作为锂离子电池的负极材料
3.1 单金属氧化物
研究者们利用MOFs独特的结构特点将其作为前驱体通过煅烧、退火等工艺合成金属氧化物。该材料大多具有多孔纳米结构,增加了电解液与活性物质的接触面积,为电化学反应提供更多的电活性位点,促进锂离子和电子在电解质/电极界面的转移;提供了足够的空间来适应体积变化进而提高其循环稳定性。
HU等[46]采用室温固固转化法并利用碱性溶液处理Cu-BTC制备出具有多级多孔结构的CuO八面体(HPCOs)材料(图6a)。HPCOs由许多平均横向尺寸约为250 nm的纳米片组装而成,基本上继承了Cu-BTC前驱体的形貌和尺寸。作为锂离子电池负极材料时优异的倍率性能以及循环稳定性(当电流密度分别为在0.5、2.0和5.0 A·g-1时,循环200、400和400次后的容量分别为1 062、615 和423 mAh·g-1)。其所表现出优异的电化学性能主要归功于其具有超薄、精细的二维纳米片结构。SOUNDHARRAJA等[47]采用金属有机框架(MOF-C)一锅燃烧法合成了平均粒径为30 nm的NiO的纳米颗粒。将该金属氧化物作为锂离子电池负极材料在500 mA·g-1的电流密度下,循环100次后,具有748 mAh·g-1的高可逆容量,在电流密度为1 A·g-1的条件下仍具有可逆容量为410 mAh·g-1,其好的倍率性能和高的可逆容量主要归功于NiO纳米颗粒以及其高的比表面积。GOU等[48]采用一锅溶剂热法合成了Co2(NDC)2DMF2,然后采用退火工艺在350 ℃下煅烧3 h得到Co3O4并用作锂离子电池负极材料。其展现出较高的可逆比容量(在电流密度为200 mA·g-1的条件下循环100次后有1 058.9 mAh·g-1的可逆比容量),优异的循环性能与倍率性能(在电流密度为100、200、500、1 000、2 000 mA·g-1时平均放电比容量分别为1 066、843、552、428、348 mAh·g-1)。其优异的电化学性能主要归功于在煅烧过程中产生的纳米级介孔颗粒增加了电解液与活性物质的接触面面积,缩短了锂离子的扩散途径,并适应了循环过程中的体积变化,从而获得了优异的电化学性能。上述三种金属氧化物中具有超细二维纳米片结构的CuO八面体材料具有最好的倍率性能,可能是由于在HPCO锂离子电池中存在表面氧化还原赝电容特性,这与其具有极薄和精细的二维纳米片结构密切相关,这种外在赝电容特性对高容量和快速的锂离子吸收非常有利。CAO等[49]报道了一种微型空心多面体Mn2O3(图6b),将其作为锂离子电池负极材料展现出优异的循环稳定性和倍率性能(在电流密度分别为1、2 A·g-1时循环1 200、1 000次后容量分别为819.8、760 mAh·g-1),这与其具有合适的空腔尺寸有着密切的关系。在第一次循环后微型空心多面体Mn2O3的小内腔消失,形成层次化的纳米结构,这种结构的演变是由转换机制的纳米尺寸效应引起的。电化学循环过程中体积膨胀是不可避免的,但是具有小内腔的Mn2O3为向内的体积膨胀提供空间,最后形成纳米颗粒均匀分散的层次化纳米结构。无空腔的多面体电极材料也会发生纳米尺寸效应,但是不平衡的膨胀张力可能形成中心拥挤的层次化纳米结构,这种结构处于不平衡阶段,易聚集、易坍塌。大空腔的电极材料由于缺乏相互作用的限制,内腔附近的纳米颗粒会不断膨胀导致结构崩溃。因此具有合适尺寸的内腔是多面体Mn2O3优异循环性能的主要原因。
除用多羧酸基MOFs作为前驱体合成金属氧化物以外,研究者们也以2-甲基咪唑为有机配体合成的ZIF-67作为前驱体合成了具有中空多孔纳米结构的金属氧化物。其作为锂离子电池负极材料也展现出优异的电化学性能。对两者的电化学性能做出了比较(表4)。SHAO等[50]采用对沸石咪唑酯骨架(ZIF-67)进行直接热解的方法,制备了具有十二面体结构且内部可控的Co3O4(图6c)。该Co3O4作为锂离子电池负极材料具有极高的可逆容量,当电流密度为100 mA·g-1时具有1 550 mAh·g-1的容量和优异的循环稳定性(100次循环后具有1 335 mAh·g-1放电比容量),且在2 000 mA·g-1的高电流密度下容量依然高达650 mAh·g-1。其优异的电化学性能主要归功于其中空多孔的纳米结构,缩短了锂离子和电子的扩散距离。

图6 HPCOs合成原理示意图(a)[46];微型空心、无空心、大空心多面体Mn2O3电极循环的结构演变示意图(b)[49];具有凹面的十二面体结构Co3O4的合成示意图(c)[50]Fig.6 Schematic illustration for growth mechanism of HPCOs(a)[46];schematics illustration of the structure evolutions of mini-hollow, bulk, and large-hollow polyhedron Mn2O3 electrodes with cycling(b)[49];schematic illustration of the formation of Co3O4 dodecahedrons with concave surfaces(c)[50]
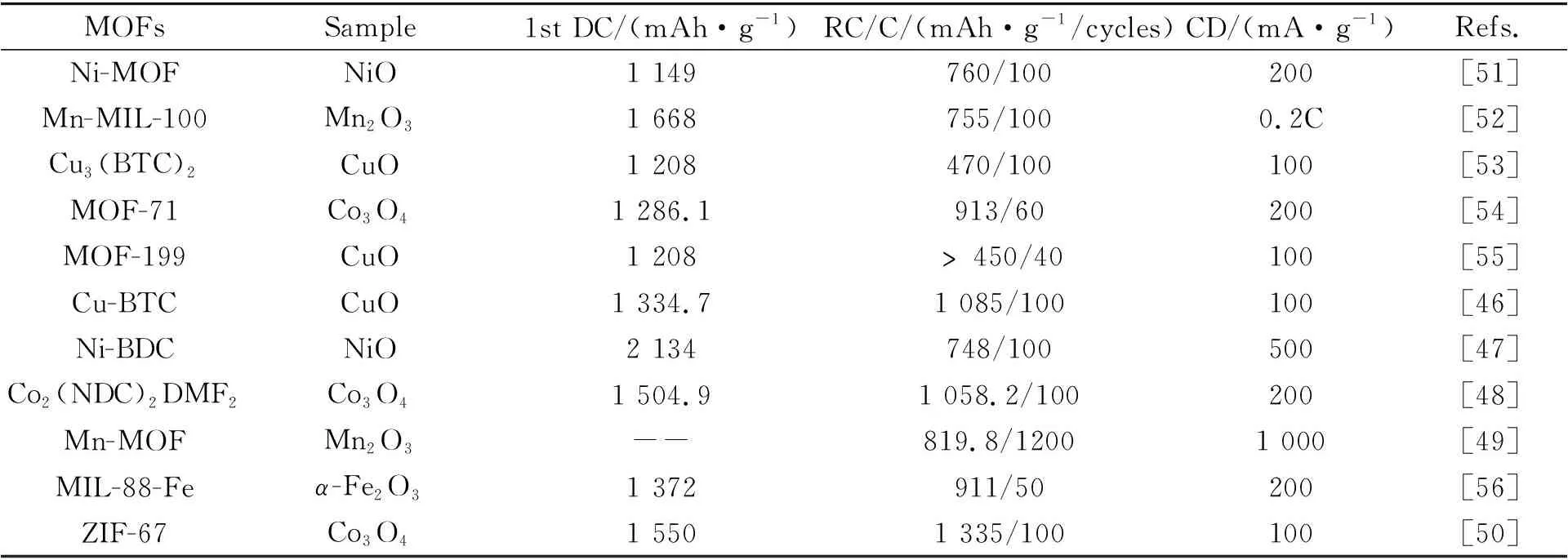
表4 单金属氧化物材料电化学性能Table 4 Electrochemical properties of mono-metal oxide materials
3.2 双金属氧化物
作为锂离子电池负极材料的MOFs衍生双金属氧化物的优点是:双金属氧化物比单金属氧化物具有更好的导电性,以及更丰富的氧化还原活性位点,这是由于两种活性金属的协同作用,电子转移的活化能相对较低;由于其独特的介孔结构,缩短电子传输路径,有利于离子迁移和扩散,同时缓解体积变化,使其在大电流下也能稳定运行[57]。
双金属氧化物的不同金属原子之间具有协同效应,同时能为锂离子提供更多的结合位点,从而相对于单金属氧化物能进一步提高其容量和导电性。LI等[59]报道了一种具有纳米颗粒相互连接的介孔结构的Co-Ni-O双金属氧化物。该负极材料是以2,5-二羟基-对苯二甲酸为有机配体与硝酸钴和硝酸镍通过一步微波溶剂热法制备的Co/Ni-MOF-74为牺牲模板,再通过热处理得到的(图7)。Co-Ni-O作为锂离子电池负极材料的初始放电和充电比容量分别为1 737和1 189 mAh·g-1,这一结果明显高于其相应的单金属氧化物的理论值(Co3O4: 890 mAh·g-1和NiO: 718 mAh·g-1),表明二元金属氧化物中不同组分之间具有协同作用。该材料在100 mA·g-1的电流密度下循环200次后仍具有比理论容量更大的容量1 410 mAh·g-1。有趣的是,可逆容量随着循环次数的增加而增加。同时也具有优异的倍率性能,在当电流密度为1 A·g-1时循环300次后,容量高达994 mAh·g-1;在电流密度分别为2和5 A·g-1时循环500次后容量分别为812和656 mAh·g-1。该Co-Ni-O双金属氧化物电极具有优异的电化学性能,主要归功于其纳米颗粒相互连接的介孔结构和两种活性金属氧化物组分的协同作用。

图7 一步微波辅助合成用于锂存储的双金属有机骨架及其衍生介孔Co-Ni-O纳米棒的示意图[59]Fig.7 Schematic diagram of one-step microwave-assisted synthesis of bimetallic organic skeleton for lithium storage and its derived mesoporous Co-Ni-O nanorods[59]
上述为以羧酸基团为有机配体与金属原子合成的MOFs前驱体,部分研究者也将ZIFs以及含有羧酸根的金属盐与有机配体反应合成的MOFs作为前驱体。将两者的电化学性能做出了比较(表5)。GUO等[61]采用了一种简单的方法制备了金属有机框架的多孔CoFe2O4纳米材料(图8a)。作为锂离子电池负极材料表现出优异的倍率性能,在电流密度为20 A·g-1时循环200次后具有815 mAh·g-1的放电比容量。GUO等[62]以纳米金属有机骨架(NMOFs)为前驱体,采用简单、经济有效的方法合成了一种空心镍铁氧杂化纳米材料(NiFe2O4)(图8b)。该金属氧化物用作锂离子电池负极材料表现出极好的电化学性能,并在电流密度为1~10 A·g-1的范围内具有稳定的循环性能,其首次放电比容量为1 245 mAh·g-1,在电流密度为1 000 mA·g-1的条件下循环200次后具有1 071 mAh·g-1的放电比容量。CoFe2O4和NiFe2O4都具有独特的空心纳米结构可以缩短电子和离子的传输长度,扩大电极的表面积,缓解Li+嵌入/脱出循环过程中的体积变化。此外,混合多元素特性允许体积变化在电化学循环中逐步发生从而获得了优异的电化学性能。

图8 CoFe2O4的合成、扫描电镜及循环性能(a)[61];空心NiFe2O4的合成示意图(b)[62]Fig.8 Synthesis, scanning electron microscopy and cycling properties of CoFe2O4 (a)[61]; schematic illustration of the formation of hollow NiFe2O4 (b)[62]
关于双金属氧化物材料电化学性能详细总结于表5中。

表5 双金属氧化物材料电化学性能Table 5 Electrochemical properties of bimetal oxide materials
3.3 双组分金属氧化物
以MOF@MOF作为模板合成的核壳结构双组分金属氧化物纳米复合材料通常集成两种功能材料,具有较强的协同效应,增强了各组分的离子电导率、电化学反应性和机械稳定性等特性[21]。金属氧化物用作锂离子电池高容量负极材料普遍存在体积膨胀导致电极粉末化的问题,通过合成具有核壳结构的复合材料有利于解决这种问题。LI等[63]通过在空气条件下对双金属有机骨架进行煅烧处理,制备了具有核壳结构的纳米ZnO/NiO微球。ZnO/NiO材料用作锂离子电池负极材料具有优异的循环稳定性(在电流密度为0.5 A·g-1的条件下循环1 000次后具有592 mAh·g-1的比容量)。GUO等[64]以MOFs为前驱体,采用两步微波辐照工艺制备了双金属纳米复合材料,并在空气中通过非均相工艺处理制备出具有多层空心结构的CuO@NiO球(图9a)。该材料在电流密度为100 mA·g-1时循环200次后具有放电比容量为1 061 mAh·g-1,远大于CuO的理论容量(674 mAh·g-1)和NiO的理论容量(718 mAh·g-1),库仑效率接近100%。ZnO/NiO微球和CuO@NiO微球优异的电化学性能主要归功于其具有独特的核壳纳米结构,这种结构不仅能够缓解体积变化,而且可以提供一个大的比表面积,促进锂离子的嵌入/脱出。WANG等[66]将具有TiO2涂层的MIL-101(Cr3+)热处理后形成了具有纳米核/壳结构的Cr2O3@TiO2八面体,该复合材料以TiO2为外壳并包含多个Cr2O3核心(图9b)。其核/壳结构中的空隙缓解了Cr2O3颗粒的体积变化,具有极强化学和结构稳定性的TiO2可限制内部颗粒的聚集以及保持结构的稳定性。其在电流密度为0.5 A·g-1时经过500次循环后具有510 mAh·g-1的容量。

图9 CuO@NiO的合成及循环性能(a)[64];具有核壳结构的Cr2O3@TiO2八面体合成示意图(b)[66]Fig.9 Synthesis and cycling properties of Cuo@NiO (a)[64]; schematic diagram of Cr2O3@TiO2 octahedron synthesis with core-shell structure(b)[66]
另外,研究者近年来采用ZIF-67以及其他MOFs为前驱体合成了双组分金属氧化物,作为锂离子电池负极材料具有优异的的放电比容量及循环性能。将其与多羧酸MOFs形成的双组分金属氧化物进行了对比(表5)。XU等[68]认为Co3O4作为一种有吸引力的锂离子电池负极材料,虽然得益于其高理论容量,但长期以来一直存在电输运低和体积变化剧烈的问题。因此作者通过阳离子交换法制备具有空心多面体结构的Co3O4/TiO2复合材料。该复合材料首次放电比容量为662 mAh·g-1,且容量保持率高达96.9%(图10)。该材料与上述以TiO2为外壳包含多个Cr2O3核心的Co3O4/TiO2复合材料有所不同,其在合成的过程中ZIF-67表面的部分Co离子先被Ti离子替换,再经过退火工艺处理得到空心多面体Co3O4/TiO2。二者都是利用TiO2来提高Cr2O3的结构稳定性并达到了一定的效果,但其容量却未能得到提高,反而低于Co3O4的理论容量(890 mAh·g-1),研究结果表明在电化学循环过程中TiO2几乎没有容量贡献。
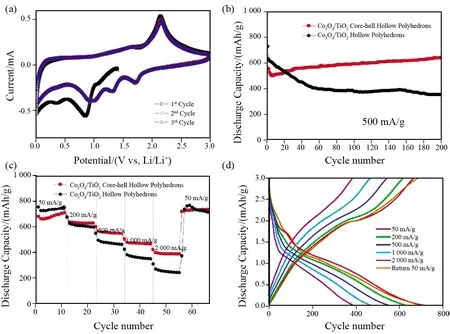
图10 扫描速率为0.1 mV/s时的CV曲线图(a);电流密度为500 mA·g-1时的循环曲线图(b);Co3O4/TiO2和Co3O4的倍率性能图(c);Co3O4/TiO2充放电曲线(d)[66]Fig.10 CV curve diagram at scanning rate of 0.1 mV/s (a); cycle curve diagram at current density of 500 mA·g-1 (b); rate performances of Co3O4/TiO2 and Co3O4 (c); charge-discharge curve of Co3O4/TiO2(d)[66]
关于双组分金属氧化物材料电化学性能详细总结于表6中。

表6 双组分金属氧化物复合材料电化学性能Table 6 Electrochemical performance of bicomponent metal oxide composite materials
3.4 金属氧化物与各种功能性材料相结合的复合材料
近年来研究开发出金属氧化物与各种功能性相结合的复合材料,复合材料中各组分具有各自独特的功能,复合材料中各组分的结合表现出独立组分的协同作用,克服了各自的缺点,保持了各自独特的功能,提高了复合材料的电化学性能[4]。
HE等[69]将Mn-doped MIL-53(Fe)粉末在Ar气氛的管式炉中退火2 h合成了MnO-Fe3O4@C复合纳米球材料(图11)。MnO-Fe3O4@C复合纳米球材料具有均匀的纳米结构,其直径约100 nm,每个纳米结构由聚簇的初级纳米粒子和无定形的碳壳层组成,形成独特的层次化纳米结构。作为锂离子电池负极材料显著提高了锂的存储性能,在电流密度为200 mA·g-1的条件下循环200次后仍具有1 297.5 mAh·g-1的比容量。其优异的电化学性能主要归功于多层多孔纳米结构、原位生成的碳层网络以及Fe3O4与MnO组分之间的强电子相互作用。PANG等[70]报道了一个由CoO纳米颗粒和氮掺杂的碳纳米管(NCNTs)组成的具有二维网络的CoO-NCNTs。该复合材料是通过对一个层状配位聚合物(Co-MOF)进行退火工艺得到的。用作锂离子电池负极材料表现出较好的循环稳定性,在电流密度为500 mA·g-1的情况下,获得2 000次循环的超长循环寿命,且每循环容量损失仅为0.006 3%。这主要归因于活性CoO被封装在NCNTs顶部,保证了优异的离子电导率,缓解了储能过程中的体积变化。此外,NCNTs相互缠绕,形成有效的导电网络,有利于离子转移。
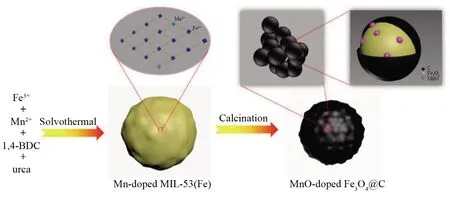
图11 复合纳米球MnO-Fe3O4@C的制作原理图[69]Fig.11 Schematic illustration for the fabrication of MnO doped Fe3O4@C composite nanospheres[69]
其他以ZIFs为前驱体与各种功能性材料结合合成复合材料,其电化学性能与多羧酸MOFs形成的复合材料进行了对比(表7)。SUN等[79]采用一种简单的超声波合成方法,成功地合成了一种具有独特三维海星状纳米结构的钴基金属有机骨架(Co-MOF)。在随后的碳化和氧化过程中,得到了一种具有多孔海星状纳米结构的碳纳米复合材料(Co3O4@N-C),该材料由氮掺杂的碳与具有多孔海星状纳米结构的Co3O4涂层组成。其独特的多孔海星状结构,有效地缓冲了锂离子插入/脱插入过程中的体积膨胀。同时,氮掺杂碳涂层提高了电导率,提供了一个缓冲层,以适应体积变化,加速形成稳定的固体电解质界面层。作为锂离子电池负极材料首圈放电比容量为1 385 mAh·g-1,在电流密度为500 mA·g-1条件下循环300次后放电比容量为795 mAh·g-1。GAN等[82]首先用一种简单的恒流电沉积方法在钛箔上生长出ZnO NRDs,然后采用水热法和退火工艺制备了C-ZnCo2O4-ZnO纳米棒(NRAs)(图12)。C-ZnCo2O4-ZnO纳米棒是由MOF(ZIF-8)衍生的碳包覆在ZnCo2O4-ZnO上。研究表明在纳米棒ZnCo2O4-ZnO表面均匀涂覆的MOF衍生碳层既可以作为导电基质,又可以作为缓冲层,抑制充放电过程中的体积膨胀。作为锂离子电池负极材料具有优异的倍率性能,在电流密度为0.5、1.0、2.0和5.0 A·g-1时其分别具有886.2、812.8、732.2和580.6 mAh·g-1的可逆比容量。这可以归结于锂离子扩散途径的缩短和均匀包覆的MOF衍生碳提高了电子电导率,从而给离子扩散和电子运输提供了激发动力。

图12 C-ZnCo2O4-ZnO的制作过程示意图[82]Fig.12 Schematic illustration of the formation of C-ZnCo2O4-ZnO[82]
关于金属氧化物与各种功能性材料相结合的复合材料电化学性能详细总结于表7中。
4 结论与展望
综上所述,有机配体、金属盐和溶剂等因素对MOFs的结构、电化学性能有着重要的影响。多羧酸基MOFs及其衍生物具有更高的容量,主要归因于羧酸根为锂离子的嵌入提供了结合位点;羧酸根中的氧原子对金属离子具有良好的亲和力;在MOFs形成金属氧化物和复合材料的过程中对其结构起到了调节的作用。对于金属氧化物与各种功能性材料相结合的复合材料而言,掺杂不同的功能性材料对其电化学性能具有重要的影响,因此选择合适的功能性材料进行掺杂非常重要。目前对电极表面和充/放电过程中MOFs结构变化的研究还不够。此外,电极材料的形貌和结构是Li+嵌入/脱出的一个非常关键的因素,需要对合成过程中的形貌控制进行重点研究。虽然复合材料和金属氧化物的电化学性能相对于MOFs有所提高,但是锂离子电池电极材料还存在两个主要问题,即充放电循环时不可逆的体积变化和电极材料的粉末化,从而导致了电池整体的倍率性能和循环稳定性受到限制。
在未来的锂离子电池电极材料的研究中仍需要注重以下几点:1)继续开发优良的MOFs材料;2)优化以MOFs材料为牺牲模板合成的金属氧化物的形貌与结构及其合成方法;3)开发合适的MOFs前驱体和选择合适的功能性材料进行掺杂;4)基于双金属氧化物电化学性能的提高,可以开发多金属氧化物并研究其电化学性能;5)增加对电极表面和充/放电过程中MOFs结构变化的研究;6)阐述锂与有机部分相互作用的机理;7)优化MOFs中锂的位置;8)降低成本,增加对安全因素和环境因素的考虑。

