污染食盐制备纯碱的综合与创新实验设计
刘雪茹,张荣兰,崔斌
西北大学化学与材料科学学院,化学国家级实验教学示范中心(西北大学),西安 710127
化学实验教学是培养学生创新能力和综合素质的重要环节,在理工学科创新人才培养中起着至关重要的作用。长期以来,如何加强实验课程的针对性和吸引力,激发大学生的学习兴趣,培养学生学以致用以及解决复杂问题的综合素质,是实验课程教学所面临的重大课题。西北大学化学与材料科学学院是教育部首批“三全育人”试点学院,拥有两个国家级一流专业建设点——化学和材料化学专业,在推进“一流专业与一流课程”建设过程中,重构实验教学培养方案,创新实验教学内容,建立培养具有综合创新素养的、适应社会需要的人才的实验教学体系,是适应时代需求的教学改革目标。而综合设计性实验,可改变传统灌输式的教学方式和生硬照搬的动手方式,培养学生融会贯通专业课程、应用相关知识通过自主设计解决实际问题的能力,训练学生创新设计思维模式,提升综合素养能力,是深入教学改革、提高教学质量、实现教学改革目标的重要手段之一。
“无机化学与化学分析实验”作为化学专业基础课程,注重于对无机化学和化学分析实验基本知识、基本原理和基本技能的学习掌握,注重于培养良好的实验习惯和实事求是的科学态度,提高分析问题和解决问题的实际能力,其中“综合与设计实验”部分旨在培养学生综合掌握和应用知识的能力,该部分内容的实施为学生以后进一步学习专业知识、强化科学研究能力及科学素养训练奠定基础,对于培养综合型、研究型与创新型人才发挥重要作用。
本实验立足于“无机化学与化学分析实验”课程的培养目标,将一个提纯实验(粗食盐的提纯)、一个制备实验(纯碱的制备)和一个组成分析实验(混合碱中碳酸钠含量的测定)综合到一起,开发了一个综合与设计实验项目,可编入无机化学与化学分析实验教材中,在学期末作为综合实验进行开展,同时可考查学生对于基础实验操作技能的掌握情况。首先,粗食盐的提纯实验相较于以往的教材,将粗食盐的组成进行了改进并增加了学生自主设计环节。主要改进体现在:本实验提供了三组不同组分的粗盐:粗食盐a (被污染),混入难溶性的泥沙和可溶性的杂质;粗食盐b (被污染),混入不溶性的泥沙和少量可溶性的Mg2+、Ca2+、SO42−杂质;粗食盐c (盐湖组成),含有较高浓度的等离子。学生分成三组,根据粗食盐中杂质种类和含量的不同自主设计实验方案提纯氯化钠。本实验中改进后的粗食盐提纯实验,可使学生了解海盐和湖盐的成分区别,体会杂质种类和含量不同引起的提纯方法的改变。其次,纯碱的制备实验是将侯氏制碱工艺流程设计改进引入大学实验课程内容中。侯氏制碱法作为国人独立创新的第一项工业工程技术成果,在中国工业史上占有独特的重要地位,其作为学科经典案例在教学中具有重要的价值。该工艺流程蕴含了丰富的化学反应原理和大量的实验操作技能,非常适合锻炼学生综合运用知识的能力,提升综合实验技能。侯氏制碱法的原理如下:
纯碱是重要的化工原料,被称为“化工之母”。目前工业生产纯碱主要有两种工艺。
一是索尔维制碱法,即氨碱法。主要以食盐、石灰石(经煅烧生成生石灰和二氧化碳)和氨气为原料来制取纯碱。其主要流程为:将氨气通入饱和食盐水生成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体:NH3+ H2O + CO2+ NaCl = NH4Cl + NaHCO3↓,再煅烧制得纯碱产品:2NaHCO3= Na2CO3+ H2O + CO2↑。含有氯化铵的滤液与石灰乳(Ca(OH)2)混合加热,所放出的氨气可回收循环使用:2NH4Cl + Ca(OH)2= CaCl2+ 2NH3↑ + 2H2O。
二是联合制碱法,又称侯氏制碱法。它是我国化学工程专家侯德榜先生(1890–1974)于1943年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气[1–4]。
侯氏制碱法包括两个过程:第一个过程与氨碱法相同,经煅烧得到纯碱产品和含有氯化铵和氯化钠的滤液。第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵。氯化铵与氯化钠在不同温度下溶解度不同,温度大于10 °C时,NH4Cl的溶解度大于NaCl;温度小于等于10 °C时,NH4Cl的溶解度小于NaCl。因此向滤液中加入细粉状的氯化钠,并通入氨气,待溶液饱和后冷却至0–5 °C,此时氯化铵结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的滤液,可回收循环使用:NaCl + NH3+ CO2+ H2O = NaHCO3↓ + NH4Cl。
侯氏制碱法在保留氨碱法优点的同时,消除了其缺点,使食盐的利用率得到提高;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成减少了环境污染,同时实现了废气的循环利用,节能环保,符合可持续发展理念。
在当前的实验教学中,对于侯氏制碱流程主要以微型化模拟课堂演示为主[5–8],学生体验不深且无法锻炼实际操作能力。本实验在讲解侯氏制碱法的原理和精髓的基础上,引导学生对侯氏制碱法进行设计改进:利用食盐与碳酸氢铵复分解反应制得碳酸氢钠,再热解得到产品纯碱。同时实验教学时以侯德榜事迹作为切入点,通过课堂讨论使学生明确侯氏制碱法的绿色创新理念,讨论该工业制备方法在不断改进过程中蕴含的创新思维与方法,学习侯德榜本人在实践过程中不怕困难、勇于创新的精神。不仅可加强学生的爱国主义情怀,树立学生立足当下解决实际问题的意识,以及可持续发展和环保理念。对于当下“一个实验一个特色,一个知识一个挑战,一次课程一次洗礼”的实验课程融合课程思政的教学体系的建设提供了思路以及参考价值。
最后,本实验中的组成分析实验部分,即混合碱中碳酸钠含量的测定也作了相应的调整。在工业纯碱制备过程中,通常用总碱度表示Na2CO3的含量,用甲基橙作为指示剂指示滴定反应的终点。而在本实验制备纯碱过程中为了准确测定Na2CO3的含量,我们采用双指示剂法(酚酞-甲基橙双指示剂)进行碳酸钠含量的测定并计算其含量。
整个实验过程中学生必须运用已学的知识,在充分理解与掌握提纯方法、控制沉淀反应条件以及NaCl、NH4HCO3、NaHCO3、NH4Cl等多种物质在不同温度下的溶解度差异等知识的前提下,才可将粗食盐的提纯和纯碱的制备有机结合起来,从而成功设计此综合实验。该实验综合性强,需要多知识点的融会贯通,可开拓学生视野,拓展学生思维,符合综合与设计实验的创新性要求。
1 实验目的
(1) 了解氨碱法和侯氏制碱法制备纯碱的反应原理和方法。
(2) 掌握无机物质提纯的方法和控制沉淀反应的条件。
(3) 巩固溶解、沉淀、减压过滤、灼烧固体样品、蒸发浓缩、结晶、烘干和滴定分析等基本操作。
(4) 掌握混合碱中双指示剂法测定碳酸钠含量的原理和方法。
2 实验原理
(1) 本实验为考察学生对于氯化钠提纯实验的理解与掌握,提供三组不同组分的粗盐:粗食盐a,混入难溶性的泥沙和可溶性的杂质;粗食盐b,混入不溶性的泥沙和少量可溶性的杂质;粗食盐c (盐湖组成),含有较高浓度的等离子。学生分成三组,根据粗食盐中杂质种类和含量的不同自主设计实验方案提纯氯化钠。以下以粗食盐a为例,说明了具体的操作原理与方法。
具体操作原理与方法:不溶性杂质可通过过滤除去,可溶性杂质应选用合适的试剂并控制条件,通过化学反应生成难溶性化合物沉淀或不影响提纯的化合物而除去。
在粗盐溶液中加入过量的BaCl2溶液,以除去。
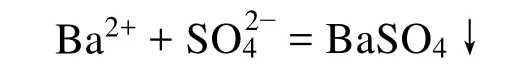
加入适量的Na2CO3和NaOH溶液,使溶液中的Mg2+、Fe2+、Ca2+及过量的Ba2+生成难溶性沉淀,再经过滤除去,同时过滤掉不溶性的泥沙。
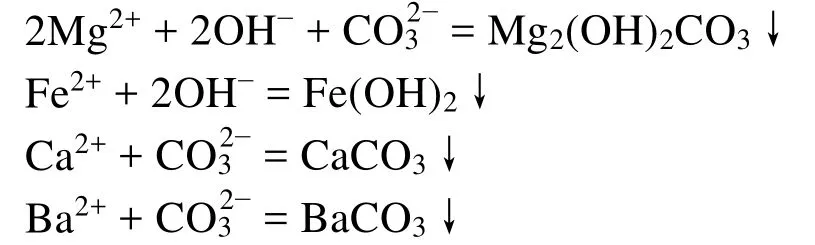
过量的NaOH和Na2CO3,可用纯盐酸中和并加热的方法除去。
粗盐中还含有少量的钾盐,它在滤液蒸发浓缩过程中仍留在母液中,而不至于和NaCl同时结晶出来。
自主设计提纯方案时须注意:在整个提纯过程中,以不引入新的杂质为前提,或者所引入的新杂质能在下一步操作中除去,如少量过量的盐酸,在干燥氯化钠时,以氯化氢气体形式逸出。
(2) 纯碱的制备。
侯氏制碱法是将CO2和NH3通入NaCl溶液中,生成NaHCO3,再在高温下灼烧转化为Na2CO3。本实验是利用NaCl与NH4HCO3反应制取NaHCO3,NaHCO3再加热煅烧制得纯碱产品,反应式如下:

反应后的体系中,NaCl、NH4HCO3、NaHCO3和NH4Cl同时存在于水溶液中,是一个复杂的四元交互体系。根据这四种盐溶解度与温度的关系,可得到分离NaHCO3的最佳条件。从表1可以看出,温度超过35 °C时,NH4HCO3将分解,而温度太低NH4HCO3较易析出,影响NaHCO3的生成。因此在30–35 °C温度区间,这四种可能的离子型产物中NaHCO3的溶解度最小,可优先结晶析出。因此将研细的固体NH4HCO3溶于浓NaCl溶液中,充分搅拌可析出NaHCO3晶体。300 °C条件下煅烧即可制得Na2CO3产品。

表1 NaCl、NaHCO3、NH4HCO3和NH4Cl在不同温度下的溶解度(g/100 g H2O)
(3) 碳酸钠含量的测定。
碳酸钠是弱酸强碱盐,用盐酸滴定碳酸钠时有两个计量点,反应式如下:
第一计量点:Na2CO3+ HCl = NaHCO3+ NaCl pH = 8.32
第二计量点:NaHCO3+ HCl = H2CO3+ NaCl pH = 3.89
第一计量点可用酚酞作指示剂,酚酞的变色范围为pH = 8–10。由于NaHCO3的缓冲作用,终点突跃不明显,因此常用参比溶液做对照,以提高分析的准确度。第二计量点可用甲基橙作指示剂,甲基橙的变色范围为pH = 3.1–4.4。由于在终点前,溶液中H2CO3和组成缓冲体系,终点也不容易掌握。因此,在用盐酸先滴定至刚好出现橙色时,将溶液加热煮沸,除去CO2,溶液变为黄色,再用极少量盐酸滴定至橙色,即为终点。
碳酸钠的百分含量计算公式如下:
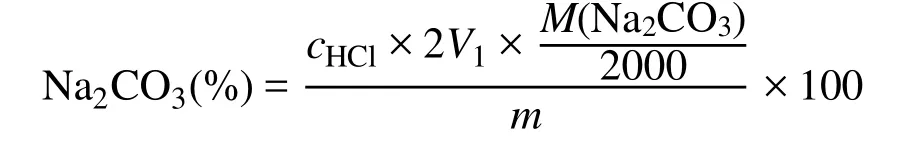
式中:M(Na2CO3)为Na2CO3的摩尔质量;V1为第一计量点所消耗的HCl的体积(mL);cHCl为HCl的物质的量(mol·L−1);m为滴定的Na2CO3固定样品的质量(g)。
提示:第一步滴定以酚酞为指示剂,其滴定终点反应为:
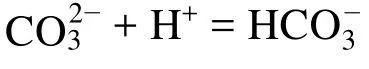
所以中和样品中全部Na2CO3所消耗的盐酸体积为V1的2倍(2V1)。而中和样品中NaHCO3所消耗的盐酸体积为V2−V1。V2为滴定终点时HCl所消耗的体积。
工业上常用总碱度表示Na2CO3的含量,其计算公式如下:

3 仪器和试剂
仪器:烧杯(50 mL,100 mL),研钵,玻璃棒,抽滤瓶,台秤,试剂瓶,锥形瓶(250 mL),滴定管,移液管(25 mL),容量瓶(100 mL),洗瓶,蒸发皿,布氏漏斗,漏斗架,量筒,滴管,滤纸,称量纸,石棉网,恒温水浴锅,酒精灯,水泵,电子天平,pH试纸。
试剂:粗食盐a,粗食盐b,粗食盐c,NH4HCO3固体,甲基橙指示剂,蒸馏水,HCl标准溶液(0.1000 mol·L−1),NaOH溶液(2.0 mol·L−1),HCl溶液(2.0 mol·L−1),BaCl2溶液(1.0 mol·L−1),Na2CO3溶液(2.0 mol·L−1),Na2SO4溶液(0.5 mol·L−1)。
4 实验步骤
4.1 NaCl的提纯
(1) 称量并溶解。
称取8.0 g粗食盐a置于100 mL烧杯中,加入40 mL蒸馏水并加热使其溶解。
加热至溶液近沸时,滴加2 mL左右1.0 mol·L−1BaCl2溶液,持续加热并不断搅拌使沉淀颗粒长大并沉淀。
停止加热,待沉淀稍沉降后,吸取上清液1–2 mL于离心管中离心分离,在离心澄清液中滴加BaCl2(1.0 mol·L−1)溶液2滴,观察是否出现浑浊,若出现浑浊,说明尚未除尽,将离心液倒回烧杯,继续滴加8–10滴BaCl2溶液,取样检验直至不出现浑浊,表示已沉淀完全。
(4) 除去Ca2+、Mg2+及过量的Ba2+。
将烧杯中的溶液继续加热至沸,不断搅拌下加入2 mL左右2.0 mol·L−1NaOH溶液和4 mL左右2.0 mol·L−1Na2CO3溶液,直至不产生沉淀,调节pH ≈ 11。检验Ca2+、Mg2+、Ba2+离子是否除尽的方法与检验的方法类似,离心澄清液中滴加Na2SO4(0.5 mol·L−1)溶液2滴,直至不出现浑浊,表明Ba2+已沉淀完全。
(5) 除去OH−和。
静置片刻,用倾析法在普通漏斗上过滤,保留滤液,弃去沉淀。在滤液中逐滴加入2.0 mol·L−1HCl溶液,直至溶液pH = 2–3。
(6) 浓缩、结晶、烘干。
将调好的滤液倒入蒸发皿中,加热蒸发浓缩结晶,不断搅拌直至成稀粥状为止,切不可将滤液蒸干。趁热用布氏漏斗进行过滤,并尽量将结晶抽干。将结晶取出放在蒸发皿中,再放在石棉网上用小火加热,轻轻搅拌干燥。
(7) 称重。
冷却称量,计算产率。
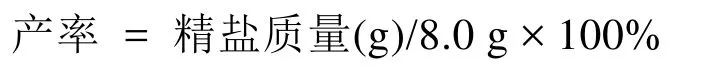
4.2 NaHCO3中间产物的制备
将4.1步骤中提纯的NaCl配制成25%的溶液,称取25 mL置于100 mL小烧杯中,放在水浴锅上加热,温度控制在30–35 °C之间。同时称取NH4HCO3固体(已研磨)细粉末10 g,在不断搅拌下分三次加入到上述溶液中。继续充分搅拌并保持在此温度下反应20 min左右。静置5 min后减压过滤,得到NaHCO3晶体。用少量水淋洗晶体以除去黏附的铵盐,再尽量抽干母液。将布氏漏斗中的NaHCO3晶体取出,在台秤上称其湿重并记录NaHCO3的质量m(NaHCO3)。
4.3 Na2CO3的制备
将上一步中制得的中间产物NaHCO3放在蒸发皿中,置于架有泥三角的石棉网上用酒精灯加热,同时必须用玻璃棒不停地翻搅,使固体均匀受热并防止结块,加热5 min后将石棉网取出继续加热30 min左右,即可制得干燥的白色细粉状Na2CO3产品。冷却到室温后(放置在铁圈上冷却,谨防实验台损坏!),在台秤上称量并记录最终产品Na2CO3的质量m(Na2CO3)。
4.4 Na2CO3含量的测定
用递减称量法准确称取1.5000–1.5500 g (准确至0.0001 g)自制的Na2CO3产品于100 mL烧杯中,加入适量水使其溶解,必要时可稍加热以促进溶解。冷却后,将溶液定量转入250 mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
准确移取25.00 mL上述溶液于250 mL锥形瓶中,加2滴酚酞指示剂,用0.1000 mol·L−1盐酸标准溶液滴定至溶液由红色到近无色,记下所用盐酸的体积V1,再加2滴甲基橙指示剂,这时溶液为黄色,继续用上述盐酸滴定,使溶液由黄色变至橙色,加热煮沸1–2 min,冷却后,溶液又为黄色,再用盐酸溶液滴定至橙色,半分钟不褪色为止。记下消耗的盐酸的总体积V2。平行滴定三次。以第一计量点所消耗的HCl的体积V1计算试样中碳酸钠的百分含量;以消耗HCl的总体积V2计算试样总碱度。
5 实验注意事项
(1) 粗盐加热溶解要充分。
(2) 蒸发结晶必须掌握合适的停止加热的时机:小火加热,保持溶液微微沸腾的状态下,溶液表面出现晶体薄层(晶膜)。
(3) 中间产物NaHCO3在蒸发皿中加热时必须用玻璃棒不停地翻搅,使固体均匀受热并防止结块。
(4) 样品灼烧后的蒸发皿放置在铁圈上冷却,防止烫坏实验台面。
(5) 在碳酸钠含量测定中,酚酞终点比较难观察,可采用相同浓度的NaHCO3溶液,加2滴酚酞指示剂作为参比溶液。
6 思考题
(2) 在本实验中,通过加入NaOH调节pH到11除去Mg2+的依据是什么,如何通过计算确定?
(3) 如果本实验总碱度过高或过低,原因各是什么?
(4) 本实验有哪些主要因素影响产品的产量?影响产品纯度的主要因素有哪些?
(5) 侯氏制碱法的化学方程式是什么?它的方法与索尔维制碱法比较,优点是什么?
(6) 简要说明碳酸钠含量测定原理。
7 结语
本实验将一个提纯实验(粗食盐的提纯)、一个制备实验(纯碱的制备)和一个组成分析实验(混合碱中碳酸钠含量的测定)综合到一起,开发了一个综合与设计实验项目。结合我国盐湖的组成特点,在粗食盐的提纯部分改进了粗食盐的组成且引入自主设计环节;在纯碱的制备部分,将侯氏制碱工艺流程设计改进引入大学实验课程内容中,体现了三全教育。本实验综合了多种基础化学实验操作,同时与工业生产实践相结合,不仅能够锻炼学生的实验操作技能,而且培养学生以解决实际问题为出发点,从模仿到创新的思维方式,以及可持续发展理念和环保意识。拓展了本科化学教学实验开设内容的范围,对于学生综合运用知识的能力和创新能力的培养以及设计思维的提升具有积极的意义。

