老反应、新认识:不容小觑的乙硼烷与氨的反应
李慧珍,李运辉,庄惠芬,陈丽婷,梁瑛敏,易思远
广州大学化学化工学院,广州 510006
硼氮氢化合物是由硼、氮、氢三种元素组成的化合物的简称,分子中含有N―H键、B―H键和N→B配位键。近年来,硼氮氢化合物的合成、结构、性质及应用一直是研究热点,尤其作为储氢材料备受关注[1–5]。此外,硼氮氢化合物在有机合成、功能材料、纳米材料等领域也被广泛研究,例如:a) 用作还原剂,还原二氧化碳[6]、石墨烯[7]、醛/酮[8]、烯烃氢化等[9];b) 用于燃料电池[10]及合成硼氮管[11]、硼氮球[12]、白石墨烯[13]、金属纳米颗粒[14,15]、硼氮高分子[16]、潜在的气相沉积前驱体等[17]。B2H6与NH3的反应最早用于合成硼氮氢化合物,该反应乍一看是一个简单的无机物反应,实际却很复杂。在不同的实验条件下,B2H6与NH3反应可生成DADB、AB、ADB等其中一种或混合产物。从1923年硼化学先驱者Stock研究乙硼烷与NH3的反应开始,至今已将近一个世纪,化学家们才逐步对该反应有了明确的认识。本文基于对DADB、AB、ADB三种小分子硼氮氢化合物的结构、合成及生成机理的总结,对B2H6与NH3这一个“老反应”的“新认识”做系统梳理,以期为无机和有机反应研究、无机化学中与硼元素相关的课程内容的更新及化学专业学生的深度学习提供参考。
1 结构
硼原子有4个价层电子轨道,但只有3个价电子,是缺电子原子,因此硼原子易接受电子,表现出较强的路易斯酸性。另一方面,由于硼(2.04,Pauling电负性)的电负性小于氢(2.20),氮的电负性(3.04)大于氢,使得与氮相连的氢带部分正电荷Hδ+,与硼相连的氢带部分负电荷Hδ−,B―Hδ−可表现出路易斯碱性。作为B2H6与NH3反应的产物,DADB、AB、ADB等小分子硼氮氢化合物结构的研究备受关注。
1.1 DADB的结构
1923年,DADB被Stock意外发现,是最早被发现的硼氮氢化合物。随后确定其组成的经验式为B2H6·2NH3,名称diammoniate of diborane也由此而来,一直沿用至今。早期研究(1939–1948)一直把DADB认作AB,即单体共价型结构NH3·BH3。随后化学家们相继提出了4种不同的离子型结构,最终研究确定了DADB的离子型结构[NH3BH2NH3][BH4]。1964年Shore报道了DADB的X射线衍射数据[18]。直到2010年,Autrey通过中子衍射测定了DADB的晶体结构,如图1所示,分子中存在较强的分子内B―Hδ−···δ+H―N双氢键[19]。
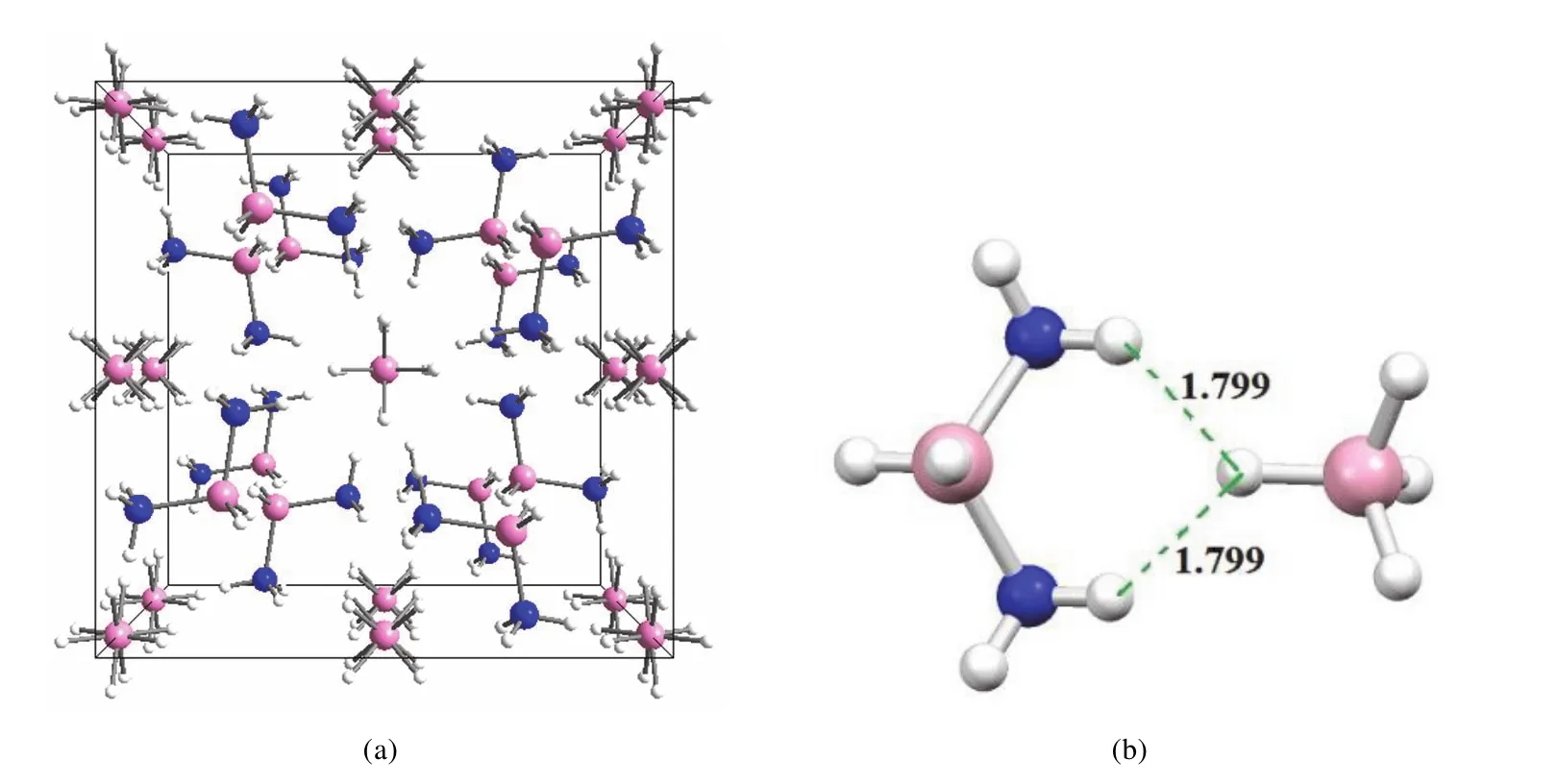
图1 DADB的晶体结构(a)和分子内双氢键(b)
1.2 AB的结构
在标准状况下,AB是一个白色固体(熔点377.15 K,密度:0.780 g·cm−3),易溶于水、液氨和四氢呋喃。AB在1955年首次被Shore制备得到。但由于测试方法的局限,前期(1955–1991)利用X射线衍射研究得到的AB的固体结构信息中B和N的位置是错误的,直到1999年Crabtree等利用中子衍射实验才准确测定了AB的结构,如图2(a)所示。AB分子间的双氢键B―Hδ−···δ+H―N也因此被发现,由图2(b)可以看出,一个AB分子与相邻的8个AB分子之间可形成12个双氢键,其中B―Hδ−···δ+H部分是弯曲的,而N―Hδ+···δ−H近乎直线[20]。AB分子间双氢键的发现合理解释了为什么AB固体的熔点(熔点377 K)远高于其等电子体CH3CH3气体(熔点90 K)。也正是基于AB及其金属衍生物中特有的双氢键,掀起了这类化合物作为储氢材料的研究热潮。

图2 AB的中子衍射结构(a)和分子间双氢键(b)
1.3 ADB的结构
ADB与B2H6的结构相似,可看作是用NH2取代B2H6中的一个桥氢得到。ADB早在1938年就被I. Schlesinger发现并制备出来,但除了有文献报道ADB的电子及谱学结构外,ADB的相关研究一直未有进展。直到2010年Shore等发现了一种简易新方法能大量制备ADB后[21],才有机会对ADB的晶体结构进行表征。ADB在室温条件下呈液态,将18-冠-6加入到ADB的溶液中,利用18-冠-6中的氧原子与ADB中与氮相连的H之间形成氢键作用,可得到2ADB·18-crown-6加和物的单晶(图3)。2015年我们通过低温X射线衍射技术,即将少量ADB的THF溶液封存到毛细管中再缓慢冷却结晶,得到了ADB·THF加和物的单晶[2]。如图4所示,每个THF分子通过其氧原子的两对孤对电子分别与两个ADB分子中的N―H的H形成两个氢键,通过氢键把ADB与THF链接成了一个Zigzag链状结构。这也解释了为什么不能将溶剂THF从溶液中与ADB分离,即ADB与THF以1 : 1 (ADB·THF)摩尔比存在。迄今为止,自由的ADB分子还未被分离出来并进行表征,这类似于硼烷BH3不能单独存在,必须以二聚体或加合物如THF·BH3形式才能稳定存在。

图3 2ADB·18-crown-6的晶体结构
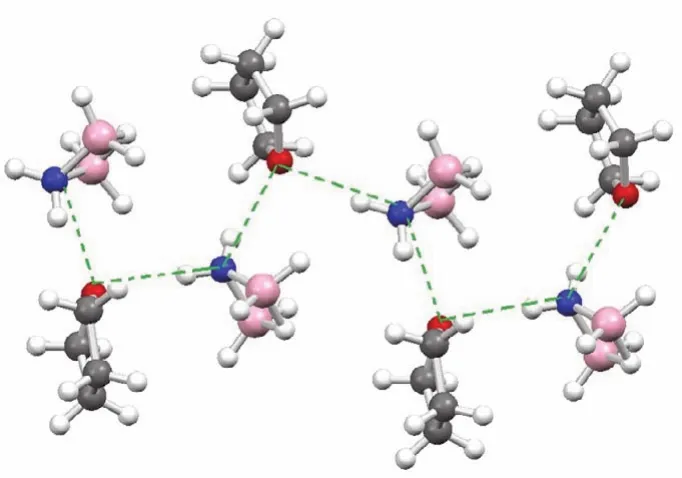
图4 NH2B2H5·THF的晶体结构
2 基于B2H6与NH3反应的DADB、AB和ADB合成
小分子硼氮氢化合物作为潜在的储氢材料,合成方法研究较多。本文只讨论其中基于B2H6与NH3反应的DADB、AB、ADB的合成。
2.1 DADB、AB的合成
由于实验条件的限制,比较复杂的B2H6与NH3反应让硼化学家们困惑了很长时间。为了避免剧烈反应,早期研究B2H6与NH3的反应均是在低温条件下进行的。1923年,硼氢化学的先驱者Stock设计通过B2H6与NH3的简单反应制备AB,但意外却得到了DADB[22]。Wiberg也偶然发现了DADB[23]。1937年,Schlesinger尝试把乙硼烷冷却到固态NH3之上以降低反应速度来制备AB[24],但没有证据显示有AB生成。直到1964年,Shore等进一步扩大了B2H6与NH3的反应,发现得到了DADB与AB的混合物。在195 K,把乙硼烷通入THF,可生成THF·BH3,再向THF·BH3中加入液氨,可得到大量AB。当把液氨蒸馏至THF·BH3溶液中,却得到了摩尔比近乎1 : 1的DADB与AB的混合物[18]。Mayer提出因为THF中O原子的配位能力较强,B2H6在THF或甲醚中是以L·BH3(L = THF,Me2O)加合物形式存在,AB很可能是通过L (路易斯碱)的置换反应得到的[25]。另一方面,当较稀的乙硼烷气流(N2稀释)通过液氨时,在195 K的反应条件下得到DADB,只含有大约5%的AB[25]。
1971年,Mayer发现B2H6与CO、PH3反应时,在有醚存在条件下反应被加速,反应的速率随着醚碱性的不同而有如下顺序:甲醚(dimethyl ether)>乙二醇二甲醚(monoglyme)>二乙二醇二甲醚(diglyme)>乙醚(diethyl ether)[26]。依据上述结果,Mayer详细研究了溶剂、温度、反应物浓度对B2H6与NH3反应的影响。发现在溶液中反应可生成DADB与AB的混合物。如果把NH3气体快速通入0.05 mol·L−1乙硼烷的乙醚溶液中,AB的产率在15%–76%。产率与溶剂密切相关,随着以下顺序降低:乙二醇二甲醚(monoglyme)>乙醚(diethyl ether)>二异丙醚(diisopropyl ether)>正己烷(n-hexane)。当把B2H6气体通入NH3的醚溶液中,AB的产率明显降低。此时很难解释为什么反应物的加入顺序不同会影响产率,但也说明除了溶剂还有其他因素影响该反应[25]。此外,B2H6与NH3在正己烷中反应时,产物DADB与AB的比例和反应速度也受温度的影响。高温有利于AB生成。而在乙醚(diethyl ether)中,AB的产率不受温度影响。改变NH3的浓度也不影响产物DADB与AB的比例。上述实验结果证明在溶液中B2H6与NH3反应生成DADB和AB是互相竞争的。
2015年,Kim课题组优化了低温条件下B2H6与NH3反应并应用于商业化生产。在195 K,两个高压反应容器1和2内分别装有乙硼烷的THF溶液与液氨,待容器1中的B2H6转化成THF·BH3后,把它导入容器2中并在不同温度或压力条件下剧烈搅拌,然后将反应混合液升温到室温,即可得到AB,产率52%–92%。结果表明,THF·BH3的浓度和升温区间影响AB的产率,压力对反应影响不显著[27]。
最近,Guo等利用B2H6与NH3气流,研究了室温条件下B2H6与NH3在气相中的反应。结果表明,如果不控制反应物B2H6与NH3的比例,得到DADB与AB的混合产物,与乙硼烷气体与液氨及溶液中B2H6与NH3的反应的结果类似。当乙硼烷过量,反应物摩尔比B2H6/NH3= 17 : 1时,反应生成AB的纳米颗粒,NH3在NH3-N2混合气中的浓度影响产物AB和DADB比例,这不同于以前报道的NH3的浓度不影响产物比例。当NH3过量,反应物摩尔比B2H6/NH3= 1 : 40时,反应生成纯的DADB,如果增加B2H6的浓度,则会导致AB生成[28]。
2.2 ADB的合成
1938年,Schlesinger在利用B2H6与NH3混合物热分解方法制备硼吖嗪(B3N3H6)时发现有少量ADB生成[29]。随后,Schlesinger用过量B2H6与NH3反应制备得到了ADB (式1),但过程比较复杂。所用的仪器装置如图5所示,包括以下实验步骤:1) 在U4A冷阱中,NH3被冷却下来与过量乙硼烷反应,从143 K升至室温,推测生成了DADB。反应过程用汞压计控制合适的温度和反应速率。2) 大量的乙硼烷被冷凝到M管中,然后在193 K蒸发,乙硼烷气体以一定的速率通过含有少量NH3的U管。3) 所有气体和蒸汽在78 K被冷凝到U4管中,通入H2测定反应的压力。4) 等最后的乙硼烷通过直至无H2生成后,大部分产物留在U4管中。5) 产物通过分级蒸馏进行纯化,在193 K得到产物[30]。该制备方法不仅过程繁杂,而且产率只有19%–33%,导致后续70多年对ADB的研究迟滞不前。

图5 制备ADB的装置示意图
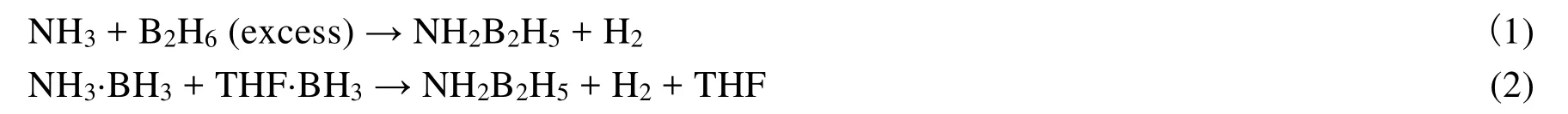
直到2010年,Shore等报道了一个利用商业化产品AB与四氢呋喃硼烷(THF·BH3)按剂量比在室温条件下混合反应制备ADB的方法(式2)。该反应不需要催化剂,只需要以下两步,产率高达70%:1) 固体AB溶于THF·BH3溶液中,搅拌,用11B-NMR监控反应;2) 当11B-NMR信息显示反应物的转化率达90%时,停止搅拌,过滤掉少量白色沉淀,低温分级蒸馏纯化即得产物ADB[21]。这个方法具有普适性,也可用于制备N-取代的ADB,如sBu2ADB,MeADB,Me2ADB,PhADB等[31–33]。
3 基于B2H6与NH3反应的DADB、AB、ADB生成机理
3.1 DADB和AB的生成机理
由于B2H6与NH3反应较复杂,在不同条件下反应可生成AB (式3)、DADB (式4)、ADB (式1)等化合物,对生成机理的探讨也经历了一个曲折的过程。从2.1部分总结的基于B2H6与NH3反应的DADB和AB的合成可以看出,当B2H6与NH3在固体或液氨条件下反应时,生成DADB,而在溶液中反应时,生成DADB和AB的混合物,而气相反应与在溶液中的反应类似。

生成离子型和共价型混合物产物的现象也发生在过量CH3NH2/(CH3)2NH分别在193/183 K与B2H6的反应中(式5–6;7–8)),相对产率[BH2(NH2CH3)2][BH4]>> (CH3)NH2·BH3,(CH3)2NH·BH3>[BH2(NH(CH3)2)2][BH4],而(CH3)3N与乙硼烷反应只发生对称解离生成(CH3)3N·BH3(方程式9)[34].
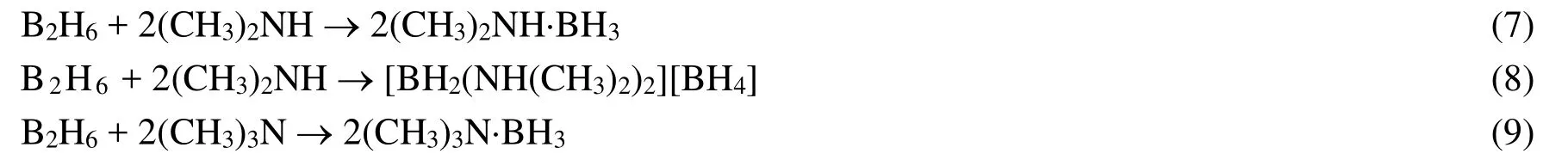
1966年,Shore等根据NH3、CH3NH2、(CH3)2NH、(CH3)3N等路易斯碱与乙硼烷反应的结果,提出了乙硼烷的在反应中的不同解离方式[35]。如图6所示,当乙硼烷与路易斯碱L反应时,一个桥氢会断裂,形成一个中间体A (L–BaH2(μ–H)BbH3),使得原本等价的两个硼原子变得不再等价,当第二分子L进攻Ba时,乙硼烷发生不对称解离,生成离子化合物DADB,当第二分子L进攻Bb时,乙硼烷发生对称解离,生成共价化合物AB。此时中间体A的提出由于没有被证实,也被争论了很多年[35–38]。1967年,Eastham提出乙硼烷与L的反应可能通过胺上的孤对电子与乙硼烷的一个非键合轨道之间的π键键合的中间体[38],但这个结构很快被Shore否定[37]。
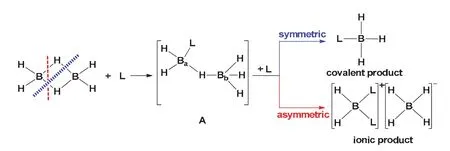
图6 乙硼烷的对称裂解和不对称理解
是什么原因导致了乙硼烷在不同实验条件下的不同解离方式?研究者们提出了很多影响因素来解释这种选择性,总结起来有以下几点:1) 立体效应[39,40];2) 诱导效应[41];3) 物质本性[42];4) 溶剂效应[39];5) L的介电常数[34,41–43];6) 共价型和离子型产物的相对稳定性[44]。在上述影响因素的研究中,立体效应、溶剂效应,L和产物的特性被关注较多。
例如,对于胺来说,随着甲基取代数的增多,空间位阻增大,导致生成乙硼烷对称解离的产物[34]。在中间体A中,因为L取代了一个与B相连的H,导致Ba与Bb的空间环境是不同的,空间位阻较大的N(CH3)3较易进攻位阻较小的Bb而生成共价产物AB,而空间位阻较小的NH3更易进攻Ba生成离子型产物DADB[34]。介电常数或溶剂效应在一定程度上也可以解释NH3、(CH3)NH2、(CH3)2NH、(CH3)3N等与乙硼烷的反应。在这四种胺中,液氨的介电常数最大,导致生成DADB,而(CH3)3N极性最小,生成共价产物AB。乙硼烷与(CH3)NH2/(CH3)2NH则生成离子型共价型混合产物[34,41,43]。
对于中间体A来说,Ba与Bb的化学环境也是不同的。当L是胺时,因为N的电负性较大,与N相连的Ba应比Bb带有更多的正电荷,理应更容易受到亲核试剂的进攻。因此,在不考虑其他因素的情况下,诱导效应能解释为什么乙硼烷与胺反应生成了不对称解离产物[41]。但是,当乙硼烷与含有氧的路易斯碱如THF,Me2O等反应时,却生成了对称解离的产物L·BH3,这可能是由于含氧路易斯碱较弱的碱性[41]。在特定温度,不对称解离产物是否容易重排生成对称解离产物则取决于产物固有的热力学稳定性[42]。
Mayer认为溶剂的碱性影响乙硼烷解离。他发现碱性醚类溶剂,如THF和甲醚,能够促进乙硼烷对称解离,L·BH3(L = THF,Me2O)可能是乙硼烷与NH3反应的中间体[25]。这就解释了为什么在醚类溶剂中容易生成AB。如图7所示,在机理a中,NH3会优先进攻R2O·BH3中间体中不与R2O配位的B;而机理b则表明在R2O·B2H6与R2O·BH3有一个平衡。在没有中间体R2O·BH3实验证据时,很难判断哪个机理优先。总之,有很多关于乙硼烷与路易斯碱反应影响因素的研究结果,但都不具有普适性,并不能合理解释与乙硼烷相关的很多反应,也一直没有可能准确预测产物是什么,肯定还有其他一些微妙的影响因素需要考虑[25]。
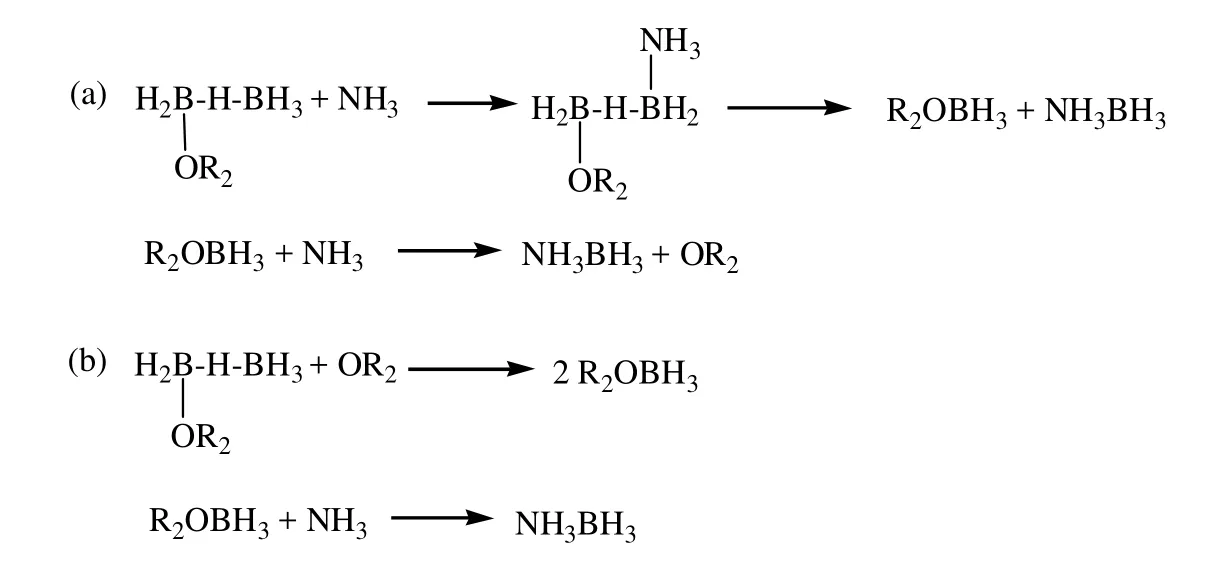
图7 B2H6与NH3在醚溶液中反应的机理
早期研究B2H6与NH3等路易斯碱的反应是在比较苛刻的实验条件下进行的。因为乙硼烷是对空气敏感的可燃性气体,很多碱也都是腐蚀性气体,因此反应在低温和高真空条件下进行。这种苛刻条件使得研究该类反应及其机理变得很困难。从结构角度看,如图8所示,在乙硼烷分子中,BH3既因为B的缺电子性表现为路易斯酸,可接受电子;又因为与B相连的H带部分负电荷可作为电子供体,表现路易斯碱性,所以乙硼烷可看作是两个BH3的路易斯酸碱加合物。研究发现,乙硼烷在配位能力较强的溶剂L (路易斯碱)中,一般以L·BH3加合物形式存在,BH3是路易斯酸。系列实验也发现当路易斯碱的碱性强于THF时,它们与B2H6/THF·BH3反应的产物相同(表1)[45]。

图8 B2H6与L·BH3的成键分析

表1 路易斯碱与B2H6/THF·BH3反应的产物对比
2010年,Shore等用THF·BH3来代替反应活性较高乙硼烷并结合实验和理论计算结果,研究并提出了基于THF·BH3与NH3反应生成AB,DADB的三步骤机理(图9)。如图9所示,第一步,NH3取代L·BH3的THF生成AB,L―B键的断裂与N―B生成同时发生,是一个SN2亲核取代反应;第二步,AB继续与L·BH3反应生成中间体ammonia diborane (NH3BH2(μ-H)BH3,AaDB),该中间体在1964年被Shore提出来(图6中的A),直至2010年才用11B-NMR检测到(图10)。B2H6和THF·BH3两者与AB反应的中间产物均是AaDB。第三步,NH3进攻AaDB有两种路径。路易斯碱如果进攻AaDB中的Ba,则发生加成反应生成离子型产物DADB (path I);若进攻Bb则生成两分子共价型化合物AB (path II)。NH3与THF·BH3的反应可在温和条件下进行,可以用硼谱来监测反应。如图10所示,随着反应的进行,反应物L·BH3(L = THF)的峰强度(δ, −0.9)逐渐降低,产物AB (δ,−22.4)峰强逐渐增加,反应3分钟后分别出现在δ,−13.8 (δ,triplet) 和−25.5 (δ,quartet)处的两个小峰即为中间体AaDB,大约7分钟后,产物DADB的峰出现在δ−38.0,并逐渐增强,直至变成的特征峰。反应最后,在11B-NMR只看到产物AB和DADB的特征峰[46]。
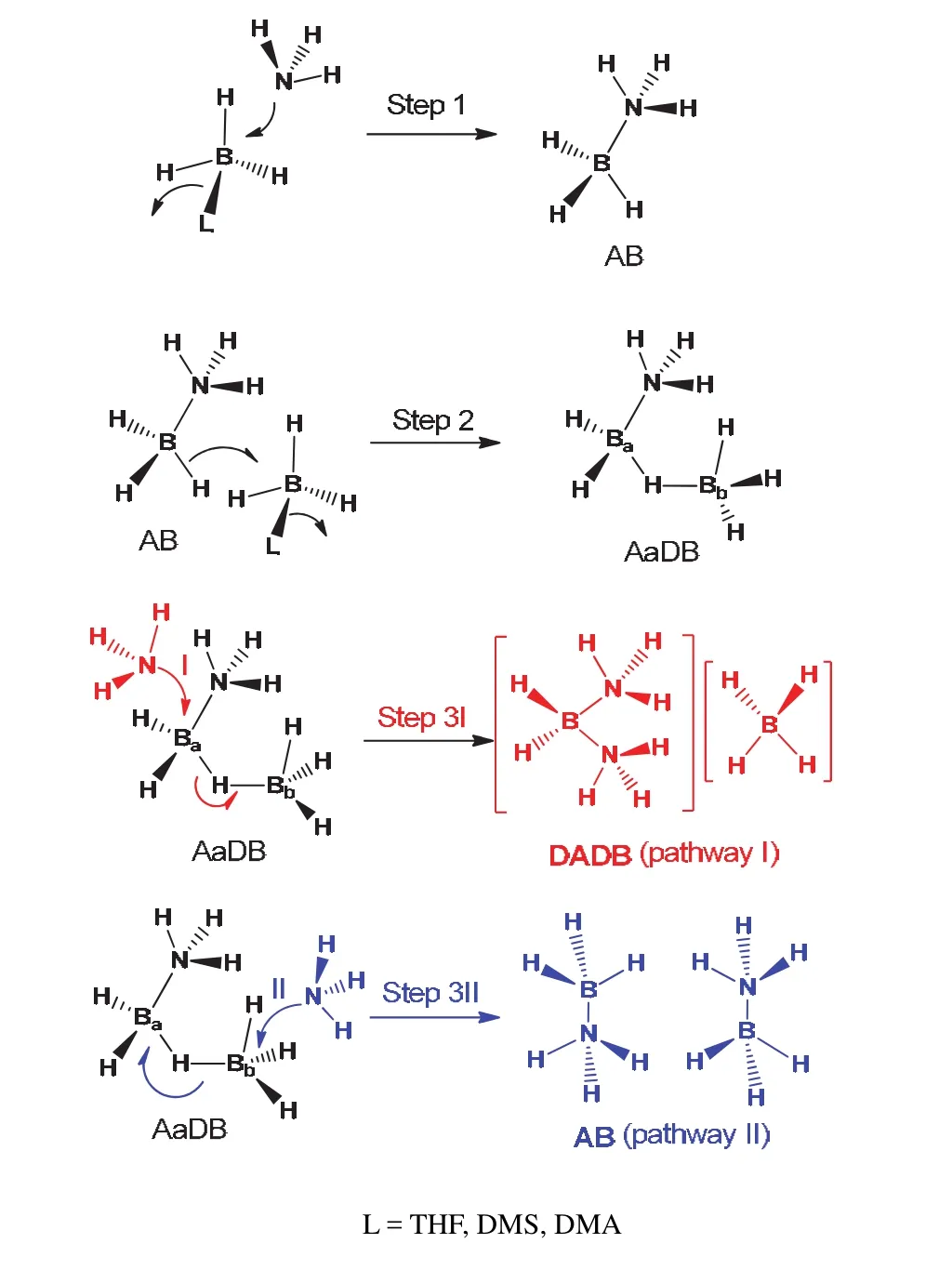
图9 AB和DADB形成机理

图10 AB,DADB和AaDB的硼谱(195 K)
实验和理论计算证明,中间体AaDB和双氢键在反应中起了重要作用[45–47]。首先,在195 K,当THF·BH3反应与过量的液氨反应时,在溶液或固态产物中只观察到AB生成,因为在第一步中没有剩余的THF·BH3进一步与AB反应生成中间体AaDB,没有该中间体则第二步反应就不可能发生,也就没有第三步生成DADB的反应。其次,当过量的THF·BH3与氨气在THF中反应时,三步可以同时发生,就可得到AB和DADB混合物。当等量的THF·BH3与NH3在195 K反应时,DADB/AB的摩尔比增大。然而,当气体NH3在195 K与THF·BH3和Me3N·BH3的混合液反应时,DADB/AB的摩尔比却减小。实验结果表明,当AB浓度较高,AB与AaDB之间的双氢键增多时,会导致生成DADB。理论计算证实了这一实验结果。在AaDB中与N相连的Hδ+与中的B―Hδ−形成的双氢键B―Hδ−···δ+H―N削弱了NH2BH2与之间的作用。换句话说,AB可看做是生成DADB的催化剂。如果中间体AaDB不能产生,就不会生成DADB。据此,以下两种策略已成功用于大量制备AB:1) 用较强的路易斯碱代替THF·BH3反中的THF,抑制AaDB生成;2) 利用非极性溶剂,使得生成的AB尽快从反应体系中脱除。利用以上策略,将NH3气体通入C6H5Me2N·BH3,DMA·BH3的甲苯溶液中成功制备了较大产量的AB,大幅度降低了AB的制备成本[47]。
如图11(a)所示,生成共价型产物AB的活化能(60.1 kJ·mol−1,pathway II)明显低于生成离子型产物DADB的活化能(128.5 kJ·mol−1,pathway I)。在这个系统引入双氢键之后,AB与过渡态TS1、TS2之间的相互作用,使得路径I的活化能大幅度降低,而路径II的活化能降低较少。当考虑双氢键与4个AB分子相互作用时,如图11(b)所示,两个路径的活化能分别降低至66.8 kJ·mol−1(pathway I)和49.6 kJ·mol−1(pathway II),活化能差别仅有17.2 kJ·mol−1,这与实验结果一致。双氢键的存在促使DADB生成,致使反应生成AB与DADB的混合物。理论计算仅仅模拟了过渡态与AB之间的相互作用形成双氢键,然而,双氢键可以在过渡态与反应体系中的其他任何物质之间形成,例如NH3或已生成的DADB。所有双氢键相互作用都可以显著地降低反应的活化能,得到DADB与AB的混合产物。但pathway I的活化能依然高于pathway II,使得AB是主产物,而DADB的产率较小。由此也可以推断,之前长期讨论的空间因素、介电常数等影响因素在这个反应体系中很重要但不是决定因素,真正在AB与DADB竞争反应中发挥关键作用的是双氢键[45]。

图11 NH3进攻中间体AaDB两种反应路径的反应复合物(RC),过渡态(TS)和产物的能量图
3.2 ADB的生成机理
ADB最早是用过量B2H6与NH3在−130 °C通过一个较冗长复杂的反应制备得到,产率较低。作者认为反应第一步先生成DADB,B2H6再与生成的DADB反应生成ADB,但没有证据支持这一假设。2010年,Shore报道的THF·BH3与AB反应制备ADB方法既简单又产率较高[21],且很快被应用于制备ADB的其他衍生物,即ADB分子中氮原子上的氢被Me、Ph、Me2S等取代的化合物。基于该方法的普适性,我们利用实验和理论计算研究了基于THF·BH3与AB反应生成ADB的机理,进一步证实了双氢键在反应过程中发挥的重要作用,也发现从中间体到产物基于双氢键的释氢过程并不是一步释氢那么简单。通过理论计算,我们提出了三个可能的反应路径,如图12所示,pathway 1被认为是最优路径。Pathway 3中过渡态TS2-3和Pathway 2中过渡态TS3-2活化能均较高而被排除在外。Pathway 1经过以下步骤:1) 作为路易斯碱,AB与THF·BH3反应,AB的B―H键成键电子对进攻THF·BH3的B原子,并取代THF,生成反应过程中极为重要的中间体AaDB。2) 中间体TS2-1形成,是由一个被N―H···H―Bb双氢键稳定的能量最低六元环结构。尽管双氢键N―H···H―Bb中H···H距离有14.4 nm,但此时并无氢气生成,而是进一步生成了中间体[H2B(NH3)(THF)]+[BH4]−。3) TS3-1形成后,双氢键N―H···H―Bb中H···H距离有8.9 nm,导致生成了另一个中间体[(THF)BH2NH2](η2–H2)BH3(图13)。伸长的B···H (14.1, 14.4 nm)和N···H (23.2 nm)以及较短的H···H 距离(8.0 nm)表明该中间体是一个分子氢的配合物,氢交换实验证明了这一点。当用ND3·BH3与THF·BD3反应制备ADB时,质谱检测证明得到了H2、HD和D2,它们是通过同位素交换生成。4) TS3-1中H···H距离只有7.4 nm,两个B···H(27.8, 27.1 nm)进一步拉长。这与该过渡态失去分子氢,生成NH2BH2和BH3一致,中间体NH2BH2可由AB与THF·BH3反应过程中产生的少量白色沉淀经表征为低聚物(NH2BH2)n证实。5) 尽管NH2BH2易聚合生成低聚物(NH2BH2)n,但大部分NH2BH2还是被BH3捕获,生成四元环状Ba―N―Bb―H化合物ADB[2]。
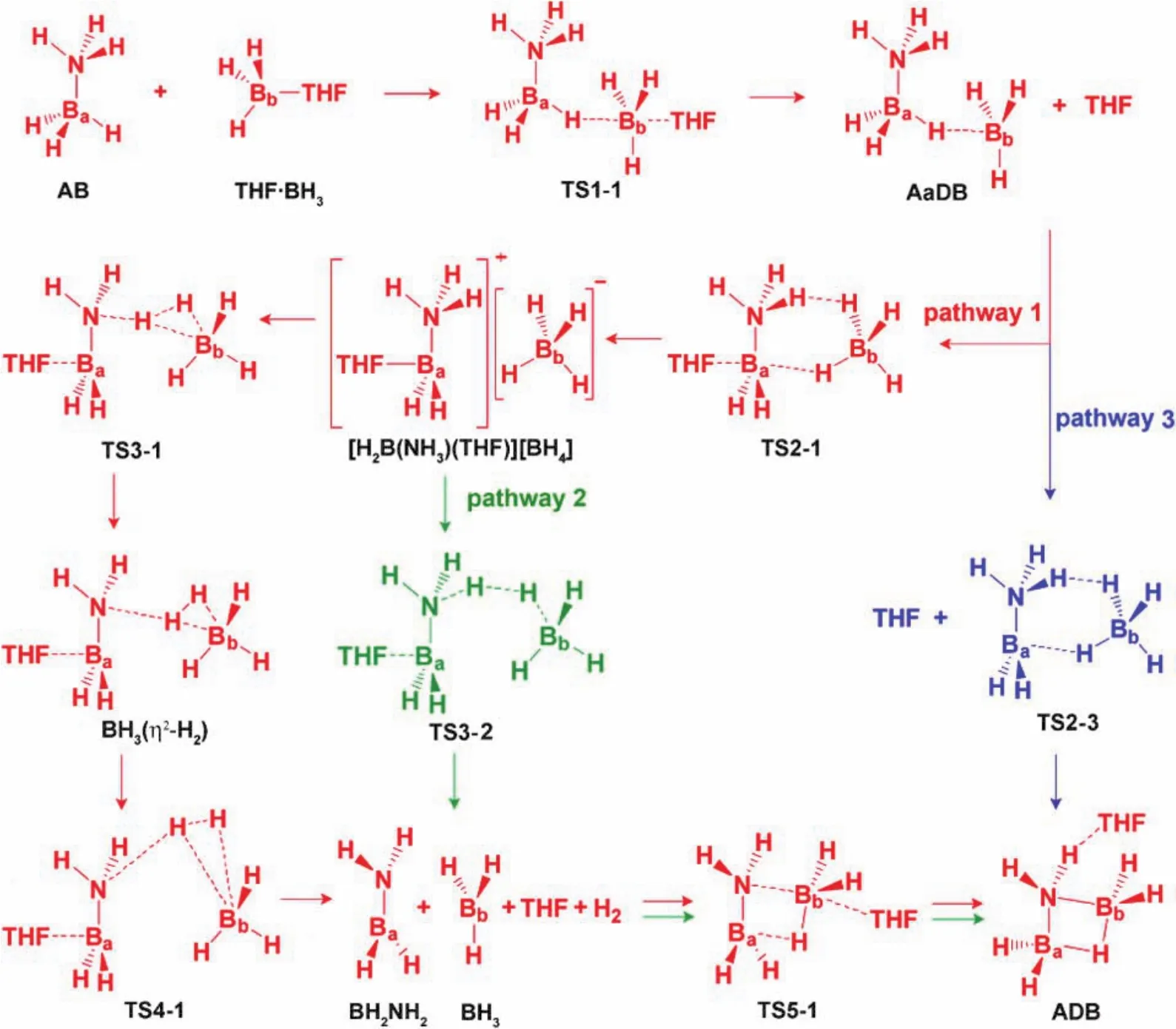
图12 ADB生成的不同反应机理
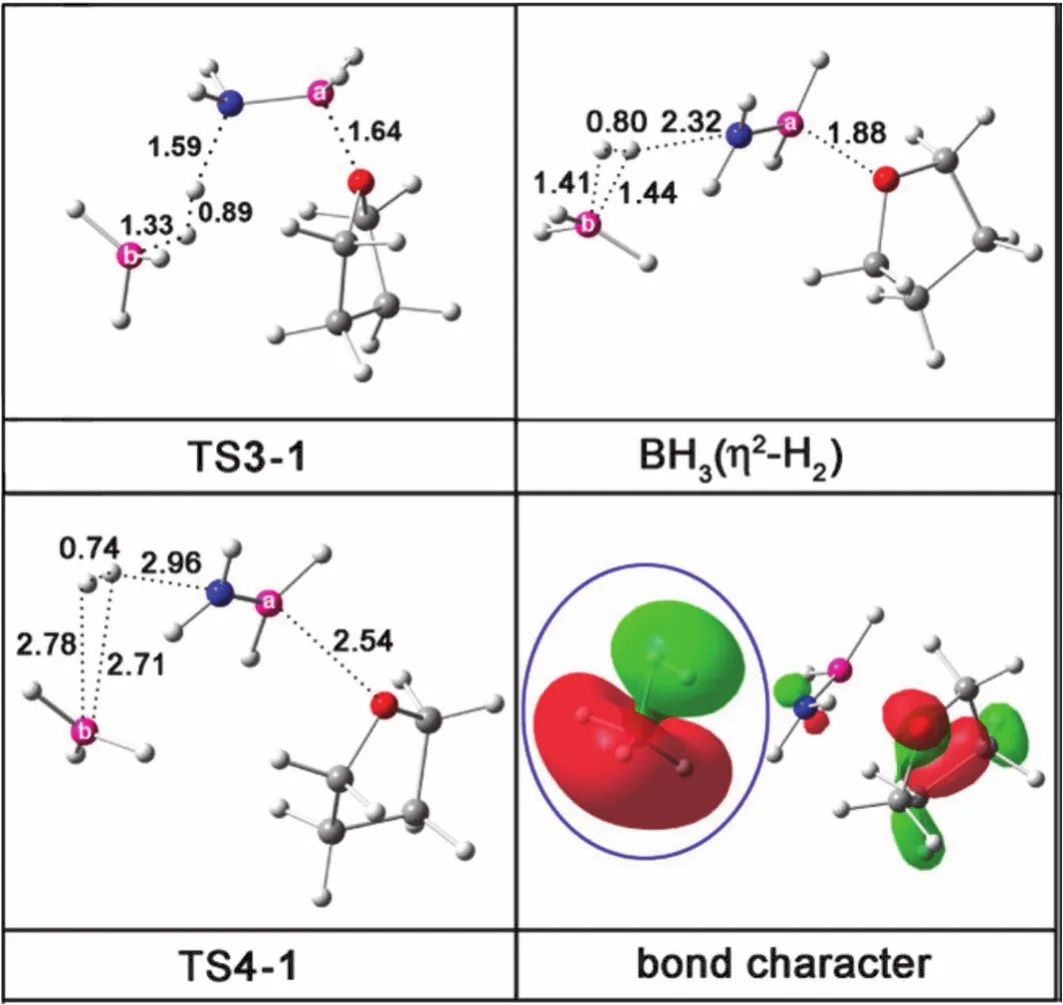
图13 中间体BH3(η2-H2), TS3-1和TS4-1的结构以及路径1中η2-H2成键特征
4 结语
B2H6与NH3的反应是一个看似简单实际却很复杂的反应,可以在不同实验条件下生成DADB、AB或ADB等其中一种或混合产物。从1923年开始至今,化学家们相继对立体效应、诱导效应、溶剂效应、介电常数等实验因素进行研究,发现上述影响因素不具有普适性,并不能合理解释与乙硼烷相关的所有反应,也一直没有可能根据上述影响因素准确预测产物。利用乙硼烷在THF中以THF·BH3存在且路易斯碱与B2H6/THF·BH3反应产物相同的实验事实,化学家们得以在温和的条件下研究DADB、AB、ADB的生成机理,最终发现是双氢键在反应过程中起着重要作用。总之,本文系统梳理和总结的对B2H6与NH3这一“老反应”的“新认识”深刻阐释了“结构决定性质”这一化学大概念,对该反应的认识发展过程及研究方法的巧妙设计对无机和有机反应研究均具有借鉴意义,也可为大学无机化学中与硼元素相关的课程内容的更新及化学专业学生的深度学习提供参考。

