烟草NtMHX1和NtMHX2基因的克隆及不同金属离子胁迫下的表达模式分析
张吉顺,张孝廉,杨慧,贾蒙骜,张婕,赵德刚
1 贵州大学生命科学学院/农业生物工程研究院,贵州省农业生物工程重点实验室,山地植物资源保护与种质创新省部共建教育部重点实验室,贵阳 550025;
2 贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵阳 550081;
3 贵州省农业科学院农业部DUS中心贵阳分中心,贵阳 550006
镁是植物生长发育所必需的金属元素,参与植物体的多个生理代谢过程。烟草(Nicotiana tabacum)是以收获叶片为主的经济作物,镁元素不仅影响烤烟的农艺性状,还与烤烟品质有着密切的关系[1]。烤烟在缺镁和高镁条件下,叶片叶绿素含量均会显著降低[2]。很多研究都证明了,施镁可以有效地提升烟叶的产质量并较好地协调烟叶中的化学成分,提升烟叶吸食品质[1,3-5]。
植物中镁的吸收、运输和分配受到不同基因家族的调控,目前已发现有4个家族蛋白参与了镁离子的运输[6-9],包括:CroA亚家族的部分成员、SV(slow-vacuolar)通道蛋白、环核苷酸相联的离子通道AtCNGC10、MHX蛋白。其中MHX蛋白属于CaCA(Ca2+/Cation Antiporter)亚家族,对植物镁离子平衡具有重要作用。拟南芥AtMHX主要负责质子和Mg2+、Zn2+和Cd2+的交换[10-11],AtMHX蛋白将金属离子扣留在液泡中,并将液泡中的质子释放到细胞质中。在橡胶树中也发现MHX具有交换质子和Mg2+、Zn2+、Cd2+离子的功能[12-13]。
Gaash等[14]对拟南芥(Arabidopsis thaliana)、马 铃 薯(Solanum tuberosum)、番 茄(Solanum lycopersicum)、葡萄(Vitis vinifera)、大豆(Glycine max)、 水 稻(Oryza sativa)、 小 麦(Triticum aestivum)、玉米(Zea mays)和小立碗藓(Physcomitrella patens)等植物中MHX蛋白进行进化和结构模型分析,发现MHX蛋白是植物所特有,且大部分植物都只有一个MHX同源基因。目前,烟草中MHX蛋白的序列信息和功能尚不明确,本文对栽培烟草中的MHX基因进行克隆,对其编码蛋白进行了生物信息学分析,并检测了不同金属离子处理下该基因的表达模式变化,为MHX基因在烟草中的作用及分子机制研究提供了参考。
1 材料与方法
1.1 材料
试验所用材料为栽培烟草(Nicotiana tabacum L.)K326。采用漂浮育苗法育苗,温室培养至5~6片真叶时将幼苗移栽至含有基质的花盆中培养,分别取幼苗期的根、茎、叶和开花期花,液氮迅速冷冻,于-80℃保存备用。将5~6片真叶期的烟苗移栽至1/4浓度的Hogland营养液中培养14 d,每7 d更换一次新的营养液,分别在1/4浓度的Hogland营养液中添加100 mmol/L的NaCl、100 mmol/L的KCl、100 mmol/L的CaCl2、50 mmol/L的ZnSO4,50 mmol/L的MnCl2,50 mmol/L的MgSO4、50 mmol/L的CuSO4和50 μmol/L的CdCl2进行不同金属离子的胁迫处理,并于添加金属离子的0 d、1 d、2 d、4 d和6 d取烟草叶片,以不额外添加金属离子的1/4浓度的Hogland营养液中培养的烟苗做为平行对照,同步取样,液氮速冻后置于-80℃冰箱保存备用,每个处理设置3次重复。
1.2 NtMHX基因的克隆及测序
以拟南芥MHX基因全长CDS序列(登录号:AT2G47600)为信息探针,利用NCBI烟草数据库比对,获得烟草MHX基因同源序列,选择一致性最高的序列,利用Primer Primer 5.0设计CDS全长克隆引物MHX-F和MHX-R(表1),分别以烟草‘K326’的cDNA为模板,使用NEB公司的KOD Fx NEO高保真酶进行烟草MHX基因的CDS序列的PCR扩增。利用天根胶回收试剂盒对PCR产物进行胶回收后,连入pGEM-T载体,转化大肠杆菌DH5α,挑取阳性克隆送去上海生工公司测序。
1.3 生物信息学分析
在NCBI网 站(https://www.ncbi.nlm.nih.gov/)上BLASTp进行蛋白预测,利用Specialized BLAST (CDD search)进行保守域分析。选择其他物种中相似性较高的MHX序列16条用MEGA5.0构建系统进化树,采用邻接法(Neighor Joining Method)作图,重复次数为1000。在蛋白生物信息学网站(http://www.expasy.org/)对NtMHX蛋白进行理化性质、亲水性/疏水性、跨膜结构、二级结构及三级结构进行预测和分析。
1.4 NtMHX基因的表达分析
根据NtMHX1和NtMHX2的CDS序列设计荧光定量特异引物2对(表1),同时选用烟草Actin基因(NTU60495)为内参基因,并设计定量PCR引物Ref-RT-F和Ref-RT-R (表1)。采用SYBR Green法在ABI Vii7实时荧光定量PCR仪上进行Real Time-PCR实验,设置3次生物学重复和3次实验重复,PCR反应体系和反应程序参照TaKaRa定量PCR试剂盒说明书。对溶解曲线、扩增效率和相关系数进行分析,选取特异性好、扩增效率接近1的引物进行实验,分析NtMHX1和NtMHX2基因在烟草组织及不同金属离子处理后各时间点的表达情况。将根中和金属离子处理0 d的叶片的相对表达量分别设置为1,其余组织中相对表达量按照2-▵▵CT法进行计算。

表1 本文中使用引物的序列信息Tab. 1 Sequence information of primers used in this research
2 结果分析
2.1 NtMHX基因克隆
以栽培烟草K326叶片总cDNA为模板,MHX-F和MHX-R为引物,扩增获得1800 bp左右的片段(图1)。经测序分析,共获得2个NtMHX基因CDS序列,一条1623 bp,命名为NtMHX1;一条1641 bp,命名为NtMHX2,序列一致性为96.4%,并扩增到了NtMHX2的一个选择性剪切体,长度为1620 bp,缺失了21 bp(844-864 bp)。选择NtMHX1和1641 bp的NtMHX2序列编码的蛋白进行后续的生物信息学分析和进化分析。

图1 烟草叶片RNA和NtMHX基因PCR产物电泳图Fig.1 Electrophoretogram of PCR products of RNA and NtMHXgenes in tobacco leaves
2.2 NtMHX蛋白的生物信息学分析
2.2.1 NtMHX蛋白质理化性质及亲/疏水性
利用在线软件ExPASy-ProtParam对NtMHX1蛋白物理化学性质进行分析,结果显示,该蛋白质分子式为C2822H4291N689O758S12,由540个氨基酸组成,相对分子量为60382.99 Da,理论等电量(pI)为5.66,属于酸性蛋白质,由20种氨基酸组成,其中Leu含量最多,占总数的11.7%,而Met的含量最少,占总数的0.7%;该蛋白为稳定蛋白,不稳定系数为38.07(<40),脂肪族氨基酸指数为111.59,总亲水性平均值为0.408。
NtMHX2蛋白物理化学性质分析结果显示,该蛋白质分子式为C2850H4333N693O766S13,由546个氨基酸组成,相对分子量为60977.72 Da,理论等电量(pI)为5.63,为酸性蛋白质。由20种氨基酸组成,其中Leu含量最多,占总数的11.2%,而Met的含量最少,占总数的0.9%。该蛋白为稳定蛋白,不稳定系数为33.16(<40),脂肪族氨基酸指数为111.25,总亲水性平均值为0.414。
利用在线软件ProtScale进一步对蛋白质的亲水疏水性进行分析,结果显示,组成NtMHX1蛋白的氨基酸大部分是疏水性氨基酸,其中,第527位分值最高,为3.222,第235位分值最低,为-2.633,说明该蛋白为疏水性蛋白。组成NtMHX2蛋白的氨基酸大部分是疏水性氨基酸,其中,第533位分值最高,为3.222,第235位分值最低,为-2.367,说明该蛋白为疏水性蛋白。
2.2.2 分析NtMHX蛋白跨膜域及亚细胞定位
利用在线软件TMHMM 2.0分析预测NtMHX蛋白跨膜区域,结果(图2)显示,NtMHX1和NtMHX2蛋白均有11个跨膜区域,是跨膜蛋白。

图2 NtMHX1和NtMHX2蛋白的跨膜结构域预测分析Fig.2 Prediction of the transmembrane domains of NtMHX1 and NtMHX2 proteins
利用在线软件SignalP 4.0分析NtMHX信号肽分布,结果显示,NtMHX1和NtMHX2蛋白均没有信号肽,为非分泌蛋白。
使用Plant-mPLoc软件预测NtMHX蛋白的亚细胞定位,推测NtMHX1和NtMHX2蛋白定位于细胞膜上。
2.2.3 分析NtMHX蛋白磷酸化位点
通过在线软件NetPhos 3.1预测NtMHX蛋白氨基酸上的磷酸化位点(图3)发现,NtMHX1蛋白氨基酸上共有45个磷酸化位点,其中包括26个Ser磷酸位点、12个Thr磷酸位点和7个Tyr磷酸位点。NtMHX2蛋白氨基酸上共有40个磷酸化位点,其中包括22个Ser磷酸位点、10个Thr磷酸位点和8个Tyr磷酸位点。

图3 NtMHX1和NtMHX2蛋白的磷酸化位点预测Fig.3 Prediction of phosphorylation sites in NtMHX1 and NtMHX2 protein sequences
利用在线软件NCBI-CD Search对NtMHX蛋白保守结构域进行预测(图4),NtMHX1和NtMHX2均存在两个CACa蛋白家族的保守结构域。

图4 烟草MHX蛋白保守结构域预测Fig.4 Prediction of conserved domains of MHX proteins
2.2.4 分析MHX蛋白高级结构
通过在线软件SOPMA对NtMHX蛋白二级结构进行预测,结果(图5)显示,NtMHX1蛋白的α螺旋占45.37%,延伸链占15.19%,β转角占5.74%,无规则卷曲占33.70%。NtMHX2蛋白的α螺旋占44.14%,延伸链占16.48%,β转角占5.13%,无规则卷曲占34.25%。使用SWISS-MODEL在线软件对NtMHX蛋白的三级结构进行预测,结果如图6,与二级结构预测结果一致,这两个蛋白富含α螺旋和无规则卷曲。

图5 NtMHX1和NtMHX2蛋白二级结构预测Fig.5 Prediction for secondary structure of NtMHX1 and NtMHX2 proteins
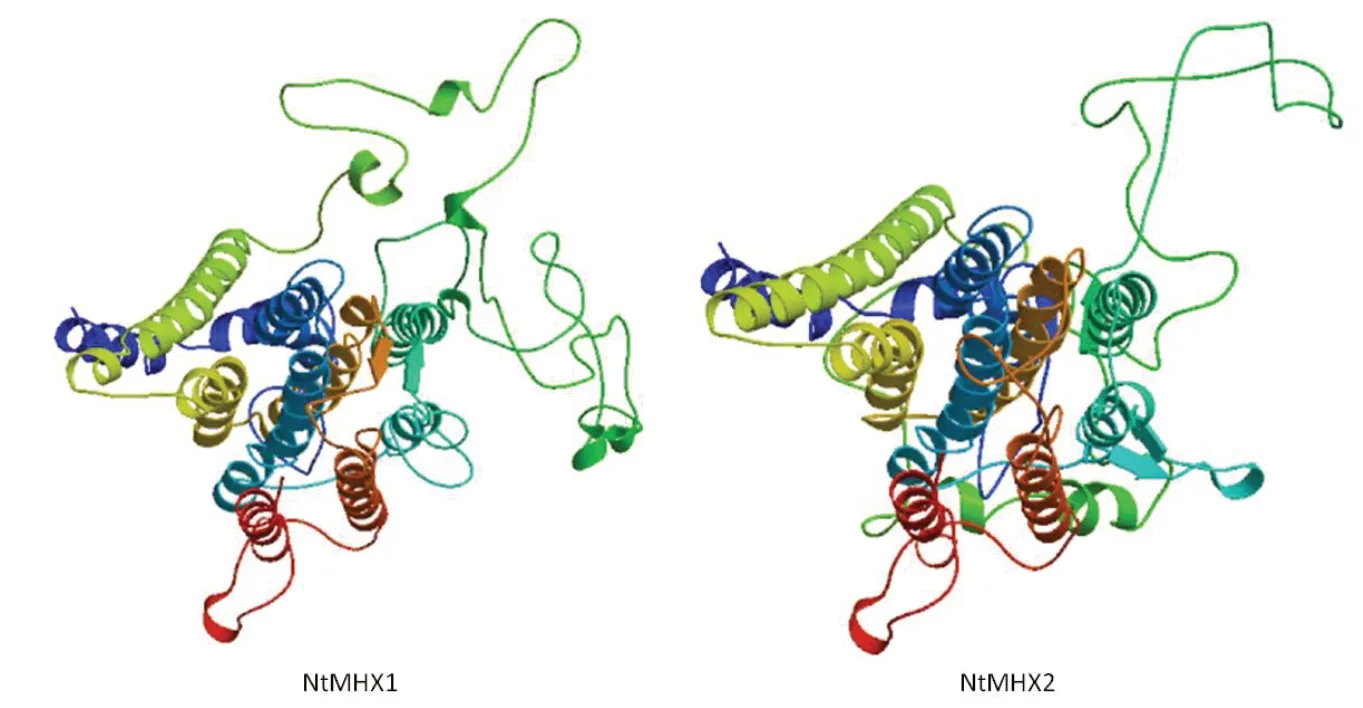
图6 NtMHX1和NtMHX2蛋白三级结构预测Fig.6 Prediction for thridary structure of NtMHX1 and NtMHX2 proteins
2.3 NtMHX蛋白序列比对及进化分析
在NCBI数据库中使用Protein Blast程序对NtMHX1和NtMHX2蛋白进行保守区域检索,发现该蛋白包含2个CaCA结构域,属于CaCA亚家族。经过蛋白同源检索,发现来自不同植物物种的MHX蛋白有很高的相似性。NtMHX1与烟草野生种绒毛状烟草(Nicotiana tomentosiformis)的一致性为99.81%,与林烟草(Nicotiana sylvestris)的一致性为96.67%,NtMHX2与林烟草的一致性为99.82%,与绒毛状烟草的一致性为96.34%,推测NtMHX1来源于绒毛状烟草,而NtMHX2来源于林烟草。
选择部分序列相似性较高、功能注释明确或有文献报道的MHX蛋白序列,利用Clustral X进行序列比对(图7),发现这两个蛋白具有保守的11个跨膜结构域。烟草NtMHX1和NtMHX2蛋白与茄科植物番茄、马铃薯具有100%的序列覆盖度,与野生番茄序列一致性最高,分别为92.78%和91.77%,与马铃薯MHX蛋白序列一致性分别为92.59%和91.77%。用MEGA5.0进行系统进化树的绘制(图8),结果可以看出,烟草和同属茄科植物的马铃薯、番茄MHX序列处于同一分枝上。序列比对和聚类分析结果均表明烟草NtMHX1、NtMHX2蛋白与番茄和马铃薯的亲缘关系最近。

图7 不同植物MHX蛋白序列同源性比较Fig.7 Homology comparison of MHX proteins from different plants
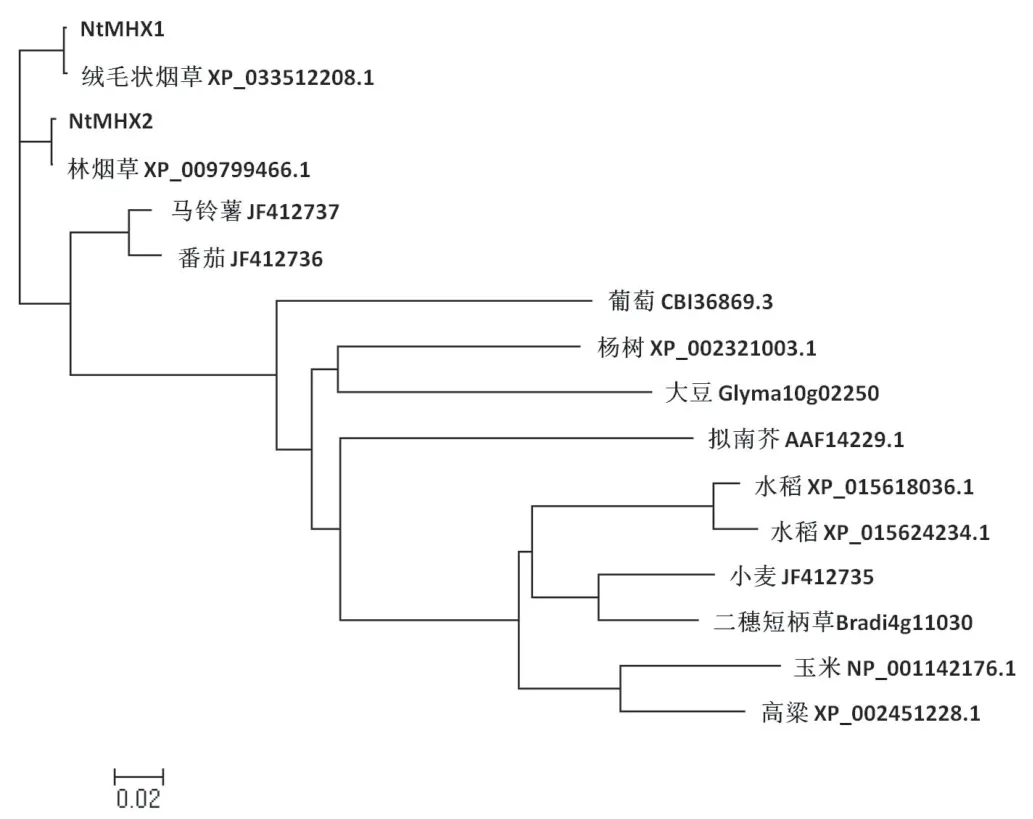
图8 NtMHX1和NtMHX2的系统进化分析Fig.8 Phylogenetic analysis of NtMHX1 and NtMHX2
选择部分序列相似性较高、功能注释明确或有文献报道的MHX蛋白序列,利用Clustral X进行序列比对(图7),发现这两个蛋白具有保守的11个跨膜结构域。烟草NtMHX1和NtMHX2蛋白与茄科植物番茄、马铃薯具有100 %的序列覆盖度,与野生番茄序列一致性最高,分别为92.78 %和91.77 %,与马铃薯MHX蛋白序列一致性分别为92.59 %和91.77 %。用MEGA5.0进行系统进化树的绘制(图8),结果可以看出,烟草和同属茄科植物的马铃薯、番茄MHX序列处于同一分枝上。序列比对和聚类分析结果均表明烟草NtMHX1、NtMHX2蛋白与番茄和马铃薯的亲缘关系最近。
2.4 NtMHX基因的组织表达特性
分别从未处理的烟草的根、茎、叶、花中提取RNA进行荧光定量分析得到结果显示(图9),NtMHX1和NtMHX2基因在根中表达量最低,在茎中表达量最高。
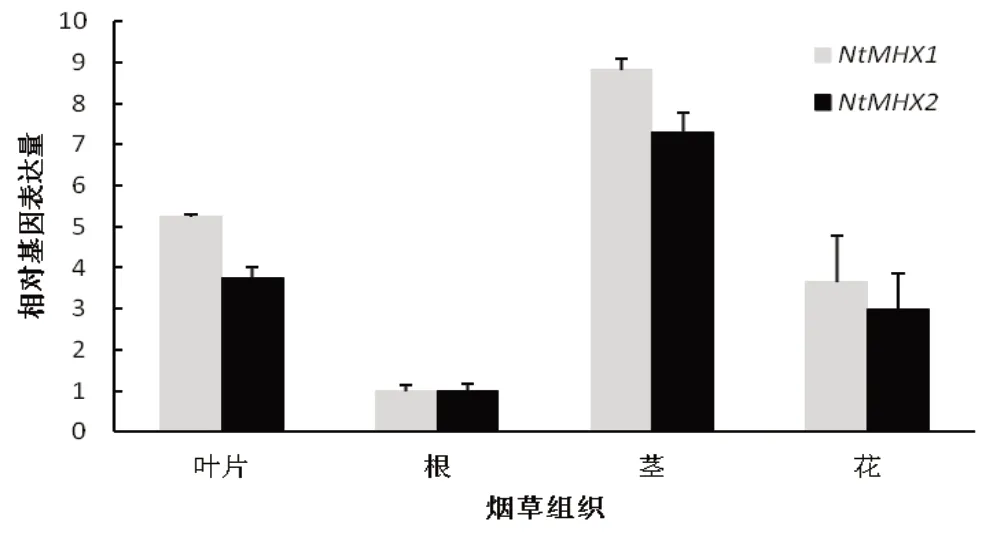
图9 NtMHX1和NtMHX2基因的组织表达特性Fig.9 The relative expression level of NtMHX1 and NtMHX2 in different tissues of Nicotiana tabacum
2.5 金属离子处理对NtMHX基因表达的影响
将苗期烟草经过不同离子处理后,检测NtMHX1和NtMHX2基因在叶片中的相对表达量。结果(图10)显 示,50 mmol/L Mg2+处 理 后,NtMHX1和NtMHX2基因表达水平迅速升高并在1 d时达到最大值(分别为2.88和2.64)后逐渐下降,在6 d左右恢复至处理前水平。50 mmol/L Mn2+处理后,NtMHX1和NtMHX2基因转录水平呈现先升高后下降的趋势,在处理后2天达到最大值(分别为3.80和3.90)。100 mmol/L Ca2+处理后,NtMHX1和NtMHX2基因的相对表达量迅速升高,在处理后2 d达到最大值(6.08和5.75)后逐渐减低。100 mmol/L K+处理后,NtMHX2基因转录水平先升高后降低,而NtMHX1基因表达水平呈现先升高后减低再升高的趋势,两个基因均再处理后2 d达到最大值,分别为5.66和6.34。100 mmol/L Na+处理后,NtMHX1和NtMHX2基因表达趋势为先升高后减低,同样在处理后2 d达到最大值(分别为6.84和6.02)。50 mM Zn2+处理后,NtMHX1和NtMHX2基因相对表达量先升高,在处理后2 d达到最大值(3.41和3.50)后减低。50 mmol/L Cu2+处理后,NtMHX1和NtMHX2基因转录本积累量先升高后减低,在处理后2 d达到最大值,分别为3.44和4.36。50 μmol/L Cd2+处 理 后,NtMHX1和NtMHX2基因转录水平迅速下降,处理后2 d的相对表达量为0.23和0.35,并在处理后4~6 d维持这一表达水平。
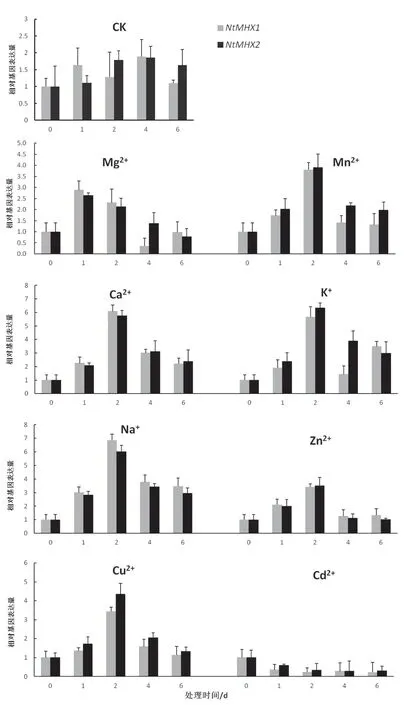
图10 不同金属离子对烟草叶片NtMHX1和NtMHX2表达水平的影响Fig.10 The effects of different metal ion treatments on the expression level of NtMHX1 and NtMHX2
3 讨论
CaCA(Ca2+/cation antiporters)亚家族蛋白广泛存在于不同的生物体内,从细菌到高等动植物都有该家族基因的报道。CaCA蛋白在维持植物体内离子平衡中发挥重要作用,进而影响了植物的生长发育[15]。根据蛋白结构和进化关系,CaCA亚家族可以分为CAX,CCX,NCL和MHX四个分支,其中MHX是植物中所特有的,且成员数量最少[14,16]。本文从烟草中克隆到2个MHX同源基因,命名为NtMHX1和NtMHX2,其中,NtMHX1来源于绒毛状烟草,而NtMHX2来源于林烟草,并与茄科植物番茄和马铃薯的MHX蛋白位于同一分支上。
生物信息学分析发现,这两个蛋白与其他植物中的MHX蛋白一样,包含CaCA保守结构域,均有11个跨膜结构域,属于跨膜蛋白,不含信号肽。亚细胞定位预测这两个蛋白定位于细胞膜上,橡胶树中该基因主要在液泡中表达[12-13],鼠耳芥(Arabidopsis Halleri)中AhMHX基因定位在液泡膜上[17]。与细胞质相比,液泡中的环境偏酸性,AtMHX蛋白将金属离子扣留在液泡中,并将液泡中的质子释放到细胞质中,本研究也发现烟草中的NtMHX蛋白等电点为5.66和5.63,为酸性蛋白。
AtMHX基因在拟南芥的维管组织,尤其是韧皮部的相对表达量较高[18],烟草NtMHX基因在根、茎、叶和花中都有表达,但茎中相对表达量最高,这与前人报道该基因主要在维管组织中表达的结果一致。鼠耳芥中AhMHX的基因表达量受植物体内Zn、Cd或者Mg含量状态的影响不显著[17]。本研究中不同金属离子处理的表达模式分析显示,Mn2+、Ca2+、K+、Na+、Zn2+处理后,NtMHX1和NtMHX2基因转录水平均先升高,后降低,并在处理2 d左右到达最大值,Cd2+处理后,NtMHX基因表达受到抑制,在2 d达到最低值。从不同金属离子的响应时间及诱导水平来看,NtMHX基因对Mg2+的响应较早,Ca2+、K+、Na+离子处理对NtMHX基因的诱导水平要显著高于Mg2+、Mn2+、Zn2+离子,只有Cd2+处理后,NtMHX基因的表达水平迅速下降,并维持低水平表达。分析发现Mn2+、Ca2+、K+、Na+、Zn2+是烟草生长发育所必需的营养元素,可以诱导NtMHX基因的表达,而有毒金属元素镉则可以抑制NtMHX基因的表达。推测NtMHX基因参与维持烟草体内金属离子的平衡,其具体功能及机制有待进一步深入研究。
4 结论
(1)从栽培烟草中克隆到NtMHX1和NtMHX2基因,开放阅读框全长分别是1623 bp和1641 bp,编码540和546个氨基酸残基,相对分子质量分别为60382.99 Da和60977.72 Da,均是包含11个跨膜结构域的酸性蛋白。
(2)进化分析表明,NtMHX1和NtMHX2与野生番茄和马铃薯的MHX蛋白高度相似。
(3)表达分析表明,NtMHX1和NtMHX2基因在烟草根、茎、叶、花中均有表达,且在茎中的表达水平最高。NtMHX基因的表达受到Mg2+、Mn2+、Ca2+、K+、Na+、Zn2+和Cu2+的诱导,并受到Cd2+的抑制,推测NtMHX基因在维持烟草体内金属离子的平衡中发挥重要作用。

