高表达SKA3预示肺腺癌患者预后不良
郭 强 陆红玲 柯希贤 方世旭 徐 刚 (遵义医科大学附属医院胸外科,遵义563000)
在中国,肺癌的发生率和死亡率在恶性肿瘤中排名第一[1]。众所周知,肺腺癌是常见的肺癌类型之一,占肺癌发病率的40%,是导致呼吸系统癌症死亡的重要原因之一[2-4]。早期肺腺癌患者能够通过手术治疗获得长期存活,而大多数中晚期患者已失去手术机会,且对化学治疗和放疗效果反应不佳,5年生存率不高于15%[5-6]。近年来,靶向治疗使肺癌患者重燃起新的希望,但其预后仍不能令人满意[7-8]。因此,需寻找新型生物标志物以增加肺腺癌患者的早期诊断率,并通过标志物识别预后不良的高危患者,运用靶向治疗以改善肺腺癌患者的预后。
SKA3 是纺锤体和动粒相关复合物中的关键一员,位于复合体着丝点外层,在有丝分裂中发挥着重要作用[9-12]。研究发现,SKA3 在结直肠癌中表达升高,升高SKA3 表达与染色体不稳定性相关。敲除SKA3 基因表达能抑制结直肠癌细胞生长和迁移,诱导结直肠癌细胞周期阻滞和凋亡,从而参与导致癌症进展[13]。此外,SKA3 表达升高与乳腺癌患者的总生存期(overall survival,OS)显著相关,且下调SKA3 基因表达能遏制乳腺癌细胞增殖[14-15]。另外,SKA3 在肾细胞癌组织表达增高,敲低SKA3基因表达能遏制肾癌细胞生长和迁移[16]。SKA3 过表达能增加了宫颈癌细胞中p-Akt、cyclin E2、CDK2、cyclin D1、CDK4、E2F1 和 p-Rb 蛋白的表达,进而增强宫颈癌细胞增殖和迁移[12]。上调GNL3 和SKA3 基因表达也能使前列腺癌细胞迁移和侵袭能力减弱,说明SKA3表达与前列腺癌进展相关[17]。然而,SKA3 在肺腺癌中的表达、潜在预后价值和调控机制仍不为人知。因此,本研究是基于TCGA 数据库中SKA3 mRNA 的表达数据,分析SKA3 肺腺癌中的表达及其临床价值。采用GSEA 分析SKA3 潜在调控的肺腺癌发生发展的分子机制。
1 材料与方法
1.1 材料 患者样本:取遵义医科大学附属医院胸外科进行手术治疗的16 例肺腺癌患者的癌组织及其配对非癌组织。本研究经遵义医科大学附属医院伦理委员会批准,16 例肺腺癌患者均签署书面知情同意书,且术前未做其他特殊治疗。RNA数据:TCGA 官网(https://tcga-data. nci. nih. gov/tcga/)下载类型为HTSeq-FPKM 的肺腺癌SKA3 mRNA 表达数据和类型为BCR XML的肺腺癌患者的临床资料。
1.2 方法
1.2.1 数据处理和分析 SKA3 mRNA表达量数据总样本数量为594 例,其中正常肺组织样本59 例,肺腺癌组织样本535 例,一一配对肺腺癌患者57 例。对TCGA 数据中的522 例肺腺癌患者的临床病理特征和预后资料进行筛选,剔除临床病理特征参数不详或不完整的病例信息及缺乏预后随访资料的病例后进行相关性分析。
1.2.2 GSEA 以SKA3 表达中位数值进行分组后对TCGA 数据库基因集进行GSEA。首先将TCGA数据库中全部基因与SKA3 表达的相关性生成一个有序的基因列表,通过GSEA 分析SKA3高表达组与SKA3 低表达组对其他基因的影响。每次分析进行1 000 次基因组排列[18]。通过P值和归一化富集评分(NES)对每种表型富集的通路进行分类。
1.3 统计学分析 数据处理和统计分析采用Perl语言和R 语言处理。Wilcoxon 秩和检验和逻辑回归分析临床病理学特征与SKA3 mRNA 表达之间的相关性,Cox回归和Kaplan-Meier分析与肺腺癌预后相关临床病理学特征之间的相关性,TCGA 数据库肺腺癌患者参数赋值见表1。NOMp<0.05为差异有统计学意义。GSEA 分析判断显著性富集的标准为NES>2,FDRp<0.01。

表1 肺腺癌患者临床病理学特征赋值Tab.1 Clinicopathological characteristics of lung adeno⁃carcinoma patients
2 结果
2.1 肺腺癌组织中SKA3 mRNA 表达升高 SKA3 mRNA 的表达在肺腺癌组织(2.523±2.221)中的表达比非癌组织(0.247±0.150)高(图1A)。进一步对TCGA 肺腺癌患者进行配对分析发现SKA3 mRNA表达在肺腺癌组织(2.417±1.838)中的表达比配对非癌组织(0.241±0.150)高(图1B),初步说明在肺腺癌发生、发展过程中SKA3的表达被激活。

图1 SKA3高表达于肺腺癌组织Fig.1 High expression of SKA3 in lung adenocarcinoma tissues
2.2 SKA3 高表达与临床病理学特征相关 研究发现SKA3 表达水平与肺腺癌患者的年龄、性别、临床分期、T 分期和淋巴结转移显著相关(P<0.01)。单因素分析发现,SKA3 表达水平与肺腺癌患者的临床病理学特征相关(表2)。SKA3 表达与肺腺癌患者的性别(OR=1.75,女性 vs 男性),临床分期(OR=2.34,Ⅰvs Ⅲ)、T分期(OR=0.66,T1vs T2)和淋巴结转移(OR=1.55,N0vs N1和OR=2.14,N0vs N2)显著相关(P<0.05)。以上结果提示SKA3 高表达的肺腺癌患者比SKA3 低表达的肺腺癌患者更容易进展到晚期,预后更差。

表2 SKA3高表达与肺腺癌临床病理学特征相关性分析Tab.2 Correlation analysis of SKA3 overexpression with clinicopathological features of lung adenocarcinoma
2.3 SKA3 与肺腺癌患者预后的相关 Kaplan-Meier 生存分析发现,高表达SKA3 的肺腺癌患者比低表达SKA3 的患者预后更糟糕(P=0.003,图2F)。单因素分析显示,SKA3 高表达、临床分期、T 分期和淋巴结转移与肺腺癌患者的预后不良相关(P<0.05,表3)。多因素分析显示,SKA3 表达水平和临床分期是肺腺癌患者预后不良的独立危险因素(P<0.05,表3)。

表3 肺腺癌患者预后的临床病理学特征分析Tab.3 Clinicopathological features of prognosis in pa⁃tients with lung adenocarcinoma
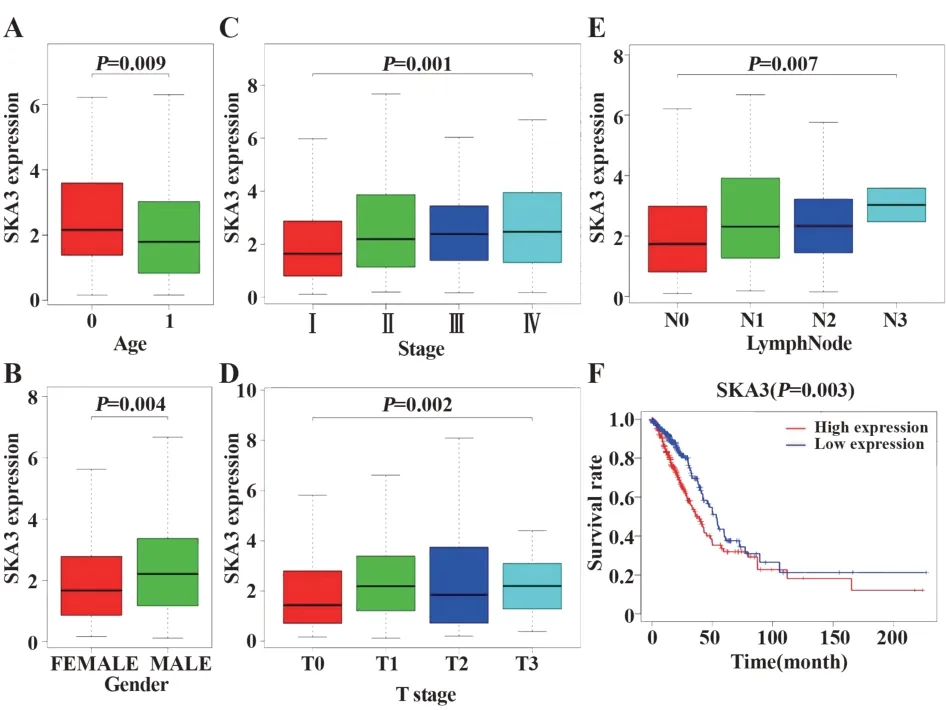
图2 SKA3 表达水平与肺腺癌患者的临床病理学特征及总生存期相关Fig.2 SKA3 expression level correlated with clinicopatho⁃logical characteristics and overall survival of lung adenocarcinoma patients
2.4 GSEA GSEA 分析提示SKA3 高表达组中与多条信号通路具有明显富集关系。以GSEA NES>2和NOMp<0.01 为筛选条件出18 条相关信号通路(表4)。发现SKA3 高表达组中显著富集到细胞周期、DNA 复制和p53 信号通路等相关的基因集(P<0.01,图3)。预示着SKA3 可能通过细胞周期、DNA复制和p53信号通路参与肺腺癌的发生发展。
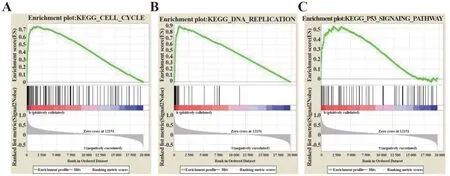
图3 SKA3高表型中富集的相关信号通路Fig. 3 Enrichment of related signaling pathways in a high SKA3 phenotype
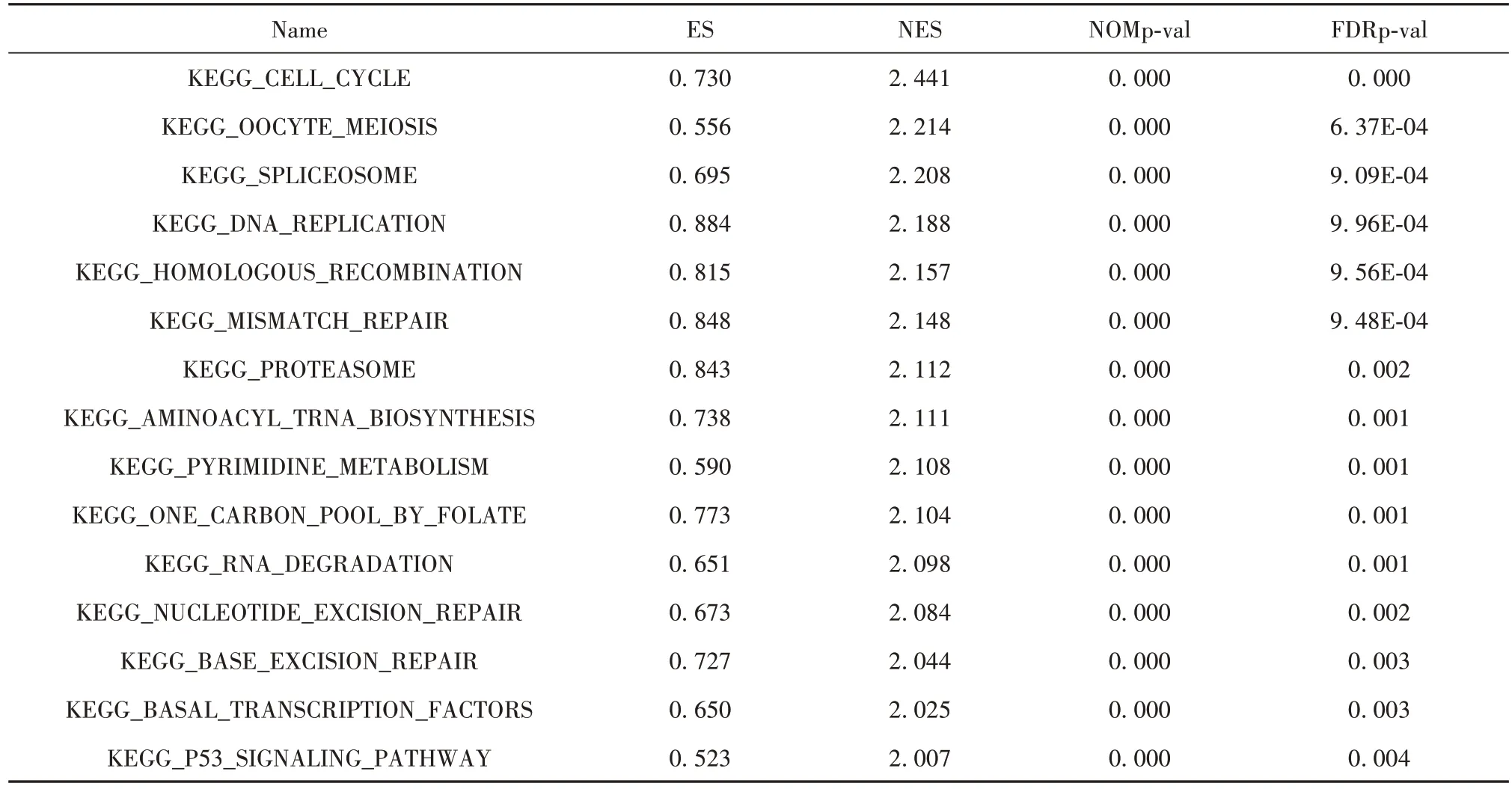
表4 SKA3高表达组中GSEA NES>2,FDRp<0.01相关的信号通路Tab.4 Signaling pathways associated with enrichment score>2 and FDRp<0.01 in SKA3 high expression group
2.5 验证SKA3 mRNA 在肺腺癌中的表达情况通过qRT-PCR 检测16 例肺腺癌患者组织和非癌组织中SKA3 mRNA 表达水平,并分析其表达与临床病理学特征之间的相关性(表5)。发现SKA3 mRNA 在肺腺癌患者癌组织中的表达增高(P<0.05)然而,SKA3 mRNA 表达水平与肺腺癌患者年龄、性别、临床分期、肿瘤大小等不具有相关性。

表5 SKA3表达水平与肺腺癌患者临床病理学参数的关系Tab.5 Relationship between SKA3 expression level and clinicopathological parameters in patients with lung adenocarcinoma
3 讨论
SKA3 参与有丝分裂过程,且与细胞增殖与凋亡密切相关[12]。研究表明,SKA3 表达水平与结直肠癌、乳腺癌和前列腺癌等肿瘤预后有关[12-17]。然而,SKA3 与肺腺癌之间的关系未见相关文献报道。本课题组对TCGA 数据库中的肺腺癌RNA 数据进行统计分析可视化处理,且发现SKA3 在肺腺癌组织中出现高表达的征象。此外,在16例临床肺腺癌组织样本中也发现了SKA3 mRNA 表达水平升高。单因素分析说明,SKA3 高表达的肺腺癌分期较晚,淋巴结转移数目更多和预后更差有关。SKA3 高表达、临床分期、T 分期和N 分期均可能是影响肺腺癌患者的预后。多因素分析发现SKA3 高表达和临床分期是肺腺癌患者预后不良的独立危险因素。GSEA 发现SKA3高表达组与细胞周期、DNA 复制和p53 信号通路显著富集,提示SKA3 高表达可能通过调控细胞周期、DNA 复制和p53 信号通路使肺腺癌进展,导致肺腺癌患者预后不良。
生理状态下,细胞周期能维持着自身稳定,防止细胞过度生长和增殖,失去细胞周期的调控则导致细胞增殖异常,进而导致肿瘤的发生[19-21]。p53信号通路是细胞周期调控中的一条重要的通路,该通路异常常导致多种细胞周期因子表达异常,进而导致细胞过度增殖和肿瘤细胞耐药。如环指蛋白Znf179 可通过p53/p27/p21 信号通路调控细胞周期,促进胶质瘤(glioma,GBM)细胞向高级分化转变,并遏制 GBM 发生发展[22]。TP53 介导的糖酵解和凋亡诱导因子(TIGAR)能调控p53 表达而促进肿瘤细胞G1 期阻滞。TIGAR 调控抑制细胞周期蛋白因子 CDK-2、CDK-4、CDK-6、Cyclin D、Cyclin E 的合成,使RB 蛋白去磷酸化增强,从而遏制细胞周期转变(G1-S 期)[23]。p53 失活激活了 Raf/Mek/Erk 级联信号通路以提高肿瘤细胞增殖能力[24]。有丝分裂到DNA 复制过程是细胞周期中的重要步骤。致使DNA复制异常与人类多种疾病相关。如MicroRNA-26a/b 能通过靶向CDC6遏制肺癌细胞DNA复制,调控肿瘤细胞迁移[25]。SKA3 能磷酸化 CDK1 和结合Ndc80C,促使SKA 复合体参与有丝分裂过程,调控细胞生长[12]。本研究通过 GSEA 发现 SKA3 高表达能促进细胞周期转变、DNA复制和p53信号通路,这与文献报道的肿瘤相关调控机制相符合。因此,推测细胞周期、DNA 复制和p53 信号通路也可能是肺腺癌发生发展中重要调控通路。
本研究使用的TCGA 数据库样本量大,临床资料完整,可信度高。不足之处在于TCGA 数据库提供的数据是SKA3 mRNA 水平,虽在16 例肺腺癌样本进行了验证,但无法完全代表SKA3 蛋白水平,且未在蛋白水平上进行验证。本研究对TCGA 数据分析和GSEA 预测的通路为进一步深入研究SKA3 在肺腺癌中的作用提供了线索和依据。

