Keap-1/Nrf2/HO-1通路在曲美他嗪抑制顺铂诱导大鼠心肌损伤作用的研究
赵丽 陈昕
顺铂(cisplatin,DDP)作为化疗药物因其价格低廉且效果突出而在各种恶性肿瘤的治疗中广泛应用,然而顺铂的临床应用受到耐药和不良反应的限制。顺铂治疗期间或治疗后不久可出现相关的心脏不良事件,包括心律失常、心室肥大、心肌炎和心绞痛[1-2],但其诱导的心脏损伤的机制仍不明确,而氧化应激被认为是其损伤主要的机制之一。因此作为临床广泛应用的化疗药物之一,减轻顺铂诱导的心脏损伤意义重大[3-4]。核转录因子2(nuclear transcription factor 2,Nrf2)是调控细胞氧化应激的核心转录因子,能发挥强大的抗氧化/抗凋亡作用。当细胞或机体暴露于活性氧(reactive oxygen species,ROS)时,ROS 可引起细胞骨架相关性抑制蛋白Keap-1 的磷酸化,从而使Keap-1-Nrf2 复合体解离,使Nrf2 由胞质移位到胞核内,与受其调控的抗氧化酶基因的抗氧化反应元件结合,使抗氧化蛋白水平增加。有研究显示Nrf2 可以抵抗ROS 引起的心脏损伤[5-7],而Nrf2 可能与顺铂诱导的心脏损伤相关[8-9]。
曲美他嗪(trimetazidine,TMZ)是一种代谢调节剂,常用于抗心绞痛的治疗,通过抑制3-酮酰辅酶A硫酶降低脂肪酸氧化,并增强心肌葡萄糖氧化[10-11]。研究显示CSE/H2S 通路通过抑制凋亡和氧化应激介导曲美他嗪对H9C2 心肌细胞起到保护作用[12]。有研究发现TMZ 可以减轻顺铂诱导的肾损伤、肝损伤[13-14],目前还未有TMZ 减轻顺铂心脏损伤的报道。为进一步探索TMZ 在Nrf2/ARE 信号通路中对心肌细胞的调控机制,本研究拟检测 Keap-1、Nrf2 和抗氧化酶类靶蛋白如血红素氧合酶 1(hemo oxygenase 1,HO-1)的表达水平,揭示其减轻顺铂不良反应和保护心脏作用的潜在机制。
1 材料与方法
1.1 材料
顺铂和TMZ 购自美国MCE 公司。抗体及引物购自美国Abcam 公司,包括Keap-1、Nrf2、H0-1 抗体和二抗;引物序列为Nrf2-rFGCACATCCAGACA GACACCAN,Nrf2-rRGGCTGGGAATATCCAGGG CA,HO-1-rFCACTGCTGACAGAGGAACACA,HO-1-rRGCATAAATTCCCACTGCCACG 及Keap-1-rFA ACCCCATGACCAACCAGTG,Keap-1-rRCACTCG TCTCGATCTGGCTC。Counting Kit-8(CCK8)购自美国Sigma-Aldrich 公司。GAPDH 抗体购自华安生物公司。ChemiDocTMXRS+成像系统来自美国Bio-Rad 公司。Novex®ECL 化学发光底物试剂盒购自美国Thermo Fisher Scientific 公司。ROS 试剂盒购自南京建城公司。Sprague Dawley(SD)大鼠购自北京生命河实验动物技术有限公司。
1.2 方法
1.2.1 大鼠心肌细胞的分离和细胞活力检测 新生2d 的Sprague Dawley(SD)大鼠麻醉后切下心脏并分离心室,用Hanks 溶液洗涤3 次,并切成小碎片。通过胰蛋白酶消化、离心后取细胞悬浮液在培养基接种后收集未附着的心肌细胞,接种到96 孔培养板中分组:对照组,200 μM 顺铂治疗(顺铂组),200 μMTMZ预处理(顺铂+TMZ 组),在用TMZ 预处理2 h 及在200 μM 顺铂处理24 h 后使用Counting Kit-8(CCK8)测量细胞活力。使用酶联免疫吸附测定(ELISA)读取器在450 nm 处测量每个孔的光密度。
1.2.2 ROS 水平检测 将细胞与50 μM DCFH-DA探针37 ℃孵育30 min。使用荧光微板读取器分别在488 nm 和525 nm 的激发和发射波长下测量荧光强度。使用试剂盒测量细胞中ROS 的含量。
1.2.3 Western blot 检测 Keap-1、Nrf2 及HO-1 蛋白的表达提取蛋白,计算上样量。配制10%分离胶,5%浓缩胶,并进行跑胶。转膜:取出胶板,剪合适大小的硝酸纤维素膜放入甲醇中激活1 min,按照黑板-黑色泡沫-滤纸-胶-硝酸纤维素膜-滤纸-黑色泡沫-白板顺序300 mA,60 min 转膜。封闭:转膜结束后,取出硝酸纤维素膜用铅笔标记marker,放入封闭液中,摇床60 min。一抗:封膜加一抗,4 ℃过夜。洗膜:TBST 3 次,TBS 1 次,10 min/次。二抗:封膜加2 抗,室温摇床1.5 h。封膜避光加显色剂,上机器跑6 min。Image J 软件对信号强度进行量化。
1.2.4 Real-time PCR 检测 Keap-1、Nrf2 及HO-1 的表达 提取RNA:取材后将组织加入一定量的Trizol 进行超声,加入1/5 Trizol 量的氯仿,震荡20 s后室温静置5 min,12 000×g 离心15 min,将上层液体吸入新的EP 管中,加入1/2 Trizol 量的氯仿,震荡20 s后,室温静置10 min,12 000×g 离心10 min,弃掉上清后,加入等Trizol 量的75%乙醇进行洗脱,7 500×g 离心5 min,弃掉上清后,室温晾干,加入适量DEPC 水,56 ℃金属浴孵育10 min。逆转录:测量样本的浓度,计算所需RNA 的量。设置10 μL 体系:5×buffer 2 μL,dNTP 0.5 μL,M-MLVRT 0.5 μL,去离 子 水1 μL,Random Primer1 μL,RNA+H2O 5 μL。上机程序:70 ℃10 min,4 ℃ 5 min,30 ℃10 min,42 ℃ 1 h,70 ℃ 15 min,4 ℃保存。Real-time PCR:设置10 μL,Mix5 μL,目的引物1 μL,cDNA4 μL,内参选用18S。程序:94 ℃10 min,(94 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s)×40 个循环,94 ℃ 1 min,50 ℃ 1 min,65~95 ℃,每增加1 ℃采集一次荧光,95 ℃ 1 min。根据Ct 值计算表达量。
1.3 统计学处理
Image J 软件对Western blot 结果进行统计学分析,余所有数据均采用GraphPad Prism 6 软件进行统计学分析。实验结果以x±s 的形式表示。多组间比较采用单因素方差分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 TMZ 显著减弱顺铂对心肌细胞活力的抑制作用
如图1 所示,与对照相比,经顺铂处理24 h 后心肌细胞活力显著降低(P<0.0001),TMZ 预处理明显减弱顺铂对细胞活力的抑制作用(P<0.01)。
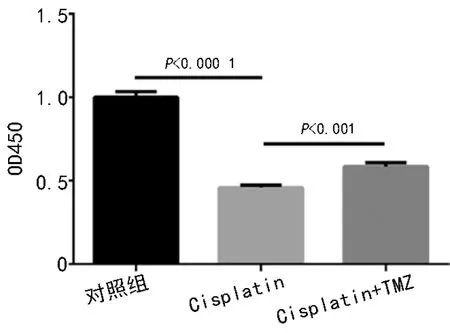
图1 顺铂对大鼠心肌细胞活力的毒性作用以及TMZ 的保护作用
2.2 TMZ 有效抑制ROS 的活性
如图2 所示,与对照相比,顺铂显著促进ROS(P<0.000 1)的聚集,与顺铂处理的细胞相比,使用TMZ预处理能有效地抑制ROS(P<0.01)的活性。
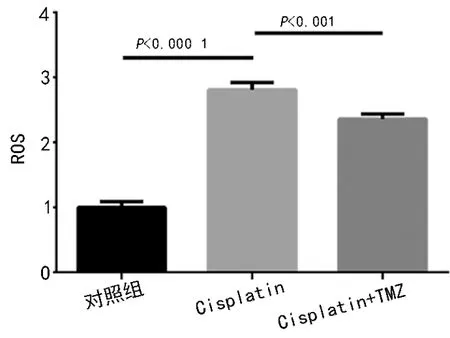
图2 顺铂对大鼠心肌细胞氧化作用以及TMZ 的抗氧化保护作用
2.3 TMZ 明显减低Nrf2 和Keap-1 的蛋白表达,增强HO-1 蛋白的表达
如图3 所示,为Nrf2、Keap-1 和HO-1 蛋白的表达情况。如表1 所示,与对照组相比,顺铂处理的Nrf2 表达显著增加(P<0.001),TMZ 明显促进了Nrf2 的核易位(P<0.01)。顺铂促进了Keap-1(P<0.01)和HO-1 的表达(P<0.01),TMZ 进行预处理可抑制Keap-1 的表达(P<0.01),增强HO-1 的表达水平(P<0.01)。

图3 Keap-1、Nrf2 和HO-1 蛋白的表达
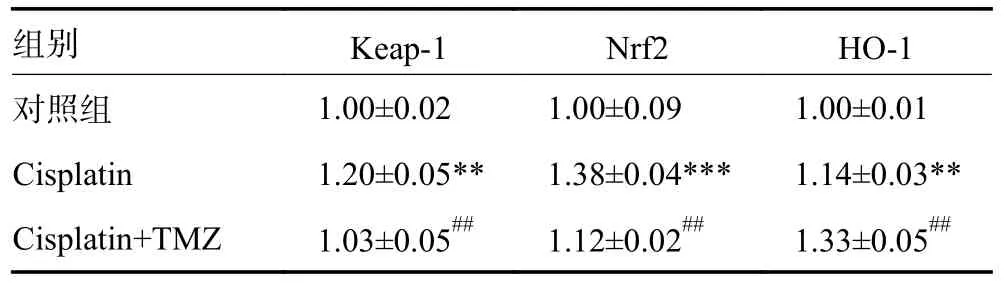
表1 TMZ 明显减低Keap-1 和Nrf2 蛋白的表达,增强HO-1的表达
2.4 TMZ 显著抑制了Keap-1 的表达,促进了Nrf2核易位,显著增强了HO-1 的表达
如表2 所示,顺铂显著促进Keap-1(P<0.0001)和HO-1 的表达(P<0.0001)。与顺铂处理的细胞相比,用TMZ 进行预处理,明显抑制了Keap-1 的表达(P<0.000 1),增强了HO-1 的表达水平(P<0.001)。与对照组相比,顺铂处理的Nrf2 表达显著增加(P<0.0001)。与单独使用顺铂治疗相比,TMZ 预处理显著促进了Nrf2 的核移位(P<0.01)。
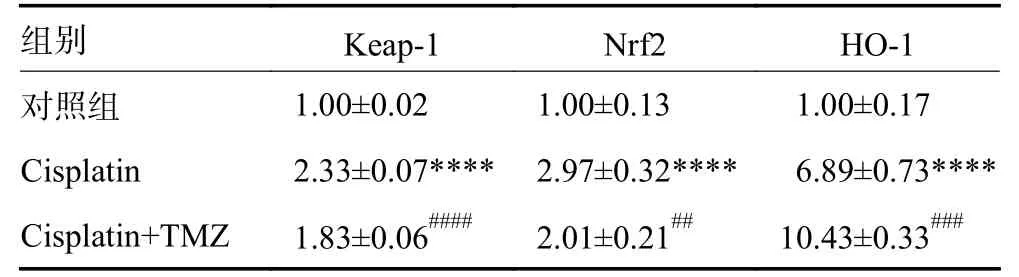
表2 TMZ 通过抑制Keap-1 调控Nrf2 及HO-1 的表达
3 讨论
顺铂导致心脏不良事件已有报道,本研究也发现顺铂显著抑制了大鼠心肌细胞的活力,而TMZ(200 μM)可显著改善顺铂对心肌细胞活力的抑制,证明TMZ对顺铂诱导的大鼠心肌损伤具有保护作用。
氧化应激是顺铂诱导的心脏损伤的主要机制之一。氧化物质ROS 大量产生会导致抗氧化防御能力的破坏或消耗[15-16],同时过量的ROS 也可引起膜脂质过氧化,产生MDA 等毒性物质[17-18],直接导致心脏损伤[19]。有研究表明,TMZ 可抑制氧化应激[20],可减轻ROS 触发的线粒体功能障碍[21],改善顺铂诱导的肾损伤和肝损伤[13-14]。本实验结果也表明,代谢调节剂TMZ 对顺铂诱导的心脏损伤具有显著的调控作用,细胞内ROS 的水平受到明显的抑制,表明TMZ 对顺铂所诱导的心脏损伤的改善作用与其提高抗氧化酶的活性而起到清除自由基的作用有关。Nrf2 是抗氧化防御系统的关键调节因子,正常情况下,Nrf2 与Keap-1结合稳定地存在于细胞质中,当细胞或机体受到损伤时,Keap-1 磷酸化使 Nrf2 从Nrf2-Keap-1 复合体中解离而移位到胞核内,与其调控的HO-1、γ-谷氨酰半胱氨酸合成酶(γ-GCS)和醌氧化还原酶 1(NQO1)结合而上调下游抗氧化酶的表达,抵抗ROS 的毒性作用。有研究发现,激活Keap-1/Nrf2/HO-1 信号通路可抑制氧化应激[22-23]。本研究的数据也表明,TMZ 预处理可以显著降低Keap-1 的表达,胞浆中的Nrf2 从Keap-1 解离并移位到核内,上调了下游HO-1 的表达,抑制了ROS 的产生,表明TMZ 具有显著的抗氧化应激作用。
此外,Dixon 等[24]2012年在研究纤维肉瘤的抗肿瘤药物时发现化合物erastin 能诱导肿瘤细胞产生一种以线粒体皱缩、双层膜密度增加为形态学特征,以铁依赖的脂质过氧化反应为代谢特征,且受胱氨酸转运通路调节的细胞死亡方式,并将其命名为铁死亡(ferroptosis)。近几年的研究发现铁死亡在细胞代谢、氧化还原、退行性疾病、癌症等方面发挥重要作用[25]。有研究发现P62/Keap-1/Nrf2 信号通路抑制了铁死亡,在氧化应激导致的铁死亡中起到重要作用[26]。谷胱甘肽过氧化酶 4(glutathione peroxidase 4, GPX4)广泛存在于细胞质、细胞核、线粒体及膜上,具有降低脂质体过氧化反应、修复膜脂质的氧化损伤的功能[27],是调控铁死亡且也是调控ROS 的重要调控因子[28-29],而Nrf2/ARE 通路的激活有助于HNC 细胞抵抗GPX4抑制,而抑制该通路则逆转了HNC 对铁死亡的抵抗[30],表明了Nrf2/ARE 通路与铁死亡的密切关系。
综上所述,本研究表明了TMZ 能显著抑制顺铂引起的心脏损伤,这部分依赖于Keap-1/Nrf2/HO-1 相关的抗氧化防御系统,而Keap-1/Nrf2/HO-1 抗氧化通路可能与铁死亡关键调节蛋白GPX4 存在关联,提示曲美他嗪的抗氧化作用也可能与铁死亡通路相关,可作为抗氧化剂用于化疗药物引起的心脏损伤的治疗,也为研究曲美他嗪的心脏保护机制提供了新思路。
4 小结
已发现和证实化疗药物具有心脏损伤作用,其致损伤作用的途径包括氧化应激等。本实验中代谢药曲美他嗪可以减轻顺铂诱导的心肌损伤,改善心肌细胞的活力,并减轻ROS 的蓄积,具有抗氧化作用。在抗氧化通路Keap-1/Nrf2/HO-1 中可增加抗氧化反应元件HO-1 的表达水平,证明了曲美他嗪具有明确的抗氧化作用,可减轻顺铂诱导的心脏损伤,也为肿瘤患者的综合治疗提供依据。

