器官保存液培养阳性率、病原菌分布及临床意义研究
陈志强,张艳君,薛 晨,谈锦艳,马秀珍,姜倩倩,赵月秀,黄 怡,2,李 奕
(海军军医大学第一附属医院 1. 疾病预防控制科; 2. 呼吸与危重症医学科,上海 200433)
近年来,尽管外科技术、免疫抑制手段及抗菌药物不断发展,但感染仍然是器官移植受者术后发病和死亡的主要原因[1],受者术后感染的预防、诊断及治疗成为目前器官移植面临的重要挑战。移植后早期发生的感染主要为医疗保健相关感染,其中包括供者来源感染(donor-derived infection,DDI)[2]。我国供者器官主要来自公民逝世后捐献(DCD),由于多数供者在逝世前存在重症监护病房(ICU)留滞时间长、侵袭性操作多及使用广谱抗菌药物等危险因素,DDI越来越受到移植医生的关注[3],2018年发布的《中国实体器官移植供者来源感染防控专家共识(2018版)》[4](以下简称《共识》)建议多学科协作对供者主动筛查以防控DDI。器官保存液(pre-servation solution, PS)是受者术后感染的潜在来源,PS培养是否作为供者常规筛查内容尚存在争议。有学者[5]认为,PS培养结果可提示移植器官病原菌污染情况,对受者治疗策略有指导意义,但也有研究[6-7]指出,PS中微生物多来自污染,并且由PS污染导致的受者感染较罕见,常规监测意义不大。本研究旨在通过回顾性分析供者器官PS培养结果,了解受者术后感染情况。
1 对象与方法
1.1 研究对象 采用回顾性研究方法,选择2016年6月—2020年12月上海某三甲医院接受器官移植的485例患者为研究对象,入组标准:DCD来源器官移植患者、供者器官PS行微生物培养。
1.2 方法 收集器官移植患者PS微生物培养结果及术后感染资料。根据培养结果将患者分为阳性组和阴性组,并将阳性组患者依据病原菌分成亚组,比较不同组患者术后感染率的差异。
1.3 统计分析 应用Excel和SPSS 24.0软件进行统计分析,偏态分布计量资料以中位数及四分位数[M(P25,P75)]表示,两组比较采用非参数秩和检验,计数资料以例数或百分比表示,采用卡方检验或Fisher’s确切概率法,P≤0.05为差异有统计学意义。
2 结果
2.1 器官PS培养情况 485例患者中221例PS培养阳性,阳性率为45.57%。分离病原菌菌种数构成情况见表1。共分离菌株327株,其中细菌282株(占86.23%),真菌45株(占13.76%),见表2。分离常见多重耐药菌47株,其中较多的为耐碳青霉烯类肺炎克雷伯菌(CRKP)、耐碳青霉烯类鲍曼不动杆菌(CRAB),分别占42.55%、38.29%,见表3。

表1 221份PS培养病原菌菌种数构成Table 1 Constituent of pathogen species in 1 221 PS cultures

表2 PS分离病原菌构成情况Table 2 Constituent of pathogens isolated from PS

表3 PS分离常见多重耐药菌构成情况Table 3 Constituent of common MORO isolated from PS
2.2 受者基本情况 不同组受者性别、年龄、移植类型、手术时间等临床资料比较,差异均无统计学意义(均P>0.05),具有可比性。见表4。

表4 PS培养阳性组、阴性组受者临床资料比较Table 4 Comparison of clinical data between PS culture po-sitive group and PS culture negative group
2.3 受者术后感染率 PS培养阳性组受者术后感染率为12.22%(27/221),阴性组为6.82%(18/264),两组比较采用倾向性评分匹配方法,共获得214对匹配对,成组设计资料χ2检验结果显示,差异无统计学意义(P=0.203),见表5。PS培养不同病原菌种数组受者术后感染率存在统计学差异(P=0.005),其中≥3种菌组高于单一菌阳性组,差异有统计学意义(P=0.004),见表6。PS培养不同病原菌组受者术后感染率存在统计学差异(P<0.001),其中CRKP、白念珠菌组均高于其他病原菌组,差异有统计学意义(P<0.001,P=0.034),见表7。

表5 PS培养阳性组、阴性组受者术后感染情况Table 5 Post-operative infection between PS culture positive group and PS culture negative group

表6 PS培养不同病原菌种数各组感染情况Table 6 Infection in groups with different kinds of strains of pathogens isolated from PS culture
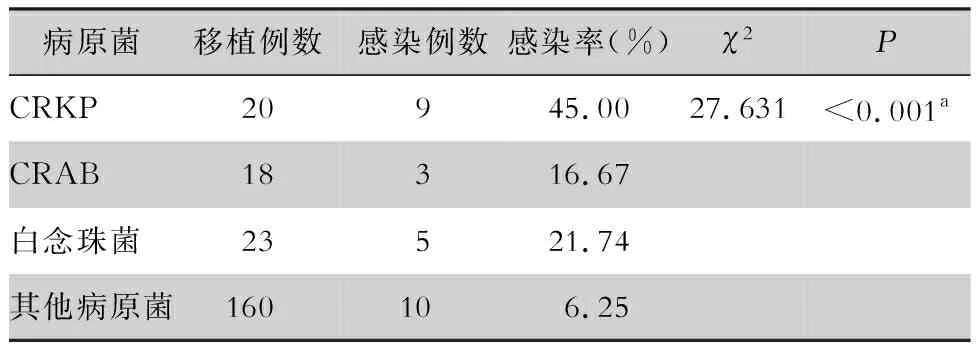
表7 PS培养不同病原菌各组感染情况Table 7 Infection in groups with different pathogens isolated from PS culture
2.4 受者术后感染部位分布 PS培养阳性组感染受者以手术部位感染为主,占45.45%,阴性组感染受者以呼吸系统感染居多,占38.89%,两组感染部位分布差异无统计学意义(P=0.164),见表8。

表8 移植术后受者不同部位感染例次数构成情况[例(%)]Table 8 Constituent of cases of infection in different sites of recipients after transplant (No. of cases [%])
3 讨论
PS是一种无菌液体,用于保持移植器官良好质量,延长保存时间,但也可成为微生物生长的良好培养基,PS中的微生物可能来自两种情况,一种是源于供者器官,另一种是源于器官获取过程中的污染,以上两种情况均可通过移植过程导致受者感染[5,8]。PS培养真菌阳性引起受者发生真菌性动脉瘤风险已被证实,受者的治疗及监测方案有国际共识可遵循[9];PS培养细菌阳性导致受者感染的风险目前尚不清楚,针对培养结果的管理方案缺少共识[10]。有学者[7,11]指出,针对性预防抗感染治疗并不能获得明确收益。PS培养的微生物分布情况目前尚不完全清晰,最近研究[9]显示,虽然凝固酶阴性葡萄球菌是最常见的PS培养阳性病原菌,但一些毒力较强、易产生耐药的肠杆菌目细菌越来越引起关注。
本研究纳入485例器官移植患者,其中肝移植112例,肾移植373例。221例患者PS培养阳性,阳性率为45.57%,培养阳性病原菌以凝固酶阴性葡萄球菌居多(20.49%),其次为肺炎克雷伯菌(11.32%)、屎肠球菌(8.26%)、大肠埃希菌(8.26%)。PS培养阳性率受移植类型、研究设计、样本量及采样时机等因素影响[10],不同研究报道的PS培养阳性率变化范围很大。Oriol等[12]报道的50例移植肝PS样本中,46例培养阳性,阳性率为92%。国内一移植中心一项大样本研究[13]发现,移植肾PS培养阳性率为77.8%。多数研究[9-10]结果显示,凝固酶阴性葡萄球菌等皮肤定植菌是PS培养常见病原菌,本研究结果支持该结论,提示PS培养阳性病原菌主要来自器官获取过程污染而非供者器官。导致获取过程中污染的原因[6,11,13]可能包括:不严格的无菌操作,供者表皮定植菌及周围环境微生物通过手术操作传播至PS,器官获取过程中供者肠道破损也可造成污染。因此,优化器官获取、保存和移植前器官修整流程,严格无菌操作,有助于降低器官PS污染风险。
国外一项Meta分析[10]结果显示,PS引起的受者感染率为4%,感染部位包括泌尿系统、手术部位、血流及呼吸系统。国内学者Yu等[13]回顾分析其所在移植中心肾移植受者术后感染情况,结果显示受者PS相关感染率为2.9%,感染类型较多的为手术部位感染及菌血症,其他感染部位也可涉及。本研究结果显示,PS培养阳性组受者术后感染率及感染部位分布与阴性组相比,差异均未达到统计学意义,可能是由PS相关感染率较低且涉及多种感染部位所致。研究[10-11,14]显示,尽管PS相关感染率较低,但导致的受者病死率可达35%,即使没有引起感染,也可造成移植器官功能障碍,针对PS培养结果进行预防性抗感染治疗可降低受者PS相关感染及移植器官失功风险。然而,有学者[7,15]指出,针对性预防抗感染治疗并不能降低受者PS相关感染率,反而会增加产超广谱β-内酰胺酶(ESBLs)肠杆菌目细菌产生的风险,认为密切关注受者临床症状及微生物监测是较合理的措施,并且可减少抗菌药物使用。此外,本研究发现病原菌≥3种阳性组受者术后感染率高于单一菌组(P<0.05),多种(≥3)菌培养阳性提示PS污染程度可能较大,更易导致受者术后感染,但该结果未看到相关文献报道。PS培养阳性可增加受者术后感染风险,造成的受者感染涉及多种部位,虽然PS相关感染率较低,但给受者带来严重不良结局,对于是否进行常规针对性预防抗感染治疗,目前尚存在争议。
多重耐药菌感染是目前全世界面临的难题,对患者生命安全造成严重威胁,2017年世界卫生组织(WHO)制定了急需研发有效抗菌药物的多重耐药菌优先等级,其中将耐碳青霉烯类革兰阴性菌(CRGN)列为首要等级[16]。本研究发现PS分离的327株病原菌中,有常见多重耐药菌47株,占14.37%,其中较多为CRKP(42.55%)、CRAB(38.29%),CRKP阳性组受者术后感染率高于其他病原菌组(P<0.05)。意大利学者进行的一项全国监测研究[17]发现,16.5% 的实体器官移植受者分离到G-菌,其中CRGN占26.5%,CRGN感染可显著增加受者术后死亡风险。Lewis等[18]研究显示,实体器官移植中,多重耐药G-菌可导致受者严重不良结局,59%的受者死亡或移植器官摘除。国内调查数据[4]显示,引起DDI的病原菌以细菌为主,其中CRKP占41.5%。全国细菌耐药监测网数据[19]显示,2014—2019年肺炎克雷伯菌对碳青霉烯类抗生素的耐药率呈持续上升趋势,2019年全国CRKP检出率为10.9%,较2014年的6.4%上升了4.5%。朱兰等[20]报道13例受者发生供者来源的CRKP感染,同时指出尽早、足量及延时使用抗菌药物可减弱肾移植术后供肾来源CRKP的致病性,降低移植肾切除概率和病死率,改善预后。鉴于CRKP具有易在院内传播、缺乏有效抗菌药物、致死率高等特点[21-22],当PS培养CRKP阳性时,建议尽早进行抗感染治疗,以改善受者预后。
真菌具有嗜血管性,对血管破坏大,所引发的真菌性动脉炎常常造成移植器官吻合口瘘或动脉壁破裂,并且治疗困难,受者一旦发生供者来源真菌感染,易出现严重不良结局[23]。本研究结果显示,PS培养分离菌株中真菌占比13.76%,其中以白念珠菌多见(占51.11%),与之前文献[9-10]报道的结果相似,白念珠菌阳性组受者术后感染率高于其他病原菌组。国外学者研究[24-25]结果显示,受者术后供者来源的真菌感染主要由PS污染导致,虽然发生率低,但可引起受者术后严重并发症及高死亡率,建议对PS培养真菌阳性的受者进行预防性抗真菌治疗。蔡文利等[26]报道12例供者来源的真菌感染受者,其中11例术后出现假性动脉瘤或移植肾破裂并发症,4例受者出现死亡结局。冯豪等[27]对PS培养为白念珠菌的受者采取相应的抗真菌治疗方案,取得了良好的治疗效果,指出针对PS培养结果进行抗感染治疗可有效防止真菌感染所致血管并发症。重视并及时预防PS来源的真菌感染,对改善受者的预后极为重要。《共识》指出,一旦PS培养酵母菌或念珠菌阳性,建议立即进行抗真菌治疗。
本研究尚存在一定局限,首先,由于未获悉供者病原筛检结果及器官获取过程中肠道损伤情况,无法判断PS培养阳性病原菌是来自供者器官还是污染所致;其次,由于缺少同源性分析技术手段,未获得受者PS相关感染率;再者,本研究采用回顾性研究方法,有学者[10]指出不同研究方法对PS培养阳性率存在一定影响,前瞻性研究的PS培养阳性率高于回顾性方法,可能与前者通常采用灵敏度高的检测方法有关。
综上所述,我国供者器官以DCD来源为主,多数供者潜在感染风险高,由于器官获取时机的不确定性造成供者感染评估、筛查不彻底,以及部分病原体处于感染窗口期,致使供者的主动筛查存在一定局限。PS培养监测作为供者来源感染筛查的最后环节,对受者预后判断和移植后抗感染策略具有指导意义。鉴于受者CRKP及真菌感染的严重性,同时本研究观察到PS培养CRKP、白念珠菌阳性的受者术后感染率高于其他病原菌,结合《共识》意见及相关研究结果,若PS培养CRKP、酵母菌或念珠菌阳性,建议立即进行相应抗感染治疗。由于PS培养阳性率高,以凝固酶阴性葡萄球菌等皮肤菌群居多,并且由PS污染引起的感染率较低,因此,是否针对培养结果常规预防性抗感染治疗,以及如何避免抗菌药物过度使用导致受者发生耐药菌感染风险,仍需采用更优设计的前瞻性、多中心研究进一步探讨。

