奥拉帕利治疗肝内胆管细胞癌1 例
潘天帆, 黄祥忠
1 临床资料
患者男,59 岁。 因 “进行性黄疸伴皮肤瘙痒1 个月” 入院。既往体健。 患者自2019 年3 月无明显诱因出现皮肤、 巩膜黄染,有尿色加深,伴周身瘙痒,右上腹隐痛不适,无畏寒发热,无恶心呕吐等。 2019 年4 月27 日于我院肝胆外科完善上腹部MR 检查示:肝左叶肝内胆管、胆总管肝门部截断;肝左叶巨大占位,考虑肝内胆管细胞癌(ICC)可能大;肝右叶肝内胆管轻度扩张;肝门部、肝胃间及后腹膜淋巴结肿大。 肝功能:AST 190.7 U/L,ALT 340.6 U/L,TBIL 182.5 μmol/L,DBIL 170.0 μmol/L;AFP 23.2 ng/mL,CA19-9>1 000 U/mL,CA125 116.4 U/mL。
考虑患者恶性胆道梗阻, 肝脏肿瘤已侵犯周围组织,伴淋巴结转移,无手术切除指征,先行控制黄疸。于5 月5 日行“经皮肝穿刺胆道支架植入术+外引流术”,术中可见:肝门部胆管梗阻,侵犯肝脏右前及右后分支,其中右后支2 支分支起始部均明显狭窄,肝左叶胆管未见显影,梗阻范围约2.5 cm,遂于狭窄处分别植入2 枚支架,规格分别为8 mm×60 mm 和8 mm×40 mm 及胆道外引流管1 根。 术后10 d 复查AST 31.9 IU/L,ALT 31.2 IU/L,TBIL 101.9 μmol/L,DBIL 89.4 μmol/L, 肝功能及黄疸症状较前明显好转。 5 月16 日行 “经皮肝穿刺活组织检查术”,病理示:HE 常规考虑ICC,免疫组化标记:CDX2(-),CEA(-),CK7(+),CK18(+),CK19(+),CK20(-),CKAE1/AE3(+),GLypican-3(+),Hepatocyte(-),Ki-67(-),P53(-)。 基因检测结果显示:EGFR、KRAS、NRAS、KIT、PDGFRA、ALK、ROS1、MET、KIT、BRAF、CD274、HER-2、FGFR2-3、NTRK1-3、RET 均为阴性,PALB2 为阳性(c.751C>T p.Q251*,杂合型,致病性变异;c.2058G>T p.R686S, 杂合型, 临床意义不明变异),BRCA1 为阳性(c.1763_1764delinesAA p.S588K,杂合型,临床意义不明变异)。考虑患者黄疸指标仍高于正常水平,未予全身治疗。
6 月10 日CT 增强提示肝左叶病灶较前进展, 肝功能Child-Pugh 评分A 级,CA125、CA19-9 较前升高,排除手术禁忌,于6 月12 日行TACE,造影示肝左叶可见巨块状肿瘤染色影,病灶边缘血供尚可,病灶中心乏血供,主要由肝左动脉分支供血,具体用药为吉西他滨1 g,罂粟乙碘油5 mL,粒径100~300 μm 的DC beads 载药微球0.5 g(载有表柔比星80 mg)。 术后予以保肝、退黄等对症处理。 根据患者目前病情,建议患者联合全身治疗,患者表示拒绝。
7 月26 日复查CT 提示患者肝左叶病灶较前增大,出现右侧少量胸腔积液,AFP、CA19-9 及CA125 均较前明显升高,考虑TACE 治疗效果不佳。 根据基因检测结果,开始服用奥拉帕利400 mg 2 次/d。 9 月16 日(用药后50 d)复查MR示肝左叶病灶较前缩小,右侧胸腔积液吸收,肝功能及AFP正常,CA19-9、CA125 较前下降。 11 月4 日(用药后100 d)复查MR 示肝左叶病灶较前继续缩小,CA19-9、CA125 较前下降。 12 月9 日(用药后130 d)复查MR 示肝左叶病灶较前继续缩小,CA19-9、CA125 较前下降。 服用奥拉帕利50、100 和130 d 复查,可见肝左叶,病灶最长径由11.8 cm 缩小到8.0 cm,(图1)疗效评价为PR,右侧胸腔积液吸收,AFP 降至正常范围,CA125、CA19-9 较前明显下降,肝功能持续A 级,患者体力状况较前好转,无任何不良反应发生。 (见表1)
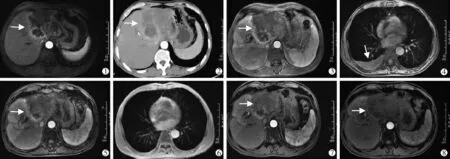
图1 (①~⑧)用药前、后随图像
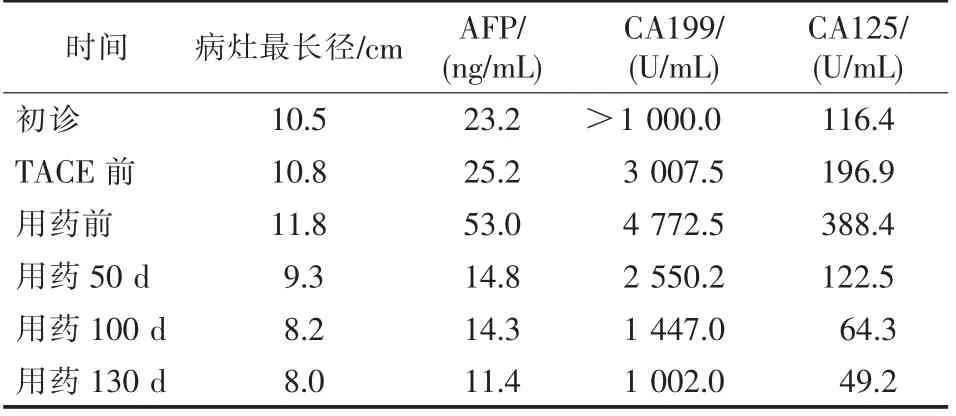
表1 本例患者疗效主要指标变化
2 讨论
ICC 是指发生在包括二级胆管在内的末梢侧原发性胆管细胞癌,发病率占原发性肝癌5%~10%[1]。 NCCN 指南对于不可切除的晚期ICC 患者推荐以顺铂或吉西他滨为主的全身化疗作为一线治疗,而对于一线化疗失败的患者则没有二线的系统治疗。 近年来,随着对ICC 分子病理机制研究的深入,目前有多种分子靶向药物正处于临床研究阶段,部分药物已 在晚期ICC 中取得进展[2]。
奥拉帕利Olaparib 是一种口服的聚二磷酸腺苷核糖聚合酶(poly ADP- ribose polymerase, PARP)抑制药,通过抑制PARP 的DNA 修复功能, 导致细胞动态平衡破坏和细胞死亡[3]。 BRCA(breast cancer susceptibility gene)是一种乳腺癌易 感 基 因, 在DNA 损 伤 修 复 中 起 关 键 作 用[4]。 PALB2(partner and localizer of BRCA2)是BRCA2 的定位协同基因,该基因所编码的蛋白在DNA 发生损伤时, 协同BRCA1、BRCA2 共同维持基因组的稳定性[5]。 体外实验发现,PALB2低 表达 或 缺 失 的 细 胞 对 奥 拉 帕 利 敏 感[6]。 Cheng 等[7]报 道1 例BRCA2 突变的难治性ICC 患者接受奥拉帕利单药治疗,随访11 个月,疗效评价为PR,肿瘤指标及生存质量均有好转。 本例患者PALB2 基因第251 位编码子的谷氨酰胺变为终止密码子, 预测分析Q251*变异可引起无义介导的mRNA 降解,导致蛋白表达缺失,为致病性变异。本例患者肝脏肿瘤体积较大, 且伴淋巴结转移, 在拒绝全身化疗和TACE 治疗效果不佳的情况下, 通过口服奥拉帕利靶向治疗,取得了较好的治疗效果。 治疗后连续检查示肝脏肿瘤进行性缩小,胸腔积液吸收,肿瘤标志物明显下降,患者体重上升,生活质量改善。 奥拉帕利主要的不良反应包括乏力、恶心、呕吐、贫血、食欲减退等,大部分为1 级或2级,可以耐受。 奥拉帕利较罕见的不良反应是骨髓增生异常综合征和急性髓系白血病,发生率为0.86%~2.20%[8]。本例患者服用奥拉帕利130 d 内无任何不良反应发生,且体力状况较前有好转,考虑可能与肝功能好转、肿瘤负荷减轻等因素有关。
TACE 是目前治疗中晚期原发性肝癌的主要方法,对于ICC 也有相关报道其疗效[9]。 然而,大多数ICC 瘤体均为乏血供,传统碘油栓塞治疗效果一般,理论上使用载药微球进行栓塞可提高疗效。 但在载药微球的粒径选择存在争议,有研究认为微球的粒径越小,微球越可以达到更多的远端微小分支血管进行栓塞,避免缺氧诱导形成侧支循环,进而获得更加疗效[10]。 但粒径过小(<50 μm)时则有微球通过肝窦及毛细血管造成异位栓塞,加重肝脏损伤的风险。 故本例患者TACE 治疗时选择粒径100~300 μm 的载药微球是兼顾疗效和安全的考虑。 曾有报道肝动脉灌注(hepatic arterial infusion,HAI)对于晚期ICC 有一定疗效[11]。 结合患者体力状况及肝功能情况,本例患者局部灌注了吉西他滨和表柔比星,其效果欠佳考虑与文献报道化疗方案有差异、治疗次数及未联合全身化疗有关。而其他的局部治疗手段,包括热消融、放射性125I 粒子等,对于巨块型ICC 则不适用。
本例患者经奥拉帕利治疗后, 近期内肿瘤控制效果良好,生活质量提高,提示针对晚期ICC,基因检测是有必要的,奥拉帕利可能是有效的分子靶向药物。但是,亦存在不足之处:①患者随访时间短,治疗后仅随访6 月余,仍需继续随访观察肿瘤变化。 ②开设课题招募患者进行临床研究,对比奥拉帕利和化疗或联合局部治疗对晚期ICC 在有效率、无疾病进展生存期、总生存期等方面的差异,为临床治疗方案提供高质量证据。

