药品质量标准管理与执行中存在的问题及对策
姬于婷 段婧婧 刘 佩 叶琳洁 李 霞
陕西省食品药品监督检验研究院,陕西西安 710065
药品质量标准是由国家相关部门制定,在药品检验过程中所应该遵循的标准规范,具有一定的法律效应,是药品生产、供应、使用及管理等多个环节都需要共同遵循的的规范。药品检验标准作为药品监管法规的重要组成部分,更是市场技术监督的核心,是保证药品质量安全的关键,更是广大人民用药安全的重要保障[1-2]。此外,药品检验标准还是各检验机构开展检验工作的依据,能否严格执行科学、完善的药品检验标准,直接关系到职能部门的工作效率,必须严格执行。笔者结合日常工作遇到的实际情况,对药品标准的管理和标准执行中存在的问题,浅谈一些体会,供同仁探讨[3]。
1 药品质量标准管理及执行中存在的问题
1.1 药品质量标准分类繁多,查询、查附效率低
药品质量标准分类繁多,造成查询、查附效率低。原卫生部制定颁布了一系列的标准[4],其中《卫生部药品标准》包括中药成方制剂(1~20 册),藏药、蒙药、维吾尔药分册,中药材第1 册,化学药品及制剂第1 册、抗生素药品第1 册、生化药品第1 册和新药转正标准(第1~15 册)。《国家药品标准》 包括新药转正标准(16~104 册,共88 册)[5]、化学药品地方标准上升国家标准第1~16 册。国家药品标准还包括《进口药品复核标准汇编》(共10 册)、《国家中成药标准汇编》中成药地方标准上升国家标准(第1~13 册)、《儿茶等43种进口药材质量标准》等。
药品质量标准数量多,检验机构很难及时收集到现行有效的药品质量标准[6],无法对药品安全性、有效性实施有效的控制。仅《中华人民共和国药典》(简称《中国药典》)2015年版中收载的药品品种就有5680 个,部颁标准与局颁标准收载药品品种12 000 余个,各类不公开发行的散页单行标准中,注册标准就达40 000 余个,补充检验方法标准200 余个[7-10]。国家药品标准还包括了大量的颁布件、修订件、补充批件等。此外,国家食品药品监督管理局也颁布了许多试行、转正标准,药典委员会也会在颁布的卫典业发及药典业发文件附标准等。
质量标准版本更新多,造成标准的管理使用困难。如《中国药典》版本较多,据统计,自1953年药典委员会颁布《中国药典》以来,我国共颁布了10 版,2020年12月新版的《中国药典》 也于2020年12月30日实施,多数新版本执行后,旧版本并未完全作废,加上每年有大量药品标准的修订、增补和升级,给药检机构的标准检索、使用带来较大困难。
1.2 药品标准执行中存在的问题
1.2.1 药品标准执行中的“一品双标” 2010年6月17日,国家药监局发布的关于实施《中国药典》2010年版有关事宜的公告(2010年第43 号)[11]明确指出:如果是中国药典中收载的品种,自执行之日起,原收载于历版成册标准中的相同品种药品标准同时废止。对于药品注册标准中收载的,如果检验项目多于中国药典中规定,或质量指标要求高于中国药典的,在执行中国药典的同时,还应一并执行原标准的相应项目。
但在执行43 号公告的过程中,检验机构不能直接确认标准的执行情况,只能通过电话向相应的生产企业质量部了解并确定该品种的质量标准实施情况,再由企业提供相关资料,以保证检验机构能正确、有效地执行“药典与注册标准”双标准的相应指标项目。如河北某企业生产的盐酸氨溴索口服溶液,其药品名称与药典一致、规格不同,原本认为应按《中国药典》2015年版相关品种执行即可,但是医院在抽样过程中核实药品说明书信息时发现,该药品标准并不仅仅执行药典标准,说明书中执行标准项显示为执行标准:《中国药典》2015年版二部[12]及国家食品药品监督管理局标准YBH02662009,标准管理员与生产厂家联系后,了解到该品种[性状]、[检查]项下的“pH 值”和“有关物质”仍执行YBH02332009,其他项目执行《中国药典》2015年版二部。再如江苏某企业生产的盐酸氨溴索口服溶液其名称、规格与药典均一致,通过说明书显示的标准项执行《中国药典》2015年版二部及国家食品药品监督管理局标准YBH01632015 与企业联系后,了解到该品种有关物质及苯甲酸钠项执行YBH01632015,其余项目执行《中国药典》2015年版二部。
1.2.2 药品标准执行中的“一品多标” 药品质量标准的执行中,有一些品种存在一个品种多个执行标准的情况。以注射用长春西汀的单行标准为例,仅在日常抽检中收集、索取到该药品的标准就达30 余份之多,选取其中几个代表性标准对其具体内容进行比较,发现相同的药品,其标准号、性状、鉴别方法、检查项、含量测定方法均有不同(表1),造成药品检测结果不唯一。
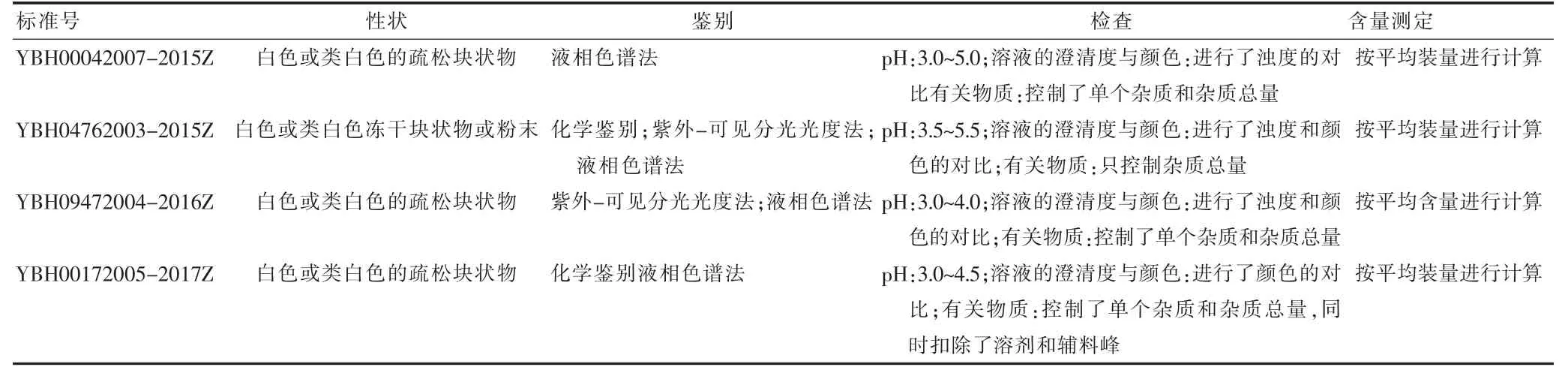
表1 注射用长春西汀多个标准的比较
1.2.3 药品试行标准转正延时 《药品注册管理办法》明确规定生产企业应在实行标准试行期满前3 个月提出转正申请。一些试行多年的药品标准,早已经超过法定试行标准的使用年限,但仍被使用着。例如:在日常收检过程中,发现消渴降糖片的试行标准规定从2005年2月6日起试行,试行期为2年至今仍没有转正,经当地药监局再次注册,现继续沿用此试行标准。对于此种情况的出现可能有两个原因,①有些制药企业存在品种转让,可能会对药品试行标准的申报不及时;②有关审批单位未能及时的对试行转正的标准进行审批[13]。如果试行标准不能及时转正,将导致同一品种存在很多不同标准,无法执行更有效的药品标准。
1.2.4 中药材及中药饮片标准不统一 《药品管理法》中提出:只有符合“地区性”和“民间习用”2 个主要特点的药材,各省级药品监督管理部门方能制定其质量标准。但由于各省对药材“地方习用”的界定标准不同、各省在制定地方标准时缺乏沟通协调及各省制定标准技术水平的不平衡等因素导致,一种中药材或中药饮片既有国家标准又有地方标准;有的还出现在不同的地方标准上[14],甚至还有同名异物、同物异名的现象。例如《江西省中药材标准》和《湖南省中药材标准》中均定义“安痛藤”源自葡萄科植物毛叶白粉藤的干燥藤茎,但在《江西省中药材标准》中其拉丁名为Cissusassamica(Laws)Craib,而在《湖南省中药材标准》中其拉丁名却是Cassamica var.pilosissima Gagn[15-16],相同药材原植物名称相同,但拉丁名不同,对检测中药材或中药饮片时标准的选用造成了困难。
1.3 药品质量标准查询困难
在抽验工作中,大量药品质量标准为单行标准,或者新药转正标准需要增加生产单位和规格等情况,由于前我国还没有建立一个全面、有效、权威的质量标准查询平台,各地药检机构标准来源多为多级转发,很难确保自建库中能够收录外省企业生产品种的质量标准,需要向外省企业索取批件和质量标准,而检验机构一般只能从抽检样品附上的资料或说明书中获得一些企业销售部门等联系方式,但是销售部门对于相关质量标准情况了解较少,必须要继续与相关质量管理部门联系。取得联系后,大多数企业仍心存戒备,很难主动提供质量标准,有的更需要标准管理人员不断电话催促,索要困难、极其费时,严重耽误检验周期[17]。而进口药品质量标准多年未发行合订本,公开不及时,也致使查询困难。
2 科学管理药品质量标准的建议
2.1 对各类药品质量标准系统化管理
目前常规的药品质量标准管理主要分为常规标准管理和电子标准管理。
2.1.1 常规标准管理流程化 通过完善标准收集,标准归纳,受控编号,标准发放,标准查新、修订或勘误及标准回收的“六步”工作法,实现对常规标准的流程化、规范化、闭环式管理。
第1 步:标准收集。定期对标准进行查新,列出需要更新的标准购买清单,接收新标准后标记更新时间。第2 步:标准归纳。按照科室业务职能,对收集、购买的标准进行分类,方便管理和日后的查询。第3 步:受控编号。对新入档的标准进行编号,并加盖受控章,形成唯一性标识,便于查询。第4 步:标准发放。对成册的标准,可在受控编号后发放原件;对于散页的标准,需将原件受控后存档,发放复印件。第5 步:标准查新、修订或勘误。定期对入档的标准进行查新、修订或勘误,确保所用标准的有效性和准确性。第6 步:标准回收。关注标准的废止情况,及时收回已废止标准,并加盖作废章进行标记。对仍有参考价值的标准,可加盖过期版本参考使用章进行标记。
2.1.2 电子标准管理系统化 首先建立标准目录查询表,方便对标准进行查附。药品目录查询表主要有成册标准目录查询表和单行标准目录查询表。查询内容主要包括:药品名称、规格、出处、页码、标准编号、标准修订等。将修订、添加的内容实时更新、补充、修订,对过期、需修订内容进行标记,以作参考,并添加新修订后的标准号和新标准的实施日期等。如:在药品标准目录查询表中查询托吡酯片,即可查到标准已由新药转正标准WS-(X-070)-2006Z 修订为单行标准国家食品药品监督管理总局国家药品标准WS1-(X-070)-2006Z-2018,新标准的实施日期为2018年11月22日。实时更新标准查询目录可方便快速查附质量标准,并保证其现行有效。收到新的修订标准后,在相应的标准目录上进行登记,并将其扫描为电子版,放入相应文件夹(可根据接收时间、标准种类等要素建立文件夹)中分类保存,方便查找使用。
2.2 对执行药品标准中存在问题的建议
2.2.1 规范、统一相同品种的药品质量标准 对已颁布质量标准的药品,通过国家药品监督抽验、注册复核等工作,排查梳理同一品种不同标准的药品清单,由国家统一规范各个品种药品的质量标准,确保不同厂家、相同品种的药品能够获得公正、有效的评价,最大限度的保证药品的安全性、有效性。对未颁布的药品质量标准,希望相关部门在注册、审批、发放程序上做到统一化、标准化,逐步达到同药同质量。
2.2.2 重视药品试行标准审批及转正的时效性 按照现行的药品管理法规定,药品试行标准执行期到达后,应及时完成转正工作,尽快确认标准的适用性。目前,因对药品试行标准的转正暂时没有强制性的规定,许多试行标准未及时转正,可能会造成生产的药品存在安全隐患。建议主管部门制定试行标准转正的强制性管理办法,规范药品标准审批流程、明确监管职责、细化审查要求,及时对试行标准进行转正审批。进一步强化依法行政,全面清理、整顿历史遗留的试行标准,使药品生产企业和检验机构执行更有效的药品标准。
2.2.3 完善中药材及中药饮片的质量标准管理 一方面通过加强法规体系建设,完善管理办法,使“民间习用”有更清晰的界定范围;另一方面要制定统一的工作机制和技术要求,加快地方中药材及中药饮片标准的整顿、清理,剔除那些与国家质量标准相同的品种,完善中药材及中药饮片的国家质量标准。此外,要进一步明确各省地方标准的适用范围,使各省间标准能够实现充分衔接。目前,已有部分地方开展了此项工作。2019年11月25日,新疆维吾尔自治区药品监督管理局对拟废止《新疆维吾尔自治区中药维吾尔药饮片炮制规范》(2010年版)中收载的打泡粉制的炒阿育魏果等11 种中药维吾尔药饮片打粉炮制规范的公示。而在此之前新疆维吾尔自治区药监局已经废止了与《中国药典》(2015年版)收载重复的71 个品种113 个中药维吾尔药饮片炮制规范[18]。
2.3 建立健全、权威的国家药品标准信息查询平台
当前飞速发展的网络信息化技术,为建立统一、权威的国家药品标准信息平台提供了技术支持。基于药品质量标准的特殊性,可利用食品伙伴网、国家药品补充检验方法和检验项目管理系统等对药品质量标准信息进行整合,按省份、标准种类(如注册标准、修订标准、进口标准)等方式分类,对质量标准电子版时时更新、上传。对各地检验机构、生产厂家分级设置管理权限,使其在相应权限下,能够第一时间查询、获取国家药品标准的各项更新动态及信息,保证相关部门顺利、快速的获得完整的、现行有效的药品质量标准,并能够及时对相关标准进行有效性确认[19-22]。

