新型冠状病毒突变株对传染性和疾病进展及免疫保护影响的研究进展①
何晓波 虞淦军 吴艳峰
(海军军医大学免疫学研究所暨医学免疫学国家重点实验室,上海200433)
自2019年末,新型冠状病毒引发的疫情迅速波及全球,是20世纪以来有报道的第3种人高致病性冠状病毒。此次疫情病原体被正式确认为一种新型冠状病毒,国际病毒分类学委员会命名其为SARS-CoV-2(severe acute respiratory syndrome coro‐navirus 2)[1],世界卫生组织命名该病毒引发的肺炎为COVID-19(coronavirus disease-19)。截至目前,国内疫情在良好的防控措施下已得到有效控制,然而国外疫情依旧严峻,全球累计病例已超过1亿,死亡人数超200万[2]。疫情初期,各国即开展了针对SARS-CoV-2基因数据的分析及相应抗体、疫苗的研发工作,目前国内外均有新冠疫苗相继紧急获批使用。然而随着SARS-CoV-2在人群中不断传播,病毒基因逐渐发生突变积累并进而发展为不同的突变株,这对疫情防控提出了新的挑战。首先,突变株可能伴随关键位点的突变从而产生更强的传染力或致病性;其次,部分位点的突变可能降低病毒与已有特异性抗体的结合力,对疾病的治疗带来负面影响;再次,突变可能影响到现有疫苗的免疫保护作用和范围,使病毒感染的预防面临更加严峻的形势。为了有效应对病毒突变带来的新的潜在风险,研究人员通过GISAID基因序列数据库[3-4]共享全球地区发现的SARS-CoV-2突变株基因序列,已鉴定若干突变的位点及突变频率。现阶段,及时掌握SARS-CoV-2突变株的发展变化,研究其在传染致病、诊疗预防等方面的影响,将有利于各国在疫情防控中实施更具预见性和有效性的防治措施。
1 SARS-CoV-2的基因组结构及生物学特性
SARS-CoV-2为新发现的β属冠状病毒,直径60~140 nm,具有包膜及单链、正义的RNA基因组[5]。SARS-CoV-2基因组结构如图1所示,其两侧存在5'和3'端非翻译区,具有RNA合成所需的二级结构[6];5'端起依次包括2个较长的开放性阅读框(open reading frames,ORFs)ORF1a和ORF1b,主要编码16种非结构蛋白(non-structural protein,nsp),分别在病毒基因转录、复制、多聚蛋白修饰等过程中发挥重要作用;剩余接近3'端的基因组为编码结构蛋白和其他辅助蛋白的ORFs。编码的结构蛋白主要包括4种,刺突蛋白(spike protein,S蛋白)为一类跨膜蛋白,能与宿主细胞受体结合并介导感染,含有主要的抗原表位;膜糖蛋白(membrane protein,M蛋白)最为丰富,在病毒的形态发生、维持中发挥作用;小包膜蛋白(envelope glycoprotein,E蛋白)在病毒复制中具有整合、释放等功能,与病毒致病机制相关;核衣壳蛋白(nucleocapsid protein,N蛋白)是核衣壳中的唯一蛋白,在病毒衣壳化中具有重要作用[7]。辅助蛋白的具体功能仍有待进一步研究阐述,但目前认为其高度可变,在病毒感染及致病中发挥一定的功能[8]。
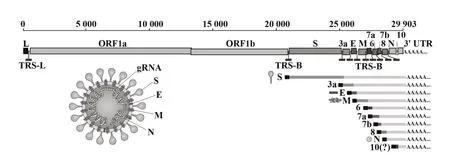
图1 SARS-CoV-2的基因组结构[6]Fig.1 Genome structure of SARS-CoV-2[6]
SARS-CoV-2进入人体后通过S蛋白受体结合区(receptor-binding domain,RBD)特异性识别并结合人血管紧张素转化酶2受体(human angiotensin converting enzyme 2,hACE2),从 而 入 侵 宿 主 细胞[9-10]。随着对SARS-CoV-2入侵机制的深入研究,研究者陆续发现了一系列新的潜在宿主细胞受体,例如神经纤毛蛋白1(neuropilin-1,NRP1)、去唾液酸糖蛋白受体1(asialoglycoprotein receptor 1,ASGR1)和环状跨膜蛋白1(kringle containing transmembrane protein 1,KREMEN1)等[11-13]。进入宿主细胞后,病毒RNA可作为信使RNA(messenger RNA,mRNA)利用宿主蛋白合成系统产生自身所需的各类蛋白产物,如病毒ORF1a和ORF1b首先翻译产生多聚蛋白pp1a和pp1ab,并通过水解、加工产生16种非结构蛋白(nsp1~nsp16),可分别发挥基因复制校正、降低宿主细胞基因表达等生物功能,并进一步组装形成关键的病毒复制转录复合物,共同完成病毒RNA的大量复制;四种结构蛋白通过宿主细胞内质网和高尔基体途径合成后,与协同产生的病毒RNA组装为完整病毒颗粒,通过胞吐脱离宿主细胞[8,14]。
回顾性研究表明人体感染SARS-CoV-2后主要存在发烧、咳嗽、乏力、呼吸急促等临床症状,胸部影像学检查通常表现为毛玻璃样阴影,大部分患者临床诊断为肺炎,症状较轻且预后良好,部分重症或转为重症的患者可能因严重的呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、多器官功能衰竭、脓毒症休克等并发症而死亡[15-16]。有研究推测,SARS-CoV-2的基本传染数R0可达2.47~2.86,具有较高的传染性,相似于SARS-CoV的2.2~3.6,但其致病性似乎低于另外两种高致病性冠状病毒SARS-CoV和MERS-CoV[17-19]。
2 SARS-CoV-2突变的机制及特点
2.1 SARS-CoV-2的突变机制 SARS-CoV-2作为RNA病毒,本身具有较高突变率,进化速度显著高于其他物种,其发生突变的机制尚未阐明,但目前认为低保真性的RNA依赖的RNA聚合酶(RNAdependent RNA polymerases,RdRps)是RNA病毒高突变率的重要原因之一,此外宿主细胞内多种活性物质可能促进病毒基因的突变,例如APOBEC蛋白酶家族的碱基脱氨作用、作用于RNA的腺苷脱氨酶(adenosine deaminases acting on RNA,ADAR)的腺苷脱氨作用、活性氧化物(ROS)的氧化作用等,以及病毒复制周期中RNA与其他相关基因之间发生同源重组而造成的遗传重组[20-23]。但也有研究表明,冠状病毒中存在一定的基因校对机制用以纠正复制错误,如非结构蛋白nsp14的3'至5'核酸外切酶活性可能是其基因复制的保真性机制之一[24-25]。
SARS-CoV-2在上述机制的共同作用下发生突变,但大部分突变个体可能因突变的不利影响而被自然选择消除,值得注意的是,随着疫情的长期持续,尤其在国外感染病例不断增多、疫情没有得到有效控制的情况下,SARS-CoV-2与感染人群的长期共存可能导致突变不断积累,在选择作用下迅速产生具有适应性优势的SARS-CoV-2突变毒株,从而造成更大危害。日前,世卫组织已正式发布了4株主要的突变毒株,提示SARS-CoV-2突变带来潜在风险的可能性。
2.2 SARS-CoV-2相关突变位点 目前,全球已报告多个SARS-CoV-2突变株在不同基因位点上发生突变,部分非同义突变因发生频率高或具有潜在的生物学影响而受到广泛关注。此外,对4254个SARS-CoV-2基因序列的分析表明,4种结构蛋白中S、N蛋白基因更易发生突变,其突变频率明显高于E、M蛋白[26]。其中,S蛋白既是介导入侵的重要组分,又是抗体作用的主要靶标,因此S蛋白突变是目前最重要的监测对象,如近期报告的S蛋白N501Y和N439K突变赋予病毒与hACE2受体更强的亲和力,且N439K突变能造成对部分中和性单克隆抗体的抗性[27-28]。表1为部分SARS-CoV-2的非同义高频突变及热点突变汇总[29-33]。
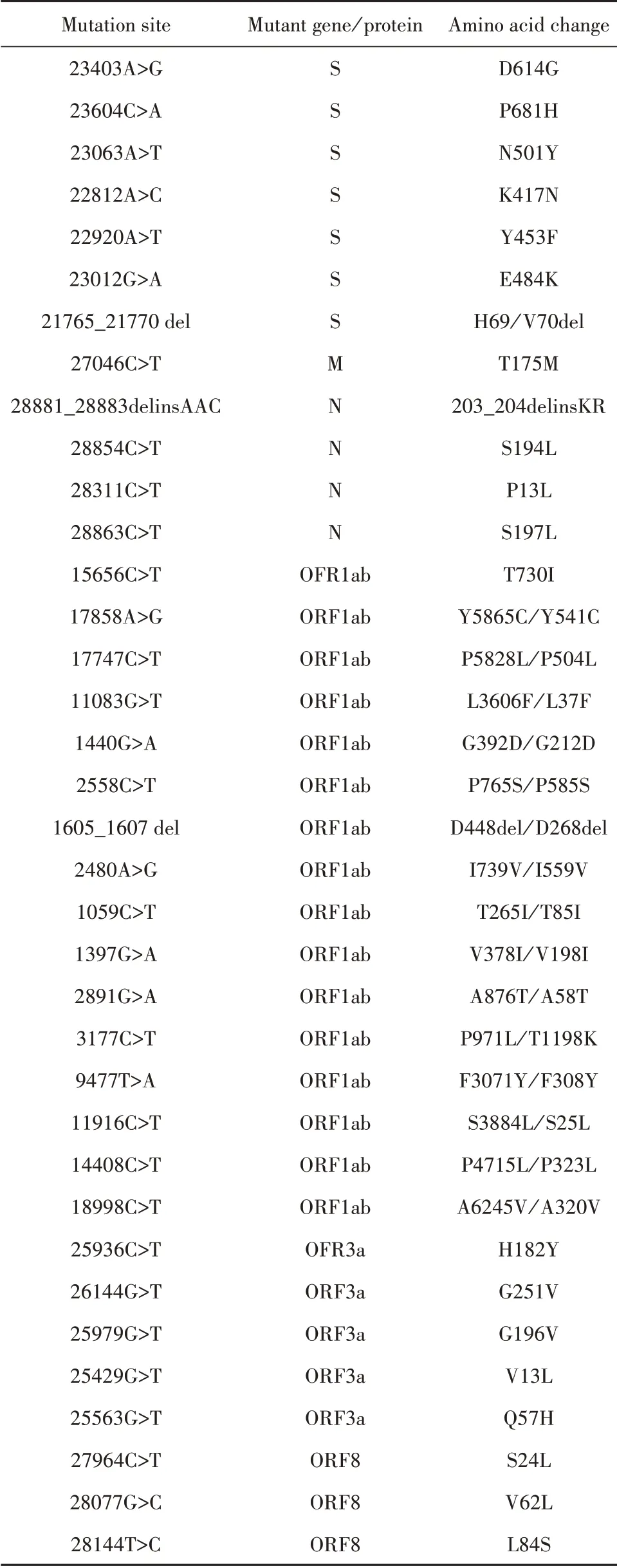
表1 SARS-CoV-2相关突变位点Tab.1 Mutation sites of SARS-CoV-2
3 目前已报道的重要SARS-CoV-2突变株
3.1 D614G突变株 2020年2月底,研究者首次观察到SARS-CoV-2中出现23403位的A核苷酸转变为G核苷酸的非同义突变,该突变编码病毒的S蛋白D614G突变,且该突变常伴随C241T、C3037T、C14408T基因突变[34-35]。至2020年6月,包含该突变的SARS-CoV-2突变株频率逐渐上升,由最初的欧洲地区局部流行,迅速发展为全球传播的SARSCoV-2主要类型。
D614G突变株的出现频率在全球各地区迅速提高的模式,提示该突变可能赋予了病毒更强的感染力,从而促使病毒更容易在人群中传播。YURK‐OVETSKIY等[36]研究表明携带D614G的假病毒对稳定表达ACE2受体的细胞的感染力是D614的3~9倍,且不局限于hACE2,证实D614G的突变能提高病毒的体外感染力,其他研究结果也支持这一结论[35,37]。但D614G突变并不影响S蛋白的合成、加工,以及与hACE2受体的结合、亲和力,进一步的结构研究显示,D614G突变通过改变S蛋白构象,在原始D614全封闭、单开放构象的基础上,进一步形成更为开放的双开放和三开放构象,这种更高开放比例的构象提高了S蛋白与hACE2受体结合的可能性[36]。此外,研究发现D614G突变可能促进了患者体内更高的病毒载量。VOLZ等[38]通过病毒样本PCR循环阈值(Ct)的检测,发现D614G突变样本比原始毒株具有更低的循环阈值,KORBER等[35]的研究同样发现D614G突变与患者上呼吸道高水平的病毒核酸相关,两者结果均提示了D614G突变与高病毒载量间的相关性,但进一步的临床数据分析并未显示D614G突变改变了患者疾病的严重程度。D614G突变编码的病毒S蛋白是目前治疗性抗体、疫苗的重要靶点,多项研究评估了不同种类单克隆抗体对D614G突变病毒和D614病毒的中和效应,结果表明两者间并未有明显差异,部分抗体对D614G突变体甚至表现出高于D614的中和作用,在血清抗体中和实验中也得到了类似的结果[39-41]。因此,D614G突变似乎并不会对治疗性抗体和疫苗的免疫保护产生负面影响。
3.2 水貂相关突变株 2020年4月,研究者首次在荷兰养殖水貂中观察到SARS-CoV-2感染[42],随后丹麦国家公共卫生研究所报告SARS-CoV-2在当地养殖水貂中广泛传播后发生突变,并进一步传染给人类[43],引发围绕水貂养殖场的日德兰半岛地区新型突变株疫情流行,丹麦食品卫生部门于11月开展对养殖场水貂的扑杀工作[44]。
HAMMER等[29]通过序列比对分析发现,突变株与武汉发现的毒株相比存在9个非同义突变,与欧洲20B分支毒株对比存在T730I、Y453F、H182Y 3种新突变,并推测病毒T730I突变最初产生于人体中,进一步传染水貂后产生适应性的Y453F和H182Y突变。其他研究表明,水貂相关突变株中还存在S蛋白相关的I692V、S1147L和HV69-70del突变,其中Y453F位于高度保守的S蛋白受体结合基序中,使其增加了与ACE2受体的亲和力,可能是促进该病毒感染人体的原因之一[43];KEMP等[45]通过假病毒结合实验表明具有HV69-70del突变的假病毒比野生型具有更高的传染性。该类突变株在水貂养殖场与周围人类社区中迅速传播,但未在全球发生大规模流行,其传播可能与职业接触及养殖场位置相关,一般人感染的可能性较低,临床数据也未显示该突变株引起患者疾病严重程度的改变[46]。但血清抗体中和实验提示,水貂突变株对中和抗体存在较低敏感性,因而对疫苗或抗体介导的免疫保护可能具有潜在影响,但仍需进一步研究确定[43]。
3.3 B.1.1.7(501Y.V1)突变株 B.1.1.7突变株最早于英国英格兰东南部地区被采集发现,随着相关病例数的不断上升,迅速流行,直至目前全球多地已报告了该突变株相关病例。B.1.1.7突变株序列上具有17个特殊突变,包括14个非同义突变与3个缺失突变,其中N501Y、P681H、HV69-70del突变位于S蛋白并初步显示出潜在的重要生物学意义[32]。STARR等[27]评估了携带不同突变的S蛋白片段与ACE2受体间的结合作用,结果显示N501Y突变的S蛋白片段展现出显著增强的ACE2受体亲和力,提示该突变可能促进了突变株的感染能力。P681H突变的具体影响尚不明确,但其位置毗邻Furin蛋白酶切位点,目前认为S蛋白能在Furin蛋白酶切作用下形成更开放的构象,从而提高与ACE2受体结合的亲和力[47-48],因此相邻的P681H突变可能影响病毒结合并入侵细胞,但仍需进一步研究。HV69-70del如上3.2中所述,可能增强了病毒传染力[45]。B.1.1.7突变株总体上显示出更强的传染性,DAVIES等[49]根据COVID-19患者住院人数、ICU床位覆盖率、病死率等因素建立数学预测模型,推断B.1.1.7突变株的传播能力比其他毒株高56%,其他研究通过SGTF PCR检测分析同样证实该突变株具有更强传播能力[50]。此外,一项英国伯明翰大学公布的研究中,研究者利用TaqPath RT-QPCR对641份病毒样品进行检测,发现B.1.1.7突变株感染患者的样本中具有更高的病毒载量[51],另一项研究针对英格兰地区SARS-CoV-2感染病例进行数据分析,结果首次证明B.1.1.7突变株造成了更高的患者病死率,这些研究在一定程度上提示了突变株可能存在增强的毒力[52]。
3.4 B.1.351(501Y.V2)突变株 南非地区于2020年7月和10月爆发两次疫情高峰,研究人员对南非3月至11月收集的2589个SARS-CoV-2病毒样本进行基因分析,鉴定了一株新的SARS-CoV-2突变体——B.1.351(501Y.V2),并确定为第2次疫情高峰的主要流行株[33]。该突变株在S蛋白中存在除D614G突变以外另外8个非同义突变,其中K417N、E484K和N501Y突变受到广泛关注,三者均位于受体结合域,而E484K、N501Y位于更关键的受体结合基序中。N501Y突变已在B.1.1.7突变株中得到鉴定,如上3.3中所述。在STARR等[27]的评估中,K417N、E484K突变均一定程度上增强了与ACE2受体结合的亲和力,K417N突变还可能导致部分单克隆抗体的失效[53]。也有研究显示E484K突变极大地降低了血清中和抗体的作用效果,而K417N和N501Y突变则无明显影响[54-55]。WIBMER等[56]利用假型慢病毒中和实验评估了510Y.V2的假病毒对血清中和抗体的影响,结果显示48%的中和抗体未检测到中和活性,在仅含RBD区突变(K417N、E484K、N501Y)的假病毒中有27%的中和抗体未检测到中和活性,这一结果提示510Y.V2突变株对康复患者依旧存在再感染风险,且可能对目前基于S蛋白设计的疫苗预防效果存在影响。
4 SARS-CoV-2突变株的影响与意义
4.1 突变对SARS-CoV-2特性的影响 目前,研究人员在D614G、B.1.1.7、B.1.351、水貂突变株中均鉴定出有可能增强其与宿主细胞ACE2受体的结合或提高亲和力的突变,这与突变株迅速流行的特性一致,提示突变可能提高SARS-CoV-2的传染性。其次,部分研究表明相关突变株在体外或体内的病毒载量要高于原始毒株,且突变株造成患者病死率的升高,因而突变可能进一步提高了SARS-CoV-2的致病性[52]。此外,包含突变株部分突变或突变组合的假病毒在血清中和实验中表现出对康复患者血浆中和抗体敏感性的下降[57-58],已知人体感染病毒后能激发CD8+T细胞介导的细胞免疫[59],而对747个SARS-CoV-2病毒样本的深度测序表明,病毒出现若干MHCⅠ限制性CD8+T细胞表位的非同义突变,而这些突变能减弱表位与MHCⅠ分子的结合并降低细胞毒性T淋巴细胞应答[60],表明突变从体液免疫和细胞免疫多方面促进SARS-CoV-2对机体免疫的逃逸能力。而水貂相关突变株的出现则提示SARS-CoV-2在非人类宿主体内发生适应性突变并扩大传播的可能性,使新冠疫情面临更难控制的潜在风险,表2为目前已报道的主要SARS-CoV-2突变株情况。
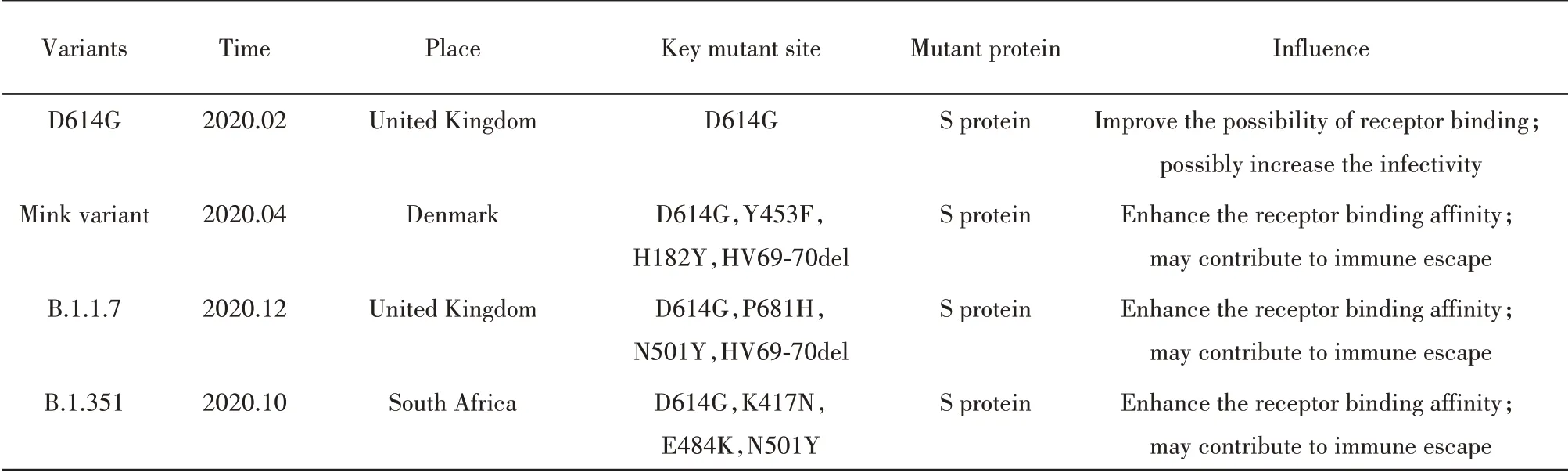
表2 已报道的主要SARS-CoV-2突变株情况Tab.2 Major reported SARS-CoV-2 variants
4.2 SARS-CoV-2突变株对患者诊断和治疗的影响 COVID-19患者的诊断方法主要包括核酸检测和抗体检测。核酸检测是利用实时荧光RT-PCR进行病毒基因检测,是目前检测的金标准,抗体检测则因患者在感染早期尚未产生特异性抗体而出现假阴性结果,因此常作为辅助诊断[61]。虽然核酸检测的引物序列大多来源于病毒基因组不同位置的保守序列,但SARS-CoV-2发生的大量突变依然可能影响PCR分析的敏感性和特异性,多个研究报告表明不同的基因突变如E蛋白基因C26340T、N蛋白基因C29200T与C29200A影响了PCR检测的敏感性[62-64],因此针对不同基因区域进行多靶标PCR检测对COVID-19的诊断显得十分必要。
特异性抗体是治疗SARS-CoV-2的重要药物之一,然而病毒基因突变可能导致抗原蛋白结构变化,从而影响抗体的疗效。STARR等[65]的一项前瞻性研究绘制了逃避治疗性抗体的SARS-CoV-2突变图谱,其中E406W突变完全逃脱了Regeneron公司的REGN-COV2(REGN10933和REGN10987)抗体,部分关键突变如K417N、Y453F可能导致对抗体的逃脱[53,66],其他研究也进一步证实部分突变株对REGN-COV2等治疗性抗体存在不同程度的抗性[57,67]。针对突变株对抗体治疗的漏逸能力,抗体联合疗法或研发针对相对保守抗原的特异性抗体或许是有效的解决途径。
4.3 SARS-CoV-2突变株对预防性疫苗的影响 目前全球紧急获批使用的新冠疫苗包括我国的国药集团中国生物和科兴中维的灭活疫苗BBIBP-CorV、美国辉瑞公司的mRNA疫苗mRNA-1273以及Bio‐tech公司的mRNA疫苗BNT162b2。SARS-CoV-2突变株的出现不仅引发研究者对其传染性和致病性变化的关注,同时相关蛋白的突变是否对已获批的新冠疫苗的有效性产生影响同样引起研究者的高度关注。SHI等[68]最新的预印本研究结果显示,20例参与者接种BNT162b2疫苗免疫产生的血清,对携带B.1.1.7、B.1.351突变株共有突变N501Y的病毒和未携带突变的N501病毒具有相似的中和活性。MUIK等[69]的研究结果同样显示注射BNT162b2疫苗产生的免疫血清对武汉参考株和携带B.1.1.7S突变的假病毒具有相同的中和效力。WANG等[70]同时对20例mRNA-1273、BNT162b2疫苗接种者接种后第八周的血清进行检测分析,结果发现对包含K417N、E484K、N501Y三突变的假病毒中和能力降低1~3倍,从免疫血清中分离的多个单克隆抗体表现出对E484K、K417N、N501Y突变不同程度的中和活性降低。高福团队最新的研究报告了B.1.351突变株对BBIBP-CorV灭活疫苗的影响,结果表明疫苗诱导的血清中和抗体对B.1.351突变株的50%中和效价为70.9,相比对照组的110与107略有降低,但依然有效[71]。这些结果初步表明BBIBP-CorV灭活疫苗对突变株仍具有明显的免疫保护效应,但也提示SARS-CoV-2突变的不断积累可能带来潜在的免疫逃逸的风险。
5 小结
SARS-CoV-2在从发现至今的传播中已出现大量突变的积累,其中,非同义突变或得益于自身校对机制、或归因于不利影响而被自然选择去除;一部分同义突变未发现对病毒的生物学特性产生影响;少部分突变具有适应性优势而积累,逐步发展为新的突变株。尽管大部分突变未观察到其所导致的明确的病毒传染性和致病性的增强,但多个实验提示一些突变的确存在增强病毒传染性的风险,而尚无明确证据证实致病性的增强。类似水貂突变株的出现表明SARS-CoV-2可以在其他动物宿主中发生适应性突变并复制传播,提示应当警惕病毒通过其他动物宿主再次传染人类的潜在风险。此外,突变可能直接影响核酸检测的准确性、敏感性,进而影响患者的临床诊断;或直接改变病毒的抗原特性,从而影响到预防性疫苗与治疗性抗体的防治效果。虽然多项研究表明已获批使用的疫苗在突变株中依旧存在明确的免疫保护效应,但也存在一定程度的免疫逃避,因此实时监测、分析病毒突变并及时纳入疫苗研发优化策略,针对突变设计出相对更为“广谱”的疫苗显得尤为重要。总而言之,病毒基因突变可能改变病毒的生物学特性,从而影响已有的诊断、治疗和预防,对相关突变进行监测和分析有助于掌握疫情发展趋势,及时作出更具预见性和有效性的防控措施。

