LncRNA H19、P21在上皮性卵巢癌中的表达及其临床意义①
赖慧超 肖婷婷 刘剑英 黄雪梅 徐敏娟
(赣州市人民医院妇科,赣州341000)
上皮性卵巢癌是女性生殖系统常见恶性肿瘤之一,其发病隐匿且进展迅速,恶性程度相对于其他妇科肿瘤较高[1]。目前临床多采用放化疗及手术等手段进行上皮性卵巢癌治疗,但由于患者就诊时已处于晚期、肿瘤细胞耐药发生等原因,患者5年生存率仍处于较低水平[2]。寻找新的相关肿瘤生物标志物对准确评估上皮性卵巢癌患者病情进展及患者预后有重要意义。长链非编码RNA(long noncoding RNA,LncRNA)是一种稳定存在于机体内的调控因子,在肿瘤进展中与肿瘤细胞的增殖、侵袭和迁移等密切相关。研究表明,LncRNA H19在宫颈癌组织中高表达,可能作为宫颈癌诊断的生物标志物[3]。乳腺癌患者血清中LncRNA H19表达水平也明显升高,与肿瘤细胞增殖、凋亡调控密切相关[4]。此外,已有研究证实LncRNA P21是肿瘤进展中的抑制因子,可用作肿瘤细胞周期调控[5]。有研究发现,乳腺癌组织中LncRNA H19水平上调,可与p53发生拮抗并靶向促进上皮间充质转化过程,促进癌细胞的侵袭和转移[6]。而p53也被证实在头颈部鳞状细胞癌中可靶向上调LncRNA P21表达发挥其抑制肿瘤细胞增殖作用[7]。表明肿瘤进展中LncRNA H19与LncRNA P21表达可能存在一定相关性。另由于LncRNA H19与LncRNA P21在上皮性卵巢癌中研究较少,作用机制尚不明确,本研究通过检测上皮性卵巢癌患者血浆LncRNA H19、P21表达水平,分析二者间相关性及与患者预后关系,初步探讨其在上皮性卵巢癌发生发展中的意义。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2016年7月至2020年7月本院收治的上皮性卵巢癌患者50例作为研究对象(上皮性卵巢癌组),患者年龄29~76岁,平均(53.08±10.32)岁。纳入标准:①根据国际妇产科联合会(International federation of gynecology and obstet‐rics,FIGO)分期标准[8]、世界卫生组织(World health organization,WHO)分级标准[9],经病理切片证实为上皮性卵巢癌;②均需进行手术治疗;③临床资料完整。排除标准:①合并患有其他部位恶性肿瘤患者;②心、肾、肝脏等功能严重不足者;③患有严重精神疾病者;④使用过药物治疗或放疗及化疗者。另选取同期在本院进行手术治疗的上皮性卵巢良性肿瘤患者50例作为良性肿瘤组,包括浆液性囊腺瘤34例、黏液性囊腺瘤16例。良性肿瘤组患者年龄28~74岁,平均(52.84±10.18)岁。上皮性卵巢癌组与良性肿瘤组患者年龄比较差异无统计学意义(P>0.05)。另选择于本院进行健康体检的正常女性50例为对照组。本研究经本院伦理委员会批准同意。1.1.2主要仪器与试剂 实时荧光定量PCR(qRT-PCR)仪(型号:7500)购自美国ABI公司;RNA提取试剂盒(货号:775001)、反转录试剂盒(货号:866001)、qRT-PCR试剂盒(货号:3914001)购自美国Roche公司。
1.2 方法
1.2.1 样本采集 所有研究对象均于入院时抽取空腹静脉血10 ml,室温以3000 r/min离心10 min获取血浆样本,并在−80℃冰箱保存待检。
1.2.2 血浆LncRNA H19、LncRNA P21表达水平检测 采用qRT-PCR法检测血浆LncRNA H19、Lnc-RNA P21表达水平。使用试剂盒进行RNA提取及RNA反转录,所得cDNA在相应反应体系下进行qRT-PCR实验。20 µl反应体系如下:SYBR®Primix Ex TaqTM10 µl,ROX 0.4 µl,cDNA 2 µl,上、下游引物各2 µl,无 酶水3.6 µl。反应 步骤 如下:95℃8 min,1个循环;95℃15 s,62℃38 s,73℃15 s,40个循环,每个样品设3次重复。实验以GAPDH为内参基因,LncRNA H19上游引物:5'-TGATGACGGGTG‐GAGGGGCTA-3',下 游 引 物:5'-TGATGTCGCCCT‐GTCTGCACG-3';LncRNA P21上游引物:5'-GGGTG‐GCTCACTCTTCTGGC-3',下游引物:5'-TGGCCTT‐GCCCGGGCTTGTC-3';GAPDH上游引物:5'-GCACCGTCAAGGCTGAGAAC-3',下游引物:5'-TGGTGAAGACGCCAGTGGA-3'。采用2−∆∆Ct法计算血浆Lnc-RNA H19、LncRNA P21相对表达水平。
1.3 统计学分析 使用SPSS23.0软件对数据进行统计学分析,计数资料用[n(%)]表示,行χ2检验。计量资料以±s表示,两组数据比较行t检验;多组数据比较采用单因素方差分析,总体有差异再行SNK-q检验进行两两比较。采用Pearson法分析上皮性卵巢癌患者血浆LncRNA H19与LncRNA P21表达水平相关性;采用Logistic回归模型进行危险因素分析,采用向后剔除法,行LR检验;采用受试者工作特征(receiver operator characteristic,ROC)曲线分析血浆LncRNA H19与LncRNA P21表达水平对上皮性卵巢癌发生的诊断价值。P<0.05表示数据之间差异有统计学意义。
2.2 上皮性卵巢癌患者血浆LncRNA H19、Lnc-RNA P21表达水平与患者临床病理特征关系 不同年龄、肿瘤直径、病理类型、病理分级及是否更年期患者上皮性卵巢癌患者血浆LncRNA H19、Lnc-RNA P21表达水平比较差异无统计学意义(P>0.05)。Ⅲ~Ⅳ期、有淋巴结转移患者血浆LncRNA H19表达水平高于Ⅰ~Ⅱ期、无淋巴结转移患者,血浆LncRNA P21表达水平低于Ⅰ~Ⅱ期、无淋巴结转移患者(P<0.05),见表2。

表2 上皮性卵巢癌患者血浆LncRNA H19、LncRNA P21表达水平Tab.2 Plasma LncRNA H19 and LncRNA P21 expression levels in patients with epithelial ovarian cancer
2 结果
2.1 三组血浆LncRNA H19、LncRNA P21表达水平比较 如表1所示,上皮性卵巢癌组血浆LncRNA H19表达水平明显高于上皮性卵巢良性肿瘤组和对照组(P<0.05),血浆LncRNA P21表达水平明显低于上皮性卵巢良性肿瘤组和对照组(P<0.05)。
表1 3组血浆LncRNA H19、P21表达水平比较(±s)Tab.1 Comparison of plasma LncRNA H19 and P21 expression levels in 3 groups(±s)
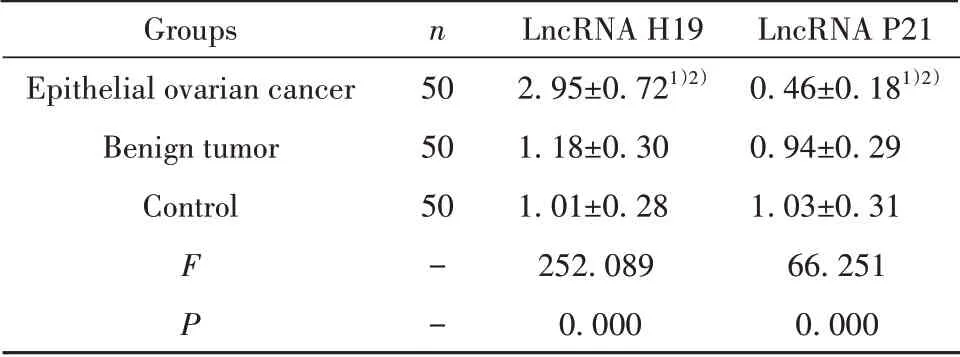
表1 3组血浆LncRNA H19、P21表达水平比较(±s)Tab.1 Comparison of plasma LncRNA H19 and P21 expression levels in 3 groups(±s)
Note:Compared with control group,1)P<0.05;compared with benign tumor group,2)P<0.05.
Groups Epithelial ovarian cancer Benign tumor Control F P n 505050− −LncRNA H192.95±0.721)2)1.18±0.301.01±0.28252.0890.000 LncRNA P210.46±0.181)2)0.94±0.291.03±0.3166.2510.000
2.3 上皮性卵巢癌患者血浆LncRNA H19与Ln‐cRNA P21表达水平相关性 如图1所示,上皮性卵巢癌患者血浆LncRNA H19与LncRNA P21表达水平呈负相关(r=−0.429,P=0.000)。

图1 上皮性卵巢癌患者血浆LncRNA H19与LncRNA P21表达水平相关性Fig.1 Correlation between plasma LncRNA H19 and Lnc-RNA P21 in patients with epithelial ovarian cancer
2.4 上皮性卵巢癌发生的影响因素分析 单因素分析结果显示,FIGO分期Ⅲ~Ⅳ期、淋巴结转移、Lnc-RNA H19高表达、LncRNA P21低表达是影响上皮性卵巢癌发生的危险因素(P<0.05)。多因素分析结果显示,FIGO分期Ⅲ~Ⅳ期、淋巴结转移、Lnc-RNA H19高表达、LncRNA P21低表达是影响上皮性卵巢癌发生的独立危险因素(P<0.05),见表3、4。

表3 影响上皮性卵巢癌发生的单因素Logistic回归分析Tab.3 Univariate Logistic regression analysis of epithelial ovarian cancer

表4 影响上皮性卵巢癌发生的多因素Logistic回归分析Tab.4 Multivariate Logistic regression analysis of influencing factors on occurrence of epithelial ovarian cancer
2.5 血浆LncRNA H19与LncRNA P21表达水平对上皮性卵巢癌发生的诊断价值分析 如图2和表5所示,血浆LncRNA H19、LncRNA P21表达水平联合对上皮性卵巢癌发生诊断的曲线下面积为0.892,均明显高于二者单独对上皮性卵巢癌发生诊断的曲线下面积(0.804、0.797,Z=2.134、2.122,P=0.033、0.034)。
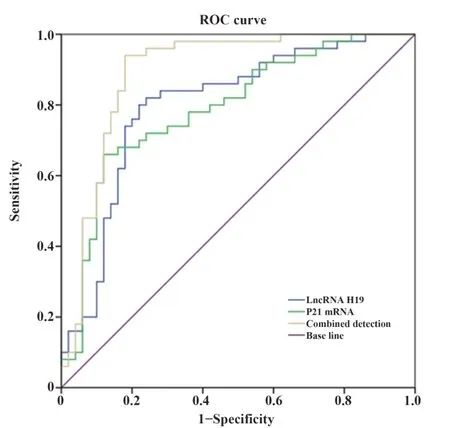
图2 血浆LncRNA H19与LncRNA P21表达水平对上皮性卵巢癌发生的诊断价值Fig.2 Diagnostic value of plasma LncRNA H19 and Lnc-RNA P21 expression levels in epithelial ovarian cancer

表5 血浆LncRNA H19与LncRNA P21表达水平对上皮性卵巢癌发生的诊断价值分析Tab.5 Diagnostic value of plasma LncRNA H19 and Lnc-RNA P21 expression levels in epithelial ovarian cancer
3 讨论
卵巢癌作为妇科三大恶性肿瘤之一,仍是威胁女性生命健康的主要恶性疾病,其中上皮性卵巢癌约占全部卵巢癌的85%以上[10]。目前上皮性卵巢癌进展的病理机制尚未完全明确,在分子水平上探究其发生发展影响因素是提高患者生存率、探寻治疗靶点的重要手段。
LncRNA是一类长度大于200 nt的RNA分子,不具有编码蛋白质潜能,但可参与机体生长发育、细胞增殖凋亡等多种生物学进程调控,与肿瘤的发生发展密切相关。LncRNA H19位于人类染色体11p15.5,是第一个被发现的印记基因,已被证实对肿瘤发生具有抑制和促进双重作用[11]。研究表明,前列腺癌细胞系中过表达LncRNA H19可靶向miR‐NA抑制癌细胞迁移[12]。此外有研究发现,体外过表达LncRNA H19可促进卵巢癌细胞对顺铂耐药,并可通过调节上皮间充质转化过程促进癌细胞增殖迁移[13]。本研究结果显示,上皮性卵巢癌组血浆LncRNA H19表达水平明显高于上皮性卵巢良性肿瘤组和对照组,与WU等[13]的研究结果相似,提示血浆LncRNA H19表达水平升高可能与上皮性卵巢癌发生有关。进一步研究发现,Ⅲ~Ⅳ期、有淋巴结转移患者血浆LncRNA H19表达水平高于Ⅰ~Ⅱ期、无淋巴结转移患者,提示LncRNA H19可能通过调节癌细胞增殖、迁移促进上皮性卵巢癌发展。而已有研究表明LncRNA H19在非小细胞肺癌中表达显著上调,与靶向p53调控癌细胞增殖有关[14],推测本研究中LncRNA H19可能靶向调控p53基因水平影响上皮性卵巢癌细胞增殖等。
LncRNA P21位于细胞周期蛋白依赖性激酶抑制剂1(cyclin-dependent kinase inhibitor 1,P21)上游约15 kb处,与细胞增殖、凋亡调控密切相关。P21被证实在膀胱癌、肺癌、结直肠癌中表达水平降低,与肿瘤细胞增殖、迁移等受到抑制有关[15-17]。本研究结果显示,上皮性卵巢癌组血浆LncRNA P21表达水平明显低于上皮性卵巢良性肿瘤组和对照组,且Ⅲ~Ⅳ期、有淋巴结转移患者血浆LncRNA P21表达水平较Ⅰ~Ⅱ期、无淋巴结转移患者低,与前人在其他肿瘤中研究结果相似[15-17],提示LncRNA P21表达水平下调可能与上皮性卵巢癌的发生有关,其水平持续降低可能预示患者病情进一步发展。可能调控机制为,LncRNA P21水平下调时其与STAT3等结合减少,进而导致其对细胞周期G1期阻滞和诱导细胞凋亡能力减弱,最终促进肿瘤进展[7]。有研究证实,LncRNA P21是抑癌基因P53的下游调控因子,推测LncRNA P21在上皮性卵巢癌中表达降低可能与p53合成受抑制有关,该机制最终可能通过影响肿瘤上皮间充质转化抑制卵巢肿瘤生长[18]。
由于LncRNA H19、P21表达均与p53基因表达关系密切[12],本研究经相关性分析发现,上皮性卵巢癌患者血浆LncRNA H19与LncRNA P21表达水平呈负相关,提示上皮性卵巢癌发生发展中Ln‐cRNA H19、LncRNA P21间可能存在共同的调控通路,以发挥其调控癌细胞增殖迁移作用。进一步研究发现,血浆LncRNA H19高表达、血浆LncRNA P21低表达是影响上皮性卵巢癌发生的危险因素,且二者联合对上皮性卵巢癌的诊断效能较高,提示血浆LncRNA H19、P21表达水平与上皮性卵巢癌进展密切相关,可能用于评估上皮性卵巢癌发生。
综上所述,上皮性卵巢癌患者血浆LncRNA H19呈高表达、血浆LncRNA P21呈低表达,均与肿瘤FIGO分期、淋巴结转移密切相关,二者联合对上皮性卵巢癌发生的诊断价值较高。但由于本研究仅从表达水平层面分析二者间相关性,具体的作用机制及诊断价值尚需进一步进行验证。

