蓝萼甲素通过cyclinB1/CDK1途径诱导DU145细胞G2/M期阻滞①
朱琳琳 徐祉轩 张明明(新乡医学院医学检验学院,河南省分子检验与医学检验技术协同创新中心,河南省免疫与靶向药物重点实验室,新乡453003)
前列腺癌(prostate cancer,PCa)发病率逐年升高,现已成为严重威胁亚洲男性健康的第二大恶性肿瘤,但相当一部分患者激素治疗不敏感或耐受,迫切需要寻找抗肿瘤效果明确但不良反应较小的药物。本研究选取的蓝萼甲素(glaucocalyxin A,GLA)是从传统中草药香茶菜中分离提取的活性成分,香茶菜作为中草药,用于清热解毒、抗菌消炎、抗肿瘤历史悠久。研究表明GLA具有良好的抗肿瘤作用,但机制尚不明确[1-4]。本研究检测GLA对人前列腺癌细胞系DU145细胞中周期蛋白B1(cy‐clinB1)、周期蛋白依赖性激酶1(cyclin-dependent ki‐nase1,CDK1)等细胞周期相关因子表达的影响,探讨GLA诱导细胞周期阻滞的作用机制,为GLA的临床应用提供实验依据。
1 材料与方法
1.1 材料人前列腺癌细胞系DU145细胞购自中科院上海细胞库。胎牛血清、RPMI1640培养液购自Gibco公司;GLA由新乡医学院药学院提供;Trizol试剂、逆转录酶(M-MLV)、实时荧光定量PCR试剂盒购自天根生化科技(北京)有限公司;所用引物均由上海生工生物工程(上海)股份有限公司合成;所用抗体均购自美国CST公司;BCA蛋白浓度检测试剂盒、流式细胞周期检测试剂盒购自江苏碧云天生物技术公司;流式凋亡检测试剂盒购自美国BD公司。
1.2方法
1.2.1 实验分组实验设空白对照组、1 μg/ml、2.5 μg/ml、5 μg/ml GLA组,4组细胞培养基均含10%胎牛血清、100 U/ml双抗(青链霉素),培养环境为37℃、5%CO2。空白对照组不加GLA,其他各组细胞贴壁后分别加入相应浓度GLA刺激培养。
1.2.2 细胞增殖4组细胞接种于96孔板中,每孔体积100 μl,约2 000个细胞,细胞贴壁后加药。各孔分别加入10 μl CCK-8溶液,96孔板置于37℃、5%CO2培养箱中孵育1 h,取出96孔板,置于酶标仪检测位,振荡混匀后,酶标仪450 nm测定各孔标本吸光度。
1.2.3 细胞周期细胞接种于6孔板中,约1×106个/孔,各孔细胞数量均匀。细胞贴壁后加药,加药后培养24 h,按试剂盒操作说明收集固定细胞,染色,上机检测分析。
1.2.4 细胞凋亡细胞接种于6孔板中,约1×106个/孔。细胞贴壁后加药培养24 h,收集细胞。预冷PBS洗涤细胞,Binding Buffer重悬细胞,Annex‐in V-FITC标记后避光、室温孵育15 min,PI染色后上机检测分析。
1.2.5 Real-time PCR Trizol一步法提取细胞总RNA,异丙醇法浓缩RNA,对RNA浓度和质量检测后进行逆转录,并按试剂盒操作说明完成qRTPCR。qRT-PCR反应条件为95℃预变性10 min,95℃变性15 s与60℃退火/延伸60 s进行40个循环,最后分析熔解曲线,采用2-ΔΔCt法(其中Ct值为循环阈值)分析mRNA的相对表达水平。所用引物序列见表1。
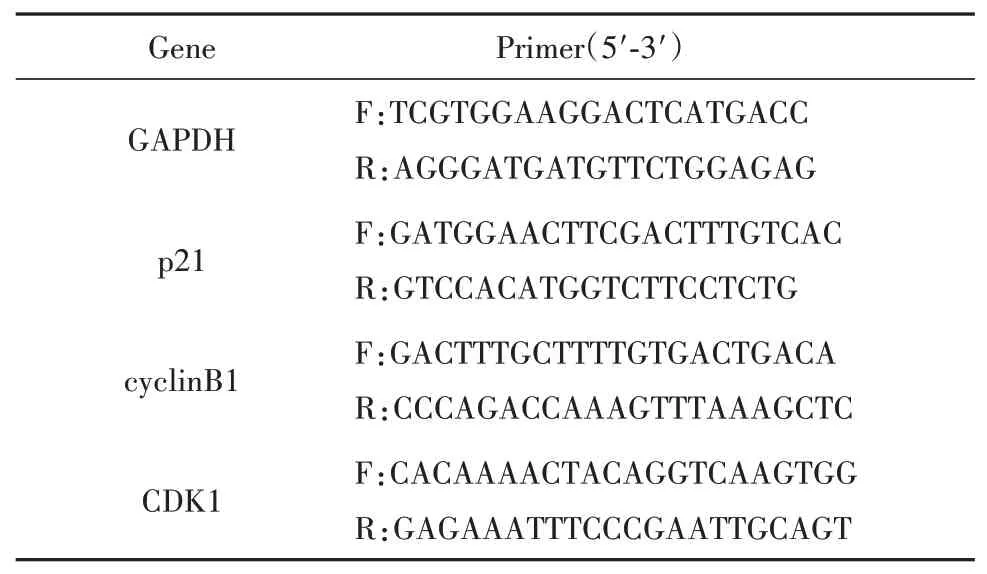
表1 Real-time PCR引物序列Tab.1 Primers used in real-time PCR
1.2.6 Western blot提取细胞总蛋白,BCA法测定蛋白浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后依次转膜、室温封闭、孵育一抗(p21、cyclinB1、CDK1为1∶1 000稀释)4℃过夜、孵育HRP-二抗(1∶5 000稀释)室温摇床1 h,洗膜后曝光扫描,以目的蛋白与β-actin蛋白条带灰度值的比值,作为其相对表达量。
1.2.7 免疫荧光采用爬片:在24孔板中培养DU145细胞,细胞贴壁后加药刺激24 h,PBS洗涤细胞后4%多聚甲醛室温固定30 min,0.5%TritonX-100室温通透15 min,室温封闭90 min,一抗孵育(cyclinB1、CDK1分别为1∶400、1∶100稀释),4℃过夜,荧光二抗(1∶400稀释)室温避光孵育1 h,DAPI染色,应用荧光显微镜检测蛋白在细胞中的定位分布。
2 结果
2.1 GLA抑制DU145细胞增殖各组细胞按相应药物浓度分别刺激培养1 h、6 h、12 h、24 h、48 h,检测细胞增殖情况。结果显示,与对照组相比,1 μg/ml GLA对细胞增殖的影响无统计学差异(P>0.05);2.5 μg/ml与5 μg/ml GLA能够抑制细胞增殖,5 μg/ml GLA的抑制效果更为显著(P<0.01),见图1。可见GLA抑制DU145细胞增殖的作用呈现剂量依赖效应。
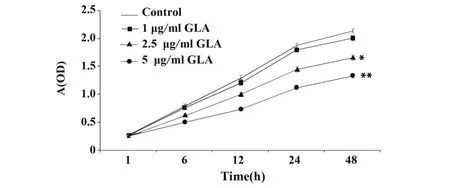
图1 DU145细胞增殖曲线Fig.1 Proliferation curve of DU145 cells
2.2 GLA阻滞DU145细胞周期与对照组相比,1 μg/ml GLA对细胞周期的影响并无统计学差异。随着浓度增加,GLA显现出阻滞细胞周期的作用,当5 μg/ml GLA刺激培养DU145细胞24 h后,细胞周期明显停滞于G2/M期(P<0.01),见图2。GLA阻滞DU145细胞周期的作用呈现出明显剂量依赖效应。
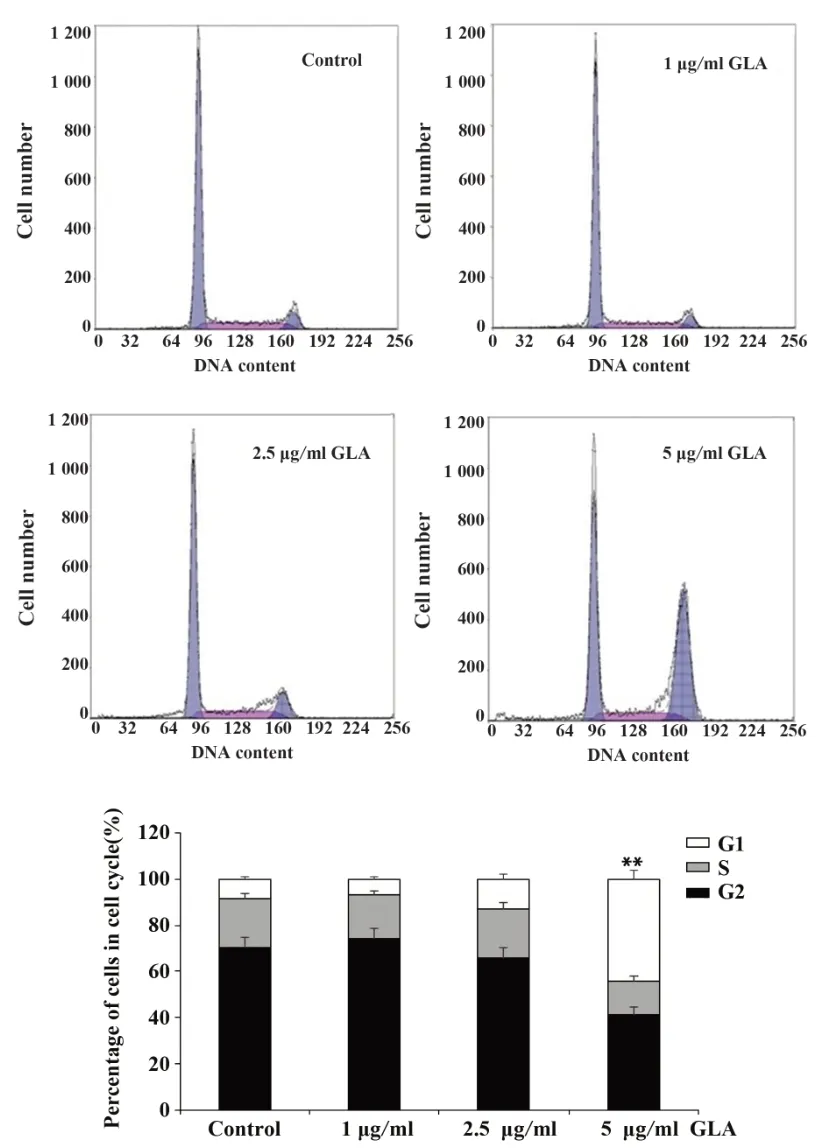
图2 GLA引发DU145细胞G2/M期阻滞Fig.2 GLA induces G2/M cell cycle arrest in DU145 cells
2.3 GLA调节DU145细胞周期蛋白的表达1 μg/ml GLA刺激培养细胞24 h,与对照组相比,p21、cy‐clinB1、CDK1 mRNA与蛋白的表达均无统计学差异。但随着浓度的增加,2.5 μg/ml GLA能够促进p21的表达,并抑制cyclinB1与CDK1的表达;5 μg/ml GLA的作用效果更为明显,在显著促进p21表达的同时,更加抑制了cyclinB1与CDK1的表达,且qRTPCR与Western blot的结果基本一致,见图3。可见GLA调节DU145细胞周期相关因子的表达,在mRNA与蛋白水平上均表现出剂量效应。
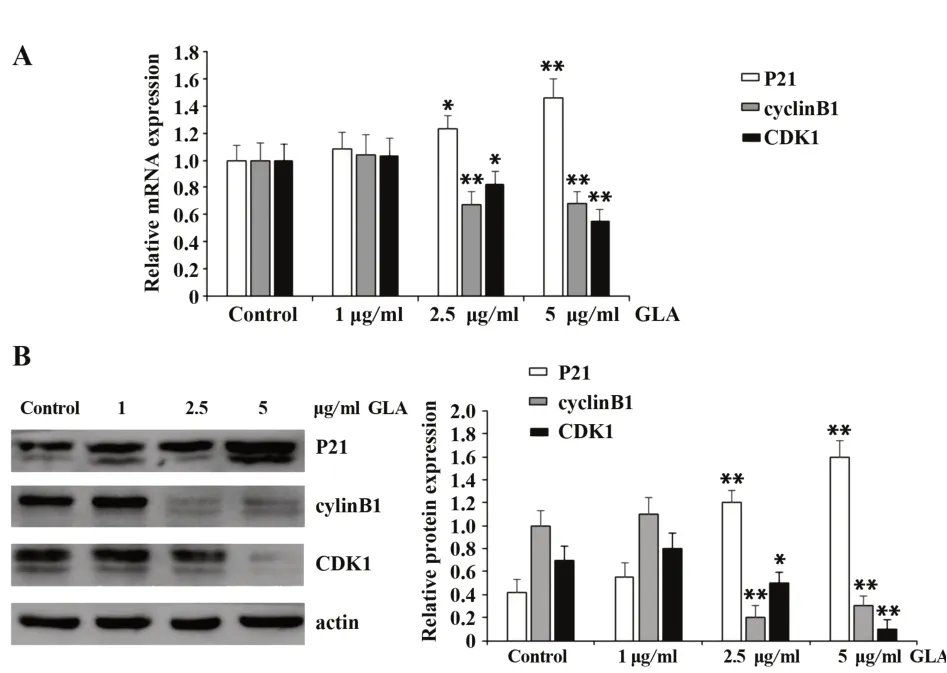
图3 GLA调节DU145细胞周期相关蛋白的表达Fig.3 GLA regulate cell cycle relative protein expression in DU145 cells
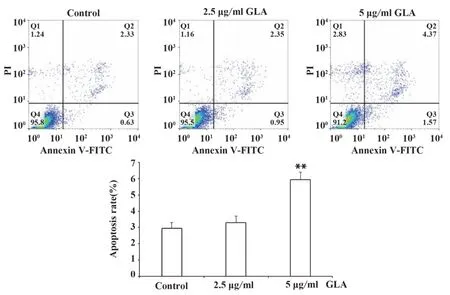
图5 GLA促进DU145细胞凋亡Fig.5 GLA promote DU145 cells apoptosis
2.4 免疫荧光验证DU145细胞周期蛋白的定位表达免疫荧光结果进一步验证了Western blot的结果,细胞周期蛋白cyclinB1、CDK1主要表达于细胞质,5 μg/ml GLA能够显著抑制cyclinB1、CDK1的表达(见图4)。GLA引起DU145细胞周期阻滞与其抑制cyclinB1、CDK1表达的作用效果及剂量效应完全一致,因此推测GLA极有可能通过抑制cyclinB1、CDK1的表达而导致细胞周期阻滞于G2/M期。

图4 DU145细胞周期蛋白细胞内表达(×400)Fig.4 Localization of cell cycle relative protein in DU145 cells(×400)
2.5 GLA诱导DU145细胞凋亡GLA阻滞细胞周期后极有可能引发细胞生物学行为发生变化。流式检测结果显示:2.5 μg/ml GLA作用于细胞,虽然能引起凋亡增加,但与对照组相比并无统计学差异(P>0.05),5 μg/ml GLA才显 示 出促 凋 亡 效 果(P<0.01)。
3 讨论
前列腺癌为常见恶性肿瘤,近年来随着经济水平的不断提高,人口老龄化进一步明显,我国前列腺癌患者呈逐年上升趋势[5-6]。大多数前列腺癌发病隐匿、进程缓慢,就诊时往往已是中晚期,临床多用雄激素治疗,但很多患者治疗后期出现激素不敏感或耐受,最终肿瘤转移扩散[7]。因此迫切需要寻找抗肿瘤效果明确但不良反应少的药物。
传统中草药一直以其活性强、毒性小备受关注,其中香茶菜在民间应用历史悠久[1-4],已用于临床的冬凌草就是从香茶菜中提取的活性成分,本研究选取的GLA则是香茶菜的另一种活性成分。前期研究发现,小剂量GLA能够通过IL-6激活Stat3信号通路,调节细胞炎症反应,促进肿瘤细胞增殖与侵袭迁移[8-9]。中草药往往对细胞功能具有双向调节作用,研究也表明GLA具有抗炎、抗肿瘤、免疫调节等作用[3-4]。因此,本研究采用较高浓度GLA作用于前列腺癌DU145细胞,探讨GLA抗肿瘤的作用机制。
增殖实验结果显示,2.5、5 μg/ml GLA作用于DU145细胞24 h后,可以抑制DU145细胞的增殖,尤以5 μg/ml GLA的作用效果更为显著。与前期实验结果一致的是,与对照组相比,1 μg/ml GLA对细胞增殖的影响作用并无统计学意义。这些结果均提示GLA抑制细胞增殖的作用呈剂量效应及时间依赖性。增殖与细胞周期关系密切,周期紊乱可以引起增殖异常。
细胞周期结果显示,与对照组相比,1 μg/ml GLA对细胞周期基本无影响。随着浓度增加,2.5 μg/ml GLA表现出阻滞作用,5 μg/ml GLA的阻滞作用尤为显著,G2期细胞达44.3%,整体上凸显G2/M期阻滞。G1期到S期、G2期到M期是复杂活跃的分子水平变化时期,容易受环境条件影响。已有研究发现,白藜芦醇能够抑制DU145细胞从G0/G1期向S期转变,从而抑制其增殖[10]。本研究结果提示GLA能够显著影响DU145细胞从G2期向M期的转变,进而阻滞细胞周期,抑制其增殖。
参与细胞周期调控的蛋白主要有S、M、G1期蛋白与CDK激酶。cyclin B为M期周期蛋白,从S期开始表达,在G2/M期到达峰值,后期消失。CDK1的活化依赖于cyclinB1,cyclinB1与CDK1结合并激活CDK1可以促进细胞由G2期进入M期[11]。p21则是CDK激酶的抑制剂,能够抑制cyclinB1/CDK的激活,阻滞细胞G2/M期转变[12]。鉴于GLA引发G2/M期阻滞,因此本研究进一步对p21、cyclinB1、CDK1进行检测。结果显示,5 μg/ml GLA作用DU145细胞24 h,促进p21表达的同时,显著抑制cyclinB1、CDK1的 表 达。GLA对p21与cyclinB1/CDK1的 作用效果正好相反。与此一致的是,LIN等[13]研究发现,GLA能够通过促进/抑制p21、Cdc25C等周期蛋白的表达,阻滞膀胱癌UMUC3的细胞周期。免疫荧光进一步印证了Western blot结果。与对照组相比,5 μg/ml GLA刺激培养24 h,DU145细胞质中cyclinB1与CDK1的表达明显增多。因此GLA极有可能通过抑制周期蛋白cyclinB1的表达,影响CDK1激酶的活化,进而导致G2/M期阻滞。
细胞周期紊乱会诱发凋亡,细胞周期长时间停滞也会诱发凋亡。流式结果就显示出5 μg/ml GLA能够引起DU145细胞凋亡,提示GLA引起周期阻滞的同时,也诱发了凋亡。已有研究发现,GLA能够抑制PI3K/Akt信号通路,导致p21、Bax蛋白累积,继而激活下游信号通路,引起细胞周期阻滞和凋亡[13-15]。本研究结果也显示GLA诱发G2/M期阻滞与p21蛋白增多相关,提示GLA极有可能通过p21蛋白信号通路诱导DU145细胞凋亡,具体作用机制在后续实验中进一步探索。
综上所述,本研究发现GLA能够诱导DU145细胞周期阻滞于G2/M期,这一作用极有可能是通过抑制细胞周期蛋白cyclinB1、CDK1的表达而诱发,cyclinB1、CDK1表达升高进一步激活凋亡信号通路,促进细胞凋亡。因而,控制GLA的作用浓度及作用时间,有效发挥其阻滞细胞周期的作用,对前列腺癌防治有新的意义和价值。

