过表达BMP-12的兔BM-MSCs在3D打印PLGA支架上的增殖与分化特性研究
崔磊,陈鹏,张文涛,谢小肖,李伟,江长青
(1.安徽医科大学北京大学深圳医院临床学院,广东 深圳 518036;2.北京大学深圳医院 运动医学科)
肌腱-骨骼连接处的损伤在运动和工作中很常见,每年全世界有3 000多万人深受其影响[1]。肌腱-骨愈合的特点是修复后在原损伤处形成瘢痕组织界面,但是腱骨界面的再撕裂率很高[2]。在上肢损伤中,肩袖损伤较为常见。对于保守治疗无效的肩袖损伤,通常进行关节镜手术治疗。但肩袖撕裂,尤其是巨大肩袖撕裂,术后再撕裂率较高[3-4]。针对目前较高的手术失败率,需要探究新的治疗措施来改善肌腱-骨骼连接处损伤修复后的腱骨愈合效果。
近年来,骨髓间充质干细胞(BM-MSCs)因其具有的多能性和出色的自我更新能力,成为了细胞组织工程的理想选择[5-6]。研究发现骨形态发生蛋白12(BMP-12)可在体外和体内促进肌腱修复和肌腱样组织的形成[7-8]。此外,BMP-12还可促进BM-MSCs的腱向分化[9]。因此,BMP-12过表达的BM-MSCs可能是用于肌腱修复的较理想的工具。
聚乳酸-羟基乙酸共聚物(PLGA)具有出色的生物相容性和生物可降解性,在医药和生物材料的应用时基本不会产生毒副作用,因此其在医药及生物材料的应用中越来越受重视。修复复杂的组织缺损通常需要定制支架,因此,具有精准定制特性的3 D打印技术与组织工程完美契合,可以个性化制作具有复杂几何结构的三维支架。最近,有研究表明3 D打印支架已成功应用于骨的形成和愈合[10-13]。然而,目前3 D打印支架在肌腱组织修复再生中的应用仍是非常有限的。
在本研究中,我们制备了3 D打印PLGA支架,并将BMP-12过表达的兔BM-MSCs植入支架上。通过体外实验研究3 D打印PLGA支架上BMP-12过表达BM-MSCs的增殖和分化特性。为进一步研究携带过表达BMP-12的BM-MSCs的3 D打印PLGA支架在肌腱损伤修复中的应用提供支持。
1 材料与方法
1.1 3 D打印PLGA支架制备
Peng等[14]研究人员已经报道了3 D打印PLGA支架的制备过程。以下为简要步骤。
⑴应用Mimics 15.0重建需要打印的组织,应用CAD软件设计所需要的肩袖形态及内部的显微走向,编译驱动对应的打印程序。
⑵将PLGA粉末(Sigma,美国)在135℃离心室中熔化,在温度范围125℃~150℃环境中以100 g的转速离心10 min。
⑶将融化的PLGA在135℃的温度下,使用27号金属针喷出。制作而成的长棒状结构为20μm宽,1 800μm长。它们的方向代表着肩袖中胶原纤维的走向,其中长棒状结构间距为100μm,保证在细胞种植时能顺利通过并附着。最终制备出高度为1 mm,直径为15 mm并相互交织的结构。
⑷使用扫描电镜(TESCAN,捷克)观察3 D打印PLGA支架的超微结构,并测量其中每一个微孔的直径,使用图形计算软件(SMILE view,日本)计算这些微孔的平均直径。
1.2 3 D打印PLGA支架的降解性能检测
将3 D打印PLGA支架切成30 mg的小块,然后将支架碎片放置在pH=7.2的PBS溶液中,于37℃恒温培养箱中浸泡12周,每4周更换一次PBS溶液,分别在第4、8和12周时,将支架材料从PBS溶液中取出,用蒸馏水彻底冲洗并风干后,使用微量天平(Columbus,美国)测量支架材料的重量。质量的损失通过公式 L=(mo-mt)/mo×100%计算,其中 mo是降解前的质量,mt是经过不同时间降解后的质量。
1.3 兔BM-MSCs的分离培养
用含100μg/mL链霉素、100 u/mL青霉素和1%胎牛血清(FBS;Sigma)的PBS冲洗无菌分离出的新西兰大白兔股骨和胫骨的髓腔,获得骨髓组织中的细胞。洗涤重悬后400 g离心30 min,收集细胞,获得的细胞在添加了10% FBS的DMEM(Sigma,美国)培养基中于37℃的条件下培养过夜,第2天冲洗漂浮的细胞,余下的细胞继续培养[19]。
1.4 流式细胞鉴定
获取第3代的BM-MSCs,经胰蛋白酶消化后,制成细胞悬液,1 000 rpm离心10 min,PBS溶液洗2遍。重悬后分装至EP管(1μL/管),然后加入异硫氰酸荧光素( FITC)共轭的 CD 90、CD 45、CD 29和β-2 微 球 蛋 白 (β-2 microglobulin,β2 m)(Abcam,英国)。4℃避光孵育30 min,PBS溶液洗涤后重悬。阴性对照组通过使用一级抗体取代FITC共轭的免疫球蛋白。最后使用流式细胞仪(BD Biosciences,美国)检测细胞表面标记物表达情况。
1.5 细胞转染
携带BMP-12基因的腺病毒载体购自GenePharma(上海),获取第3代BM-MSCs用于腺病毒转染。使用脂质体2000试剂(Invitrogen)将腺病毒载体(对照组)及含有BPM-12基因的腺病毒载体(ADBMP-12)分别转染细胞。将转染的细胞转移到新鲜培养基中,置于37℃、5% CO2饱和湿度的培养箱中孵育。
1.6 细胞种植
PLGA支架放入超净台经过紫外线照射30 min,然后在75%的乙醇溶液中浸泡12 h,无菌PBS溶液清洗3次。将合适尺寸的支架放入24孔板中,使用全细胞培养液浸泡7 d备用。取转染BMP-12基因的第3代BM-MSCs,每块支架接种1×106细胞,在各孔中加入3 mL的培养液将支架完全浸没,然后放入37℃、5% CO2饱和湿度的培养箱中。阴性对照组则种植未转染BMP-12基因的第3代BM-MSCs。
1.7 细胞黏附
在细胞种植于3 D打印PLGA支架后第1、3、5、7天,取部分种植有细胞的PLGA支架观察细胞的黏附情况。用4%多聚甲醛将细胞固定15 min,随后行苯基吲哚染色(Sigma,美国)。按照染色试剂盒说明书操作,在室温下染色10 min后将支架置于荧光显微镜(Bio-Tek,美国)下进行观察。计数5个随机视野下的细胞数,计算其平均数。
1.8 细胞毒性检测
此次试验中使用LDH-细胞毒性检测试剂盒(Cataloguenumber KA0785.Abnova,台湾)进行细胞毒性试验。在细胞接种后72 h进行该项测定。死亡对照组细胞使用非离子型表面活性剂乙二醇辛基苯基醚(Triton X-100)处理20 min,使细胞内LDH完全释放。LDH的浓度使用560 Labmax检测仪(Labtest,美国)测量。
1.9 细胞增殖检测
在BM-MSCs接种于3 D打印PLGA支架上培养的第1、3、5、7天,分别取部分培养孔检测细胞的增殖活性。在每个时间点,使用DMEM培养基清洗支架。使用计数试剂盒8(CCK-8)溶液(Beyotime,北京),于37℃,5% CO2饱和湿度培养箱中孵育2 h,然后用酶标仪(Bio-Tek)测量各孔在450 nm波长处的吸光度值(optical density,OD值)。
1.10 实时定量PCR(qRT-PCR)
使用TRIZOL试剂(Invitrogen,美国)从细胞中提取总RNA。把提取的RNA反转录到cDNA中,然后使用SYBR预混料Ex Taq Ⅱ试剂盒(Takara,大连)进行实时PCR,最后在AB Ⅰ7900系统(Applied Biosystems,美国)上进行检测,以Actin为内对照,通过比较相对Ct值的方法进行检测mRNA表达情况。
1.11 Western blot检测种子细胞Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、BMP-12、SCX、Tnmd、Tnc 的蛋白表达水平
制备全细胞裂解物的方法见文献[15]。用以下主要抗体对膜进行Western blot,用以检测相关的蛋白表达水平:抗Ⅰ型胶原多克隆抗体(Abcam,美国),抗Ⅲ型胶原多克隆抗体(Abcam,美国),anti-BMP-12多克隆抗体(Abcam,美国),anti-SCX多克隆抗体(Abcam,美国),anti-Tnmd多克隆抗体(Abcam,美国),anti-Tnc多克隆抗体(Abcam,美国)和anti-β-actin兔多克隆抗体(Abcam,美国)。用相应的二级抗体(Abcam,美国)和ECL试剂(Sigma)观察蛋白条带。
1.12 统计学方法
所有的统计数据均采用SPSS 18.0统计软件(SPSS,Inc,美国)进行分析,采用非配对样本t检验比较两组间的差异;采用单因素方差分析比较两组以上的差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 3D打印PLGA支架形态特征
计算机软件模拟出的支架三维形态如图1A所示,3 D打印的PLGA支架如图1B所示,可看出支架表面粗糙,呈现出微孔,纤维丝分层分布,每层之间平行,层内纤维丝平行排列,光滑均匀,相邻层次的纤维丝相互垂直,呈现“井”字形。扫描电镜(SEM)结果显示,3 D打印PLGA支架具有连通均匀的多孔立体结构,孔隙率为(79.3±5.4)%,其中大孔的平均尺寸为(256.3±17.6)μm(图 1C、D)。

图1 3 D打印PLGA支架的形态特征。(A)使用软件对支架进行三维建模;(B)预制支架的形态;(C)多孔复合支架的扫描电镜图像;(D)多孔复合支架扫描电镜的高放大率
2.2 兔BM-MSCs的免疫表型分析
流式细胞学检测分离的细胞的表型特征如图2所示,第3代的细胞CD90阳性率为98.3%,CD29阳性率为97.5%,CD45阳性率则为0.6%,β2m阳性率为0.4%。几乎全部第3代的细胞免疫表型CD 45及β2 m均为阴性(图2)。此结果表明:分离培养的细胞具有BM-MSCs的特性,可证明为BM-MSCs。
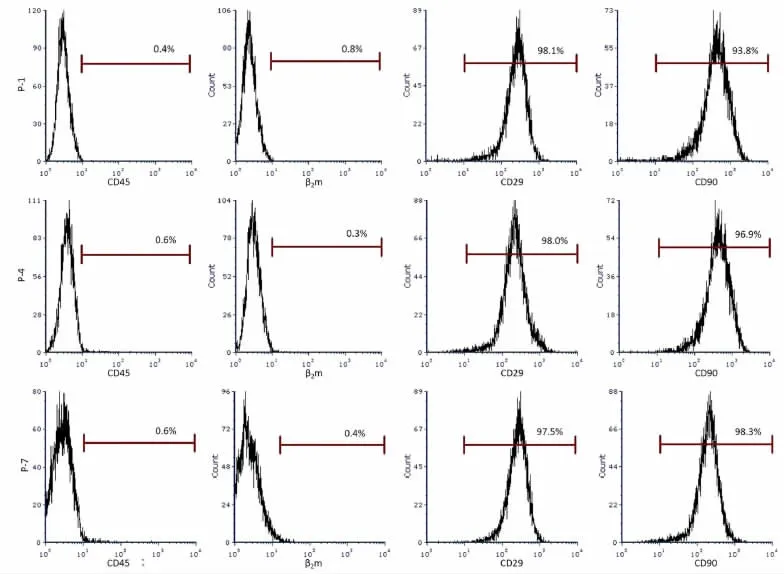
图2 离体兔BM-MSCs的免疫表型
2.3 3D打印PLGA支架的降解特性及PLGA支架材料对细胞的毒性和增殖活性的影响
3 D打印PLGA支架的降解通过质量损失法来检测,如图3A中所示,3 D打印PLGA支架材料经PBS孵育4、8和12周后的质量损失率分别为25%、43.3%和75.7%。细胞毒性检测结果显示,PLGA组细胞上清液中LDH含量与阴性对照组无明显差异,两组均明显小于死亡对照组,说明PLGA对兔BM-MSCs无明显毒性(图3B)。用CCK-8法检测PLGA支架对细胞增殖的影响,如图3 C中所示,PLGA组的OD值与阴性对照组相比差异无统计学意义(P>0.05)。另外,同时比较了在培养基中培养的兔BM-MSCs和用3 D打印PLGA支架培养的BM-MSCs的细胞增殖活性,阴性对照组和3 D打印的PLGA支架组之间没有显著差异(图3D)。此部分实验结果显示:PLGA对兔BM-MSCs的增殖无明显影响,且无明显细胞毒性。
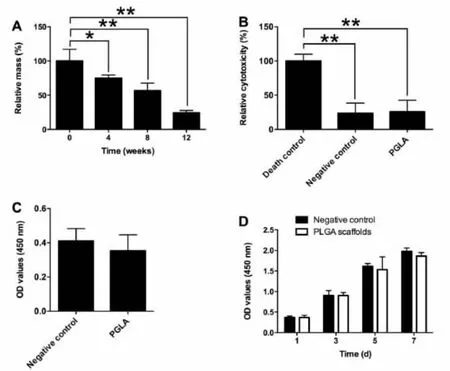
图3 3D打印PLGA支架的降解特性及PLGA对细胞毒性和细胞增殖的影响。(A)受试支架在PBS中降解的质量损失;(B)兔BMMSCs上清液中的乳酸释放量测定PLGA细胞性;(C)CCK-8法评价PLGA对兔BM-MSCs增殖的影响;(D)CCK-8法测定兔BM-MSCs在3D打印PLGA上的增殖
2.4 BMP-12促进兔BM-MSCs中肌腱细胞分化的相关生物标志物的表达情况
采用qRT-PCR和Western blot方法检测BMP-12过表达对兔BM-MSCs腱向分化的影响。如图4A所示,与阴性对照组相比,转染了BMP-12的BM-MSCs中BMP-12的mRNA表达量增加了约30倍,差异有统计学意义(P<0.01)。qRT-PCR结果进一步提示,与阴性对照组相比,兔BM-MSCs中BMP-12的过表达显著增加了Ⅰ型胶原、Ⅲ型胶原、SCX、Tnmd和Tnc的mRNA表达(图4B-F)。另外,Western blot结果显示,与阴性对照组相比,AD-BMP-12组BMP-12、Ⅰ型胶原、Ⅲ型胶原、SCX、Tnmd 和 Tnc 的蛋白水平显著升高(图4 G)。这些结果表明BMP-12的过表达促进了与肌腱分化相关生物标志物的表达。
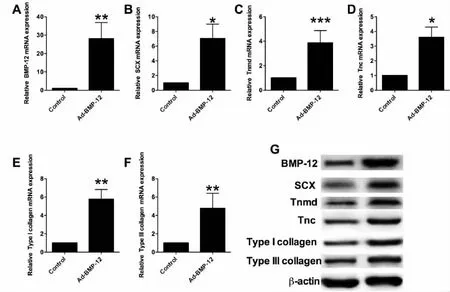
图4 BMP-12对兔BM-MSCs成骨分化的影响。用qRT-PCR测定(A)BMP-12;(B)SCX;(C)Tnmd;(D)Tnc;(E)Ⅰ型胶原和(F)Ⅲ型胶原在BMP-12过表达兔BM-MSCs或对照兔 BM-MSCs的 mRNA 表达;(G)BMP-12、SCX、Tnmd、Tnc、Ⅰ型胶原、Ⅱ型胶原在两种方案中的蛋白质印迹分析
2.5 BMP-12促进兔BM-MSCs在3 D打印PLGA支架上的增殖、黏附和腱性分化
采用CCK-8法检测BMP-12过表达对用3D打印PLGA支架共培养的兔BM-MSCs增殖的影响。对照组和AD-BMP-12组的兔BM-MSCs种植在3 D打印PLGA支架上以后,分别于第1、3、5和7天进行CCK-8检测,发现对照组和AD-BMP-12组的兔BM-MSCs的OD值差异无统计学意义,而且随着时间延长两组细胞的OD值均逐渐增大(图5A)。另外,对照组和AD-BMP-12组的兔BM-MSCs在种植于3D打印PLGA支架后的第1、3、5和7天,两组的黏附细胞数量逐渐增加,且对照组和AD-BMP-12组之间的细胞黏附数量差异无统计学意义(图5B)。qRT-PCR结果显示,BMP-12的过表达显著促进了3D打印PLGA支架植入后Ⅰ型胶原、Ⅲ型胶原、SCX、Tnmd和Tnc的mRNA表达(图5 C-G)。Western blot分析结果显示,与阴性对照组相比,AD-BMP-12组兔BM-MSCs在3 D打印PLGA支架上种植后第1、3、5和7天,其Ⅰ型胶原、Ⅲ型胶原、SCX、Tnmd和Tnc的蛋白水平出现了显著升高(图5 H)。
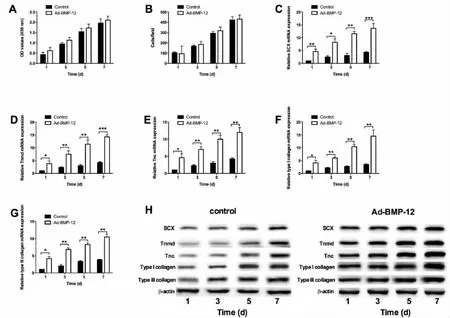
图5 BMP-12对在3D打印PLGA支架上培养的兔BM-MSCs增殖、黏附和成骨分化的影响。(A)CCK-8检测种植在PLGA支架上的过表达BMP-12的兔BM-MSCs和对照组兔 BM-MSCs在种植后第 1、3、5、7 天的细胞增殖活性;(B)种植在PLGA支架上的过表达BMP-12的兔BM-MSCs和对照组兔BM-MSCs在种植后第1、3、5、7天的细胞黏附情况;(C-G)qRT-PCR检测的种植在PLGA支架上的过表达BMP-12的兔BM-MSCs和对照组兔BM-MSCs在种植后第 1、3、5、7 天后,SCX、Tnmd、Tnc、I型胶原及 III型胶原的mRNA表达情况;(H)Western blot检测的种植在PLGA支架上的过表达BMP-12的兔BM-MSCs和对照组兔BMMSCs在种植后第 1、3、5、7 天后,SCX、Tnmd、Tnc、I型胶原及III型胶原的表达情况
3 讨论
肌腱损伤修复手术的成功与否取决于腱-骨结合处的愈合情况。经手术修复后,腱骨交界处形成一层纤维血管组织。但是,这种纤维血管组织是脆弱的,因此使得外科修复容易失败[20]。针对目前传统手术治疗方法的难点及其较高的手术失败率,研究人员开发、测试出许多生物材料并应用于临床,目的在于促进肌腱损伤组织的愈合,提高手术治疗的成功率,最终改善患者的术后功能[16]。
在前人的基础上,有学者进行了深入的研究,并提出进行肩袖损伤修补术时可采用相应的肩袖补片进行加强修补,这尤其适用于较大范围肩袖损伤及慢性肩袖损伤并伴有冈上肌萎缩的患者。此外,在手术治疗大面积肩袖损伤时应用肩袖补片,可以有效地缓解患者的疼痛、提高肌力和增加肩关节的活动度[17-18]。
人工合成的可降解医用高分子材料中相关研究最多、应用范围最广的是脂肪族聚酯,特别是PLGA及其共聚物。在美国,PLGA是通过FDA认证的、并被正式作为药用辅料收录进美国药典的材料。聚乳酸-羟基乙酸是通过水解的方式进行降解的,聚乳酸-羟基乙酸本身是与水不相溶的固体,经过溶蚀作用,其内部结构发生变化,转变为水溶性物质,体积与原来相比减小,溶解的小分子物质,将在人体内的三羧酸循环中发挥重要作用,最终的产物是二氧化碳与有机酸。聚乳酸-羟基乙酸共聚物(PLGA)是由两种单体乳酸和羟基乙酸经随机聚合而成,其具有出色的生物相容性和生物可降解性。并且PLGA的降解产物是乳酸和羟基乙酸,这是人正常代谢途径的副产物,因此它在医药和生物材料中应用时基本不会产生毒副作用。
3 D打印技术是上个世纪80年代末兴起的技术。原理有两方面,一方面是分层加工,另一方面是迭加成型[19]。3 D打印技术从传统的打印方式延伸而来,也就是普通喷墨打印。普通喷墨是平面的,也就是仅仅能在平面上移动,经过了在垂直上移动的创新之后,出现了3 D打印技术。再之后将3 D打印技术应用到了生物工程中,进行组织或是器官的打印。
BM-MSCs是多能干细胞,能够分化为多种间充质组织。多项研究表明,BM-MSCs具有向软骨细胞、成骨细胞、肝细胞等多种类型细胞分化的潜能[20-21]。有研究表明,BM-MSCs移植到撕裂的跟腱处经自然愈合后,跟腱具有更高的强度和更自然的组织[22]。一项研究表明,BM-MSCs在大面积肩袖撕裂修复中,可以明显改善肩袖的功能[23]。然而,来自Gulotta等[24]研究表明,在大鼠肩袖损伤修复模型中,应用BM-MSCs未能促进肌腱-骨结合处的愈合,这可能是由于缺乏促进BM-MSCs腱向分化的诱导因子所致。大量的动物实验表明,BM-MSCs能够促进骨、关节软骨和肌腱的局部修复和再生[25-27]。Ouyang等[28]研究者在兔模型中,将骨髓基质细胞引入骨隧道,通过在肌腱和骨之间形成纤维软骨附着物来改善其愈合情况。Lim等[29]研究者在兔前交叉韧带损伤重建模型中,用间充质干细胞覆盖肌腱移植物增强了肌腱移植物与骨的结合。
既往研究表明,体内移植细胞的转分化和存活率非常低[30-32]。而基于合成支架的组织工程技术为组织再生提供了一种很有潜力的替代方法。支架作为组织工程的重要组成部分,为细胞提供了固定的场所,增加了细胞的表面积,并为特定的结构提供了支撑。
本研究使用3 D打印技术制备了PLGA支架,并研究其降解性能,结果表明,3 D打印PLGA支架材料经PBS孵育12周后的质量损失率为75.7%,完全超出了肩袖愈合所需要的时间,说明这种材料的降解性能符合肩袖修复的需要。此外,我们还将3D打印的PLGA支架与BM-MSC共培养,并探究支架的细胞毒性及对细胞增殖活性的影响。实验结果发现,与PLGA支架共培养的BMSCs和阴性对照组BMSCs,两者细胞上清液中LDH含量差异无统计学意义,说明PLGA支架无明显的细胞毒性。在CCK-8检测细胞增殖活性的实验中,两组细胞连续培养7 d,PLGA支架组吸光度值与阴性对照组差异无统计学意义(P<0.05)。因此,我们有理由认为,PLGA支架对兔BMSCs的增殖活性没有明显影响。
BMP-12属于TGF-β/BMP家族,在体内外均能促进肌腱的分化和形成[8,33-34]。Lee等[35]研究者发现,在体外短时间内刺激BMP-12足以诱导BM-MSCs分化为腱细胞,当处理过的种植BM-MSC的胶原支架植入实验动物体内手术产生的肌腱缺损处,21 d后观察到开始形成了牢固的肌腱样组织。在本研究中,我们制备了过表达BMP-12的兔BM-MSCs,发现BMP-12的过表达促进了兔BM-MSCs腱细胞分化相关标志物的表达,并有助于细胞在3D打印PLGA支架上的种植,这表明BMP-12的过表达促进了BM-MSCs的成腱分化。
本研究采用3D打印技术制备PLGA支架,3D打印PLGA支架具有良好的生物相容性及生物可降解性,对BM-MSCs无明显细胞毒性作用,提示PLGA支架适用于体内植入。以上结果表明,使用3D打印的PLGA支架加载过表达BMP-12的BM-MSCs所制备的补片可以作为一种很有前途的肌腱组织修复方法。
但是,本研究尚存在一些局限性。目前我们只在体外实验中研究了种植于3D打印PLGA支架上的加载过表达BMP-12的BM-MSCs的增殖与分化特性,有待通过进一步的动物体内实验进行验证。
综上所述,在携带过表达BMP-12的BM-MSCs的3D打印PLGA支架上,BMP-12的过表达促进了BM-MSCs的腱向分化。携带过表达BMP-12的BM-MSCs的PLGA支架可以为肌腱组织修复提供一种新的治疗方法。
致谢:本研究基于深圳市科技计划项目(项目编号:20180214121124 778)及深圳市医疗卫生三名工程(项目编号:SZSM201612078)的支持得以顺利进展,值此表达诚挚感谢。

