4,4’-DDT全生命周期暴露对大型溞(Daphnia magna)生长、生殖、心率、行为、存活及基因转录的影响
李涵,李俊,刘春生
华中农业大学水产学院,武汉 430070
水质基准(WQC)是制定水质标准的重要科学依据,在环境保护方面发挥着重要作用,是环保部门制定水质标准、评价水质和进行水质管理不可或缺的科学依据和理论基础[1]。美国是最早开展水质基准研究的国家[2],随后许多学者针对水质基准建立中存在的问题,提出了一系列相关的理论和方法[3-4],目前已形成以保护水生生物和人体健康的水质基准为主,辅以沉积物基准、营养物基准、细菌基准、野生生物基准、生物学基准和物理基准等较为完整的水环境基准体系[5]。在美国环境保护局水质基准中,水生生物基准是最早制定的,它的目标在于防止化学污染物对具有商业和娱乐价值的水生生物及其他重要物种(如河流湖泊中的鱼类、底栖无脊椎动物和浮游生物)造成不可接受的长期和短期影响。水生生物基准制定包含2个参数的确定,即基准最大浓度(criteria maximum concentration, CMC)和基准连续浓度(criteria continuous concentration, CCC),这2个阈值浓度是为了防止化学污染物短期和长期作用对水生生物造成急性和慢性毒性效应而设,其值分别为水生生物短期或长期暴露在有毒物质中,没有产生不可接受的影响时,有毒物质在环境水体中的最大浓度。CMC的制定参考的是水生动物急性毒性数据,CCC的制定参考的是水生动物慢性毒性、植物毒性、生物富集的综合影响。在CCC制定中浮游甲壳类动物的毒理学数据是必须参考的,因为这类生物在水体中分布广泛,具有很强的代表性。在浮游甲壳类生物中,大型溞(Daphniamagna)是最为常用的毒理学测试模式生物[6-11],通常栖息在淡水水域环境中,在南半球及南非地区的分布非常广泛。美国环境保护局在1978年将大型溞定为毒性试验的必测项目,其慢性毒理学数据在美国环境保护局水质基准CCC的制定中发挥了很重要的作用。
传统的慢性毒性测试获得的毒理学数据在大部分情况下是可以保护水生生物免受污染物危害的,然而对于一些具有较强生物累积性和环境持久性的化学污染物而言,其对大型溞的慢性毒性数据与实际风险数据可能存在一定的偏差。大型溞的寿命通常为50~100 d,在自然水体中其全生命周期可能均暴露于污染物中。传统慢性暴露实验只涵盖其部分生命阶段,可能存在以下2个不足:(1)由于慢性暴露实验的暴露周期较短,获得的化学污染物对生物发育生殖指标的最低观察效应浓度(lowest observed effective concentration, LOEC)大都高于环境浓度,因此环境浓度化学污染物潜在的环境风险通常难以得到充分评估;(2)由于慢性暴露实验是在生物的部分生命周期内进行的,对于一些寿命较短而全生命周期都暴露于化学污染物中的生物而言,慢性暴露实验可能会低估化学品的实际环境风险。以往的研究发现,当磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)对大型溞的暴露时间达到62 d时,大型溞生长和生殖指标的LOEC在32 d的基础上均降低了一个数量级[12]。因此在对一些持久性污染物CCC的制定中,参考大型溞部分生命周期暴露的毒理学数据得出的阈值浓度在实际中可能仍然会对水生生物造成一定的毒性效应。为了探究这个问题,本研究从美国环境保护局水质基准文件NationalRecommendedWaterQualityCriteria: 2002中选取4,4’-滴滴涕(4,4’-DDT)为代表性污染物,以其CCC为参考测试浓度,对大型溞开展全生命周期暴露实验,评估阈值浓度的4,4’-DDT对大型溞不同生命阶段生长、生殖、心率、行为、存活和基因转录等指标的影响并比较各指标LOEC与暴露时间的关系。
4,4’-DDT是一种广泛使用的有机氯类杀虫剂,也是一种典型的内分泌干扰物质[13]。4,4’-DDT自身毒性不是很强,但具有很强的稳定性,生物降解缓慢,能长期存在于环境中,并在食物链和生物体组织中积累,尤其是脂肪组织[14]。由于4,4’-DDT使用广泛,目前已出现全球范围的污染[15],在许多鸟类和鱼类组织中均发现了4,4’-DDT残留物,包括生活在沙漠地区的鸟类或海洋深处的鱼类。美国环境保护局在2002年的文件中规定4,4’-DDT在水体中的CCC为1 ng·L-1。本研究选取持久性污染物4,4’-DDT对大型溞开展全生命周期暴露实验,旨在验证其CCC在全生命周期暴露下是否会对水生生物造成毒性效应,从而对部分生命周期暴露和全生命周期暴露之间的关系和应用做进一步思考,以及探究在对持久性污染物进行风险评估和基准制定时应通过何种暴露手段获取更为精准的毒理学数据来源。
1 材料与方法(Materials and methods)
1.1 实验试剂
4,4’-DDT购自Dr. Ehrenstorfer试剂公司(德国),CAS号为50-29-3,纯度为98%;二甲基亚砜(dimethyl sulfoxide, DMSO)购自Sigma公司(美国),CAS号为67-68-5,纯度>99%;总RNA提取所需的RNAiso Plus试剂、反转录试剂PrimeScriptTMRT reagent kit及荧光定量试剂SYBR® Primex Ex TaqTMⅡ均购自TaKaRa公司(大连,中国);氯仿(CAS 67-66-3)、异丙醇(CAS 67-63-0)、无水乙醇(CAS 64-17-5)均购自国药集团化学试剂有限公司,为国产分析纯级。
1.2 大型溞的培养
大型溞溞种来自南京大学环境学院,实验开始前在本实验室恒温光照培养箱中至少连续稳定培养了10代。大型溞培养温度为22 ℃±1 ℃,光暗比为16 h∶8 h。参考之前的相关研究中大型溞的培养方案,除氯自来水适用于大型溞的养殖[16-18]。本研究大型溞的培养液为经安吉尔净水器(J1205-ROB12)过滤后,连续曝气48 h除氯的自来水,曝气后溶氧含量为8.6 mg·L-1,在此培养液中大型溞生长状态良好、个体活跃。喂食小球藻(Chlorellapyrenoidesa)和斜生栅藻(Scenedesmusobliquus)混合液,喂食密度为产溞前2.5×106cell·mL-1,产溞后5×106cell·mL-1,每天上午9:00喂食一次。每隔一天更换一次培养液。
在本研究培养条件下大型溞只营孤雌生殖。孤雌生殖是大型溞在营养状况良好的条件下所营的一种无性生殖方式,由大型溞卵巢内的干细胞均等分裂生成卵母细胞进而发育成雌性个体[19],此繁殖方式有利于大型溞迅速扩大种群[20]。在孤雌生殖模式下,大型溞能保持遗传的稳定性和基因的纯净性,个体差异较小使毒理学研究能在可重复和统一的实验条件下开展[21]。此外孤雌生殖模式下大型溞繁殖周期短、子代产量大,使实验材料的获取更为便捷。而有性生殖是大型溞在营养状况不良条件下的生殖方式,产生的卵鞍需要在适宜条件下孵化才能发育成幼溞,此种繁殖方式是大型溞为渡过不良环境所进行的,出现有性生殖说明大型溞受到了环境胁迫,是一种不健康的状态[22],不适用于开展毒理学研究。在本研究中大型溞的所有子代均由孤雌生殖得到。
1.3 绿藻的培养与收集
小球藻和斜生栅藻藻种来自中国科学院水生生物研究所,使用BG11液体培养基在恒温光照培养箱内培养。BG11液体培养基配方如表1和表2所示。在接种第7天绿藻生长达到平台期,在此时收集绿藻。将收取的2种新鲜藻液按照1∶1的比例置于50 mL离心管内,配平后置于高温冷冻离心机内,20 ℃、8 000 r·min-1离心5 min,弃去上清,加入适量纯水,将沉淀摇匀后重复进行离心,洗涤2次之后,加入适量纯水,摇匀后用细胞计数仪(Cellometer Mini, Nexcelom,美国)测定绿藻细胞密度,适当稀释至所需密度后置于4 ℃冰箱保存备用。

表1 BG11液体培养基配方Table 1 The formulation of BG11 medium

表2 A5痕量金属溶液配方Table 2 The formulation of A5 trace metal solution medium
1.4 实验设计
1.4.1 4,4’-DDT浓度设置及母液配制
本研究以4,4’-DDT的CCC为标准,在高于其一个数量级和低于其一个数量级分别设置一个浓度梯度,从而比较LOEC与暴露时间之间的关系。之前的研究表明暴露时间延长可能使LOEC在数量级上降低,设置浓度梯度能探究4,4’-DDT全生命周期暴露是否也存在这种现象,从而揭示其是否能准确评估化学污染物的环境风险[12]。4,4’-DDT的CCC为1 ng·L-1,据此本研究选取10 ng·L-1为最高浓度,1 ng·L-1为次高浓度,0.1 ng·L-1为最低浓度,每个浓度设置3个平行,同时设置一个溶剂对照组。之前的研究表明,体积分数为0.01%的DMSO不会对大型溞造成毒性效应,因此本研究以溶剂对照作为空白对照[12]。暴露液的体积为1 000 mL,为了保证对照组DMSO的体积分数为0.01%,加入母液的体积应为100 μL。
4,4’-DDT原液的浓度为100 ng·μL-1,先吸取50 μL原液于棕色玻璃瓶内,加入950 μL DMSO,配制成5 000 ng·mL-1的母液,然后将其稀释5倍,得到1 000 ng·mL-1的母液,然后将母液按照梯度稀释的方法依次稀释,得到100、10和1 ng·mL-1的母液。将这3个浓度的母液吸取100 μL加入1 000 mL的暴露液中,得到4,4’-DDT的浓度即为10、1和0.1 ng·L-1,对照组加入等体积DMSO。
1.4.2 全生命周期暴露取样时间点的确定
根据之前绘制的大型溞全生命周期特征曲线[12],将大型溞的全生命周期分为生长阶段(0~12 d)、繁殖阶段(13~53 d)和死亡阶段(54 d~自然死亡)。为了与21 d慢性毒性测试作比较,选择的取样时间点分别为第6天、第21天、第32天和第55天,其中第6天、第32天和第55天分别是生长、繁殖和死亡阶段的代表性取样时间点。
1.4.3 4,4’-DDT对大型溞全生命周期暴露及取样
暴露实验使用1 000 mL的圆底烧杯,暴露培养液与日常培养保持一致,每个烧杯中盛入1 000 mL连续曝气48 h的过滤自来水和50只出生<12 h的幼溞,保证每只幼溞所占的平均体积为20 mL。在暴露体系中加入不同浓度的4,4’-DDT母液,使体系中4,4’-DDT的浓度达到设定值,在空白对照中加入等体积的DMSO。在恒温光照培养箱中进行培养,培养条件与日常培养保持一致,每天喂食一次,每隔一天换水一次,每次换水完成后都随机打乱烧杯在培养箱内的位置,排除光照不匀等因素对实验造成的误差。
从暴露的第0天起,每天观测对照组和暴露组大型溞的生长、繁殖和存活情况,并记录每个烧杯内存活的大型溞个数和每天新产出的子代总个数,每日新产出的子代在计数完成后需移出培养体系。在暴露的第6天、第21天、第32天和第55天,取样前需先测定大型溞F0代和F1代的体长(从头盔至尾巴基部的长度)、大型溞的心率和行为参数。体长测量方法为:从每个烧杯内随机取8只大型溞,使用软件Image Pro Plus和LEICA DFC450C(德国)拍照并测量体长,记为F0代体长。收集取样当日新产出的子代(<24 h)10只,测量体长,记为F1代体长。心率的测定方法为:从每只烧杯内随机选取3只大型溞,使用LEICA DFC450C(德国)和Camtasia Studio软件,待大型溞心率平稳后,在显微镜下将大型溞的心脏搏动拍摄为视频(50 f·s-1),然后以慢动作播放视频并计数60 s内的心跳次数。行为参数测定方法为:用动物行为仪DanioVision(Noldus,荷兰)监测并拍摄大型溞在1 h内(40 min光照+20 min黑暗)的水平游泳轨迹,随后用Ethovision XT 13软件分析计算其水平方向的游泳速度。由于本研究中大型溞的行为测定采用的是二维成像系统,为了最大程度消除垂直运动的影响,测定行为参数时选取的水深在不影响大型溞正常游动的情况下尽可能小,以限制大型溞在垂直方向上的运动,之前的几项研究也是通过在扁平的容器内进行检测以消除大型溞垂直方向运动的影响[23-25]。本研究均采取10 mm水深,大型溞的垂直运动可忽略不计。
各项指标测定结束后对大型溞进行取样,为了保证能提取足量的总RNA,根据大型溞个体大小的差异,在第6天、第21天、第32天和第55天所取样本数分别为15、10、5和5只。将大型溞样本取至做好标记的RNAase-free EP管内,充分吸干水分后加入600 μL TRIzol和4~5颗匀浆钢珠,用细胞破碎仪匀浆后置于-80 ℃冻存。
1.4.4 大型溞的阶段特异性PCR array
本研究基因转录的检测采用先前建立的大型溞阶段特异性PCR array[12]。简言之,将大型溞的全生命周期分为为出生阶段、生长阶段、繁殖阶段和死亡阶段。据推测,当大型溞从某一个生命阶段进入下一个生命阶段时,一些基因的转录将被上调以实现下一阶段的生物学功能。因此采用转录组测序手段筛选每2个连续的生命阶段之间上调的基因,开发大型溞的阶段特异性的PCR array。在以往的研究中,类似的假设也常被用来筛选具有阶段特异性功能的基因[26-27]。在本研究中,大型溞阶段特异性PCR array的开发步骤为:(1)分别获取第0天与第6天、第6天与第32天以及第32天与第62天之间的差异转录基因,并且对差异性上调的所有基因进行KEGG pathway分析,得到第0天与第6天、第6天与第32天以及第32天与第62天之间显著性上调的所有代谢通路,分别定义为生长、繁殖和死亡阶段的关键通路;(2)将3个阶段的所有关键通路按照富集因子(rich factor, RF)值从大到小排序;(3)选取每个阶段中RF排名前五的代谢通路进行重点研究,在每条代谢通路中,选取基因倍数变化(fold change)最大的5个基因(readcount≥10)构建大型溞的阶段特异性PCR array。从转录组数据中挖掘出在4个取样时间点转录均维持稳定的基因作为内参基因(internal control),本研究的内参基因为bcl2(hypothetical protein DAPPUDRAFT_311135

表3 大型溞阶段特异性PCR array包含的代谢通路及基因Table 3 List of genes and corresponding pathways in the developed stage-specific PCR array of Daphnia magna
1.4.5 实时荧光定量PCR检测
分别使用第6天、第32天和第55天的大型溞样品检测阶段特异性PCR array中生长阶段、繁殖阶段和死亡阶段关键基因的转录情况。总RNA的提取采用TRIzol法,RNA浓度和纯度的检测使用Epoch Microplate分光光度计(BioTek Instruments, Inc,美国),检测RNA样品在260 nm/280 nm波长下的比值,若该比值在1.90~2.10之间,则确定所得RNA纯度较高,可用于反转录,RNA浓度的测定是根据样品在260 nm波长下的光吸收度来确定的。反转录使用Prime Script RT reagent kits (Takara公司,大连,中国)试剂,所使用RNA的量为500 ng,根据试剂盒的步骤将所提取的总RNA反转录成cDNA,各试剂用量如下:5X Prime Script Buffer (for Real time) 2 μL,Prime Script RT Enzyme Mix 0.5 μL,Oligo Dt Primer (50 μmol·L-1) 0.5 μL,Random 6 mers (100 μmol·L-1) 0.5 μL,RNase Free dH2O 1.5 μL,Total RNA 5 μL。加样完成并离心后放置于PCR仪中进行反转录,PCR仪反应条件设置为:37 ℃,15 min;85 ℃,5 s。反应完成后得到cDNA。稀释20倍后可用于实时荧光定量PCR检测。实时荧光定量PCR检测使用SYBR Green Primex Ex TaqⅡ kits (Takara公司,大连,中国)试剂。各试剂用量如下:SYBR Green Mix试剂10 μL,DEPC水6 μL,Rox Reference Dye试剂0.4 μL,Primer F 0.8 μL,Primer R 0.8 μL,cDNA 2 μL。基因引物的设计使用的是Primer Premier 6软件,扩增条件设置为:95 ℃,2 min;95 ℃,15 s;60 ℃,1 min;共计40个循环。与之前的研究[12, 28]相同,本研究数据采用CT值计算,采用2-△△CT法分析,最后将转录数据以fold change形式呈现。
1.4.6 数据分析与处理
本研究中数据分析使用Kyplot Demo 3.0 (Tokyo, Japan)软件,参数方差的正态性和同质性分别使用Kolmogorov-Smirnov和Levene’s检验。处理组与对照组之间差异性的检验使用的是one-way analysis of variance,在本实验中所有分析的显著性水平设置为P<0.05。
2 结果(Results)
2.1 4,4’-DDT全生命周期暴露对大型溞生长的影响
F0代的体长是大型溞的生长指标。如图1所示,与对照组相比,0.1、1和10 ng·L-1的4,4’-DDT暴露对大型溞F0代的体长在第6天、第21天、第32天和第55天均没有产生显著性的影响。

图1 4,4’-DDT (0.1、1和10 ng·L-1)暴露第6天、第21天、 第32天和第55天对大型溞F0代体长的影响注:数据表示为平均值±标准误。Fig. 1 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the body length of Daphnia magna of F0 generation after exposure to 4,4’-DDT for 6, 21, 32 or 55 dNote: Data was represented by mean±standard deviation.
2.2 4,4’-DDT全生命周期暴露对大型溞生殖的影响
本研究大型溞的子代全部由孤雌生殖得到,整个实验过程中未出现有性生殖现象。大型溞的生殖指标包括平均累积产溞数和F1代体长,分别为生殖数量和生殖质量的指标,综合体现大型溞的繁殖力。如图2(a)所示,与对照组相比,0.1、1和10 ng·L-1的4,4’-DDT暴露对大型溞的平均累积产溞数没有显著性影响。由图2(b)可知,与对照组相比,10 ng·L-1的4,4’-DDT在暴露第21天、第32天和第55天均显著性降低了F1代体长,在这3个时间点体长降低的百分比分别为4.00%、2.70%和3.32%。其余2个浓度组对F1代体长没有显著性影响。

图2 4,4’-DDT (0.1、1和10 ng·L-1)全生命周期暴露对大型溞生殖的影响注:数据表示为平均值±标准误,*代表P<0.05,与对照组相比有显著性差异。Fig. 2 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the reproduction of Daphnia magna after the whole-life-stage exposureNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
2.3 4,4’-DDT全生命周期暴露对大型溞心率的影响
如图3所示,4,4’-DDT全生命周期暴露显著性改变了大型溞的心率。在暴露的第6天和第21天,大型溞的心率在1 ng·L-1和10 ng·L-1浓度组出现了显著性的增加,其他浓度组没有显著性效应;而在第32天和第55天,0.1 ng·L-1的4,4’-DDT对其心率也产生了显著性影响。由此可见,4,4’-DDT对大型溞心率的LOEC在不同的生命阶段出现了变化,随着暴露时间的延长,LOEC从第21天的1 ng·L-1降低为第32天的0.1 ng·L-1,降低了一个数量级。

图3 4,4’-DDT (0.1、1和10 ng·L-1)暴露第6天、 第21天、第32天和第55天对大型溞心率的影响注:数据表示为平均值±标准误,*代表P<0.05, 与对照组相比有显著性差异。Fig. 3 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the heart rate of Daphnia magna after exposure to 4,4’-DDT for 6, 21, 32 or 55 dNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
2.4 4,4’-DDT全生命周期暴露对大型溞行为的影响
由图4可知,4,4’-DDT在不同的生命阶段对大型溞游泳速度的影响是不同的。在暴露第6天,4,4’-DDT显著性增加大型溞的游泳速度,LOEC为0.1 ng·L-1;在第21天,4,4’-DDT对大型溞的游泳速度没有显著性影响;在第32天和第55天,大型溞的游泳速度在4,4’-DDT作用下出现了显著性降低,LOEC均为0.1 ng·L-1。由此可见,随着暴露时间的延长,4,4’-DDT对大型溞游泳行为的影响从促进到无影响到抑制,促进和抑制作用的LOEC均为0.1 ng·L-1。

图4 4,4’-DDT (0.1、1和10 ng·L-1)暴露第6天、 第21天、第32天和第55天对大型溞行为的影响注:数据表示为平均值±标准误,*代表P<0.05,与对 照组相比有显著性差异。Fig. 4 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the swimming speed of Daphnia magna after exposure to 4,4’-DDT for 6, 21, 32 or 55 dNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
2.5 4,4’-DDT全生命周期暴露对大型溞存活的影响
如图5所示,与对照组相比,0.1、1和10 ng·L-1的4,4’-DDT暴露在第6天、第21天、第32天和第55天对大型溞的存活率均没有产生显著性影响。对照组与暴露组的存活率均在暴露第89天降为0%。
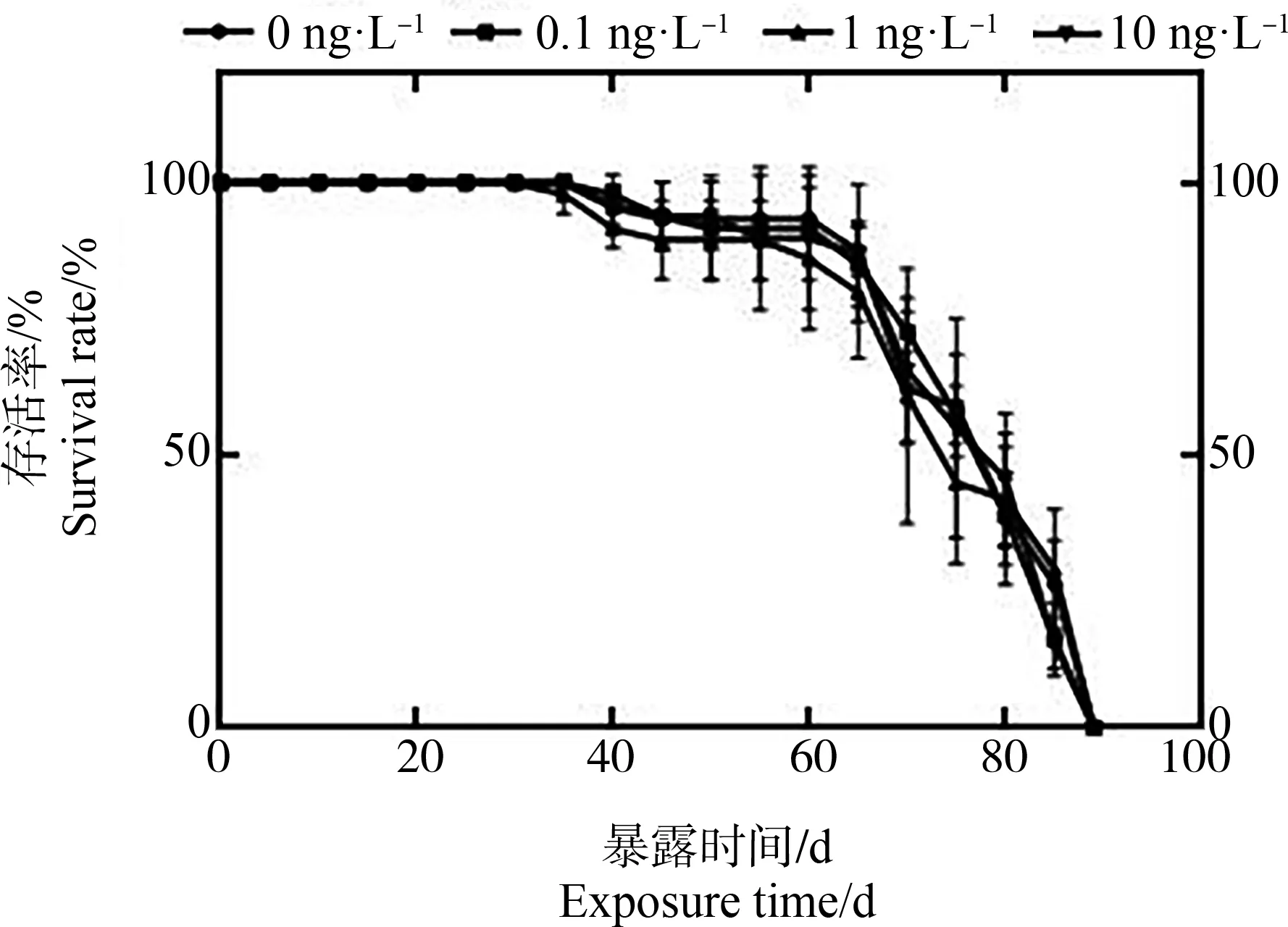
图5 4,4’-DDT (0.1、1和10 ng·L-1)全生命周期 暴露对大型溞存活的影响注:数据表示为平均值±标准误。Fig. 5 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the survival rate of Daphnia magna after the whole-life-stage exposureNote: Data was represented by mean±standard deviation.
2.6 4,4’-DDT全生命周期暴露对大型溞基因转录的影响
图6显示了4,4’-DDT暴露对大型溞阶段特异性PCR array中生长关键基因转录的影响。在生长阶段的17个关键基因中,与对照组相比,有11个基因的转录在4,4’-DDT暴露后发生了显著性变化,这11个基因分布在5条代谢通路中。其中,同源重组(homologous recombination)通路中包含5个基因,分别是rpa1 (DNA-directed RNA polymerase Ⅰ subunit RPA1)、pold1 (DNA polymerase delta subunit 1)、rad54l(DNA repair and recombination protein RAD54 and RAD54-like protein)、rad52 (DNA repair and recombination protein RAD52)、mre11 (double-strand break repair protein MRE11)。其中,rpa1和pold1在10 ng·L-14,4’-DDT暴露下转录显著性上调,rad54l、rad52和mre11在1 ng·L-1或10 ng·L-14,4’-DDT暴露下转录显著性下调。在DNA复制(DNA replication)通路中,rnaseh1(ribonuclease HI)和rfc3_5 (replication factor C subunit 3/5)的转录被显著性下调,而pold1的转录出现上调;在错配修复(mismatch repair)代谢通路中,rpa1和pold1的转录被显著性上调而msh6 (DNA mismatch repair protein MSH6)和rfc3_5的转录被下调;在核苷酸切除修复(nucleotide excision repair)通路中,除了pold1的转录在4,4’-DDT作用下被上调之外,msh6和rfc3_5的转录均是被显著性下调的;在细胞溶质DNA传感途径(cytosolic DNA-sensing pathway)中,有3个基因的转录均出现显著性降低,分别为rpc1_2 (DNA-directed RNA polymerase Ⅲ subunit RPC1)、rpc3 (DNA-directed RNA polymerase Ⅲ subunit RPC3)和rpc1_4 (DNA-directed RNA polymerase Ⅲ subunit RPC1)。

图6 4,4’-DDT (0.1、1和10 ng·L-1)暴露第6天对大型溞生长关键基因转录的影响注:数据表示为平均值±标准误,*代表P<0.05,与对照组相比有显著性差异。Fig. 6 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the vital gene transcriptions at the growth stage of Daphnia magna after exposure to 4,4’-DDT for 6 dNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
总体而言,在这11个转录被显著性改变的基因中,只有2个基因的转录是显著性上调,另外9个基因在4,4’-DDT作用下均出现显著性下调转录。
图7显示了4,4’-DDT暴露对大型溞阶段特异性PCR array中生殖关键基因转录的影响。在生殖阶段的24个基因中有6个基因的转录在4,4’-DDT暴露下出现显著性变化,其中hspa1_8_3 (heat shock 70 kDa protein 1/8)的转录显著性上调,abl1 (abelson tyrosine-protein kinase 1)、pik3c(phosphatidylinositol 3-kinase)、prom1 (prominin 1)、sgrap(RAS guanyl-releasing protein 1)和ptch1 (patched 1)的转录显著性降低。这6个基因分布在4条代谢通路中,分别是慢性粒细胞白血病(chronic myeloid leukemia)通路、癌症中的转录失调(transcriptional misregulation in cancer)通路、剪接体(spliceosome)通路和轴突导向(axon guidance)通路。

图7 4,4’-DDT (0.1、1和10 ng·L-1)暴露第32天对大型溞生殖关键基因转录的影响注:数据表示为平均值±标准误,*代表P<0.05,与对照组相比有显著性差异。Fig. 7 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the vital gene transcriptions at the reproduction stage of Daphnia magna after exposure to 4,4’-DDT for 32 dNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
图8显示了4,4’-DDT暴露对大型溞阶段特异性PCR array中死亡关键基因转录的影响。在死亡阶段的18个基因中,有5个基因的转录在0.1、1或10 ng·L-1的4,4’-DDT暴露下出现了显著性上调,分别为sgcd(delta-sarcoglycan)、glra1 (glycine receptor alpha)、takr2 (tachykinin-like receptor)、crhr1 (corticotropin releasing hormone receptor 1)和ddc(aromatic-L-amino-acid decarboxylase),1个基因的转录被显著性下调,为actb_g1 (actin beta/gamma 1)。其中上调的基因主要集中在扩张型心肌病(dilated cardiomyopathy)和神经活性配体-受体相互作用(neuro active ligand-receptor interaction)这2条代谢通路中。

图8 4,4’-DDT(0.1、1和10 ng·L-1)暴露第55天对大型溞死亡关键基因转录的影响注:数据表示为平均值±标准误,*代表P<0.05,与对照组相比有显著性差异。Fig. 8 The effects of 4,4’-DDT (0.1, 1, 10 ng·L-1) on the vital gene transcriptions at the death stage of Daphnia magna after exposure to 4,4’-DDT for 55 dNote: Data was represented by mean±standard deviation; *represented P<0.05, and compared with control, the exposure group had significant difference.
3 讨论(Discussion)
本研究采用先前建立的大型溞全生命周期毒性评估方法[12],选取美国环境保护局水质基准文件中的环境持久性污染物4,4’-DDT为受试化学污染物及其基准连续浓度为暴露浓度,以毒理学模式生物大型溞为模型开展全生命周期暴露实验,研究依据部分生命周期毒理学数据得出的污染物阈值浓度在全生命周期暴露下对水生生物是否会造成毒性效应。采用已开发的大型溞阶段特异性PCR array探究4,4’-DDT对不同生命阶段关键基因转录的影响。当一条代谢通路中至少有一半基因或者数目≥3个基因的转录在化学污染物的影响下发生显著性变化时,即认为其是受主要影响的代谢通路[28],在本研究中采取同样的规定。
体长是大型溞的生长指标,大型溞快速生长期为出生后的0~12 d,随后体长增长减缓并逐渐趋于稳定,到达平台期。本研究中,10 ng·L-1及更低浓度的4,4’-DDT全生命周期暴露对大型溞的体长没有产生显著性影响,说明该浓度不足以对大型溞造成发育毒性。以往的研究表明,当4,4’-DDT的浓度超过50 ng·L-1时才会使斑马鱼的体长出现显著性降低[29],另一项研究表明,1 μg·L-1的4,4’-DDT暴露对大型溞的生长并没有产生显著性的影响[30]。由此可见,4,4’-DDT对大型溞的发育毒性较低,美国环境保护局水质基准中制定的CCC(1 ng·L-1)对于大型溞的生长没有产生毒性效应。此外,大型溞生长阶段的5条关键代谢通路在4,4’-DDT暴露下均受到了主要影响,其中同源重组(homologous recombination)、DNA复制(DNA replication)、错配修复(mismatch repair)和核苷酸切除修复(nucleotide excision repair)这4条通路内基因的转录既有上调也有下调;而细胞溶质DNA传感(cytosolic DNA-sensing pathway)途径包含的5个基因中有3个的转录在1 ng·L-1或10 ng·L-14,4’-DDT作用下出现显著性下调。细胞溶质DNA传感(cytosolic DNA-sensing pathway)途径中,细胞内模式识别受体的特定家族负责检测来自入侵微生物或宿主细胞的外源DNA,并产生先天免疫应答[31-32],该途径与生物的先天免疫能力紧密相关,对大型溞个体的正常发育至关重要。研究表明,1 ng·L-1或10 ng·L-1的4,4’-DDT暴露显著性抑制了大型溞免疫相关途径中基因的转录,虽然没有造成发育毒性,但可能在一定程度上降低了机体的免疫能力。
在生殖方面,10 ng·L-1的4,4’-DDT浓度组F1代体长出现显著性降低,这说明大型溞的繁殖力降低。一般而言,大型溞投入繁殖活动的总能量是固定的,在产溞总数不变的情况下,为降低总繁殖成本,只能减小子代个体。在食物、温度等外界条件不变的前提下,污染物的胁迫是导致大型溞降低繁殖成本的主导因素。此外,较小的个体在环境中存活的风险更高。因此,10 ng·L-1的4,4’-DDT对大型溞造成了一定的生殖毒性。从基因转录的结果来看,没有受主要影响的代谢通路存在。因此10 ng·L-1的4,4’-DDT对大型溞的生殖毒性可能主要来源于4,4’-DDT胁迫下的应激反应,美国环境保护局水质基准制定的CCC(1 ng·L-1)对于大型溞的生殖没有产生毒性效应。
心率和行为是大型溞毒理学研究中比较敏感的2个指标,经常被用于各种污染物的毒性检测中,近些年相关的研究也得到广泛开展[33-35]。大型溞的心脏位于其头部后方的背侧,其心脏壁和壳瓣均为透明的,心脏搏动可通过显微镜清晰地观察到[36]。大型溞的游泳行为受到生理、感知、神经和肌肉等多方面的影响,并且与其捕食、逃避天敌等行为直接相关[37-38]。这2个生理指标能够更敏感地指示一些环境浓度化学污染物对大型溞的毒性效应,也能作为大型溞的毒性测试中生理指标的补充,在对一些持久性环境污染物进行环境风险评估与环境基准制定时应予以考虑。大型溞有着与哺乳动物类似的肌源性心脏(myogenic heart),其心率对许多污染物表现出的反应与哺乳动物相似[39]。其起搏机制与一组独特的离子通道有关,包括超极化激活、环核苷酸门控(HCN)和T型钙离子通道[40]。心率的变化能够反映出污染物对水生生物能量代谢的影响以及污染物进入血液循环系统的程度[41]。许多研究表明,外源物质能够显著性影响大型溞的心率,且不同的物质表现出的反应不同[41-42]。例如,尼古丁暴露能降低大型溞的心率,而乙醇则能增加其心率[43]。此外,全氟辛烷磺酸(PFOS)会导致大型溞心律失常[44]。我们之前的研究也表明,磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)暴露后大型溞可能死于心脏功能的丧失,并且TDCIPP能够加速心脏功能丧失的进程[12]。本研究中,4,4’-DDT暴露导致大型溞心率的增加可能与其代谢增强相关,机体增加基础代谢从而抵御4,4’-DDT的胁迫。并且随着暴露时间的延长,LOEC的降低说明4,4’-DDT在大型溞体内的不断累积,对大型溞的毒性增强。之前的研究也指出,DDT在大型溞体内具有一定的生物累积性,随着暴露时间的延长,其在大型溞体内的浓度会逐渐升高,并且随着时间的延长,最终浓度可达到几千mg·kg-1[45]。在本研究中,即使是最低浓度的4,4’-DDT(0.1 ng·L-1)也会对大型溞的心率造成显著性影响,说明心率比生长生殖指标更加敏感。研究表明,大型溞的游泳速度随着体长的增长而增加[46],因此影响体长的因素可能也会影响大型溞的游泳速度[24]。本研究中大型溞的体长没有发生显著性变化,因此其体长不是影响游泳速度的因素。有研究发现,蚤状溞(Daphniapulex)的游泳速度随着污染物暴露时间的延长,会先上升到一个峰值,然后降低,这可能是对污染物胁迫短时间内的反应[47]。4,4’-DDT对大型溞游泳速度的影响也是先促进后抑制,并且LOEC均为0.1 ng·L-1。与心率一样,行为参数也比生长和生殖指标更为敏感,因此对于心率和行为而言,美国环境保护局水质基准制定的CCC(1 ng·L-1)在全生命周期暴露下对大型溞表现出一定毒性效应。
在存活方面,10 ng·L-1及较低浓度的4,4’-DDT暴露并没有影响大型溞的平均寿命。之前一项急性毒性研究表明,4,4’-DDT对大型溞14 d的半数致死浓度(lethal concentration 50%, LC50)为670 ng·L-1[48],本研究所设置的浓度相对较低,没有对大型溞产生致死性。死亡阶段基因转录的结果显示,在4,4’-DDT作用下受主要影响的代谢通路只有神经活性配体-受体相互作用通路,该通路是质膜上所有与细胞内外信号通路相关的受体和配体的集合[49],说明4,4’-DDT暴露对大型溞死亡阶段的细胞信号传导具有一定干扰作用。但是总体而言,美国环境保护局水质基准制定的CCC(1 ng·L-1)对大型溞的存活没有造成显著性毒性效应。
总而言之,美国环境保护局水质基准中对4,4’-DDT制定的CCC在全生命周期暴露下对大型溞的生长、生殖和存活均未造成显著性毒性效应,但是对其心率和行为会造成显著的毒性效应。基因转录结果表明,4,4’-DDT在生长阶段和死亡阶段分别改变了大型溞与免疫功能和细胞信号传导功能相关代谢通路中基因的转录。此外对于心率而言,随着暴露时间延长,其LOEC从第21天的1 ng·L-1降低至第32天的0.1 ng·L-1,说明即使在0.1 ng·L-1暴露条件下仍然能够观察到4,4’-DDT对大型溞的毒性效应。因此在对一些持久性环境污染物进行环境风险评估与环境基准制定时,全生命周期毒性测试应得到适当考虑。

