不同产地翠冠梨果的GC-IMS 香气指纹图谱差异性分析
张文君 李慧冬 毛江胜 方丽萍 丁蕊艳 郭长英 颜朦朦 陈子雷,2
(1.山东省农业科学院农业质量标准与检测技术研究所, 山东省食品质量与安全检测技术重点实验室,济南 250100; 2. 山东师范大学生命科学学院, 济南 250014)
作为梨起源中心之一, 我国具有丰富的梨种质资源, 据报道有 13 种和 1 600 多个品种[1], 在世界梨产业中占有重要地位。 近几年, 无论栽培面积还是产量都迅速发展, 梨属新品种也在逐年增加[2~3]。但市售梨果分级粗糙、 品质参差不齐, 品种名称不规范、 产地不清, 优势品牌发展受到一定的限制[4]。
果实香气可以客观反映果实的风味特性及成熟程度, 同时直接决定着果实及其加工品的品质, 显著影响市场竞争力[5~6]。 已有学者针对果品香气物质的鉴定与差异性进行研究, 以期通过了解果品中的香气化学组成[7~8]及各因素影响下梨果香气的差异性, 优化种植品种及产地规划、 选择适宜的采摘时间及贮藏方式[9~11]、 保证果品的品质。 对于不同产地果品及其他农产品, 大量文献报道基于香气指纹信息的产地差异性或判别研究可以通过不同产地产品关键香气筛选与分析, 实现产品产地与真假鉴别[12]。 这方面研究对象主要集中在茶叶[13]、 葡萄酒[14]、 水果[15]、 烟草[16]及咖啡豆[17]等产品, 经研究可以确切了解不同产地产品之间的关键差异性挥发性香气物质, 分别为产品的产地鉴别提供理论依据、 关键鉴别指标、 良好鉴别技术, 进而亦可以据此实现产品质量控制、 特色产区划分、 优势产区选择、 地理标志产品保护、 品牌竞争力提升等。 但目前, 未见基于挥发性香气指纹信息的梨果产地差异性、 产地判别及溯源等方面的报道。
气相色谱-离子迁移质谱 (GC-IMS) 是以气相为基础, 根据气相离子在弱电场中迁移率的不同,快速分析挥发性和半挥发性化合物的技术。 该联用技术借助气相色谱克服了离子迁移质谱技术分离度差的局限性, 结合离子迁移质谱的漂移时间分析,可提供更加丰富的三维化学信息[18]。 相比气相色谱-质谱联用技术 (GC-MS), GC-IMS 技术无需真空, 无需前处理, 灵敏度高、 简单快速并且全面准确[19], 在食品风味分析[20~21]和鉴伪[22~24]方面得到了飞速发展, 通过与化学计量学方法结合,GC-IMS 的分类率甚至可以达到100%, 逐渐成为食品风味品质评价、 食品真伪鉴别和原产地验证等领域的重要技术。 由此, 本研究应用GC-IMS 技术对不同产地梨果中复杂香气物质进行痕量分析,较为全面采集梨果香气物质指纹图谱, 通过主成分和相似度分析, 判定香气之间的差异性, 评价不同产地梨果之间的区分程度, 以期建立一种快速、 准确的梨果产地区分方法, 为梨果产地鉴别及溯源提供理论依据和数据支持。
一、 材料与方法
(一) 材料与设备材料: 翠冠梨果分别采于福州(FZ)、 徐州(XZ)、 南昌(NC)、 武汉(WH)、宿州(SZ)及重庆(CQ)6 地。
设备: FlavourSpec®HS-GC-IMS 食品风味分析与质量控制系统[配有CTC 自动顶空进样器、Laboratory Analytical Viewer (LAV) 分析软件及GC×IMS Library Search Software 定性软件], 德国G.A.S 公司。
(二) HS-GC-IMS 测定条件GC: 载气 N2(纯度≥99.999%); 进样针温度为 45℃; 色谱柱FS-SE-54-CB-1 (15m, ID: 0.53 mm); 固液膜厚度为 1 μm。 载气流量为 0~2 min, 2 mL/min;2~20 min, 2~150 mL/min。 IMS: 漂移管长度为98 mm; 管内线性电压为500 V/cm; 漂移管温度为45℃; 漂移气 N2(纯度≥99.999%); 漂移气流速为 150 mL/min; 放射源为射线 (氚,3H); 离子化模式为正离子。
(三) 测试采集产地相同的梨果, 分别从每个梨果上竖切0.5 cm 厚的梨片, 去掉核果, 每次取3~5 个梨果上果肉 (带皮), 带皮切成0.5 cm×0.5 cm 梨块, 混合均匀, 取 2 g 样品于 20 ml 顶空进样瓶中, 40℃孵化 20 min, 经顶空进样 200 μL,用气相离子迁移谱仪FlavourSpec®进行测试。 每个样品重复2 次。
(四) 数据处理经 LAV 和 GC×IMS Library Search Software 软件分析得出样品中挥发性有机物(volatile organic compounds, VOCs) 的差异谱图,利用美国国家标准与技术研究所 (National Institute of Standards and Technology, NIST) 数据库和 IMS数据库对物质定性分析。 采用SPSS 22.0 进行主成分分析 (principal components analysis, PCA)、 采用R 语言软件进行相似度分析。
二、 结果与分析
(一) 不同产地翠冠梨果中香气物质指纹信息的差异分析由LAV 分析软件分析, 得到6 地翠冠梨中挥发性香气成分的GC-IMS 指纹图谱 (见图 1)。 图中纵坐标为气相保留时间 (retention time, RT), 横坐标为离子迁移时间 (drift time,DT)。 图谱中左侧竖线为反应离子峰 (reactant ion peak, RIP 约为 7.81~7.89 ms)。 RIP 右侧的每一个点代表一种香气物质。 颜色代表物质的浓度, 蓝色表示浓度较小, 红色表示浓度较大, 颜色越深表示浓度越大。 整个谱图即代表了样品的顶空成分。从图1 中可以看出, 翠冠梨果香气组分可以通过GC-IMS 技术很好地分离, 且可直观看出样品间的差异, 如图1 中徐州与福州2 地梨果与其他4 地差异较为明显; 重庆和宿州样品中实线框区域的挥发性组分的含量与其他4 地差异显著; 徐州与福州样品中虚线框区域挥发性组分的种类及含量均与其他4 地有明显不同。 基于挥发性物质的气相色谱保留时间和离子迁移时间对挥发性组分进行定性分析, 以现有软件内置的NIST 保留指数数据库与IMS 迁移时间数据库资料进行鉴定, 共定性出43种挥发性物质 (见表1), 其中酯类是主要的香气物质, 共32 种; 醇类、 醛类及酮类物质也有检出,种数分别为 6 种、 3 种、 2 种。 从峰值总量看, 重庆样品含量最高, 为31 126 V/mV; 其次是徐州、南昌、 武汉, 在 28 678~28 924 V/mV 之间; 宿州和福州最低, 分别为23 920 V/mV、 22 227 V/mV。
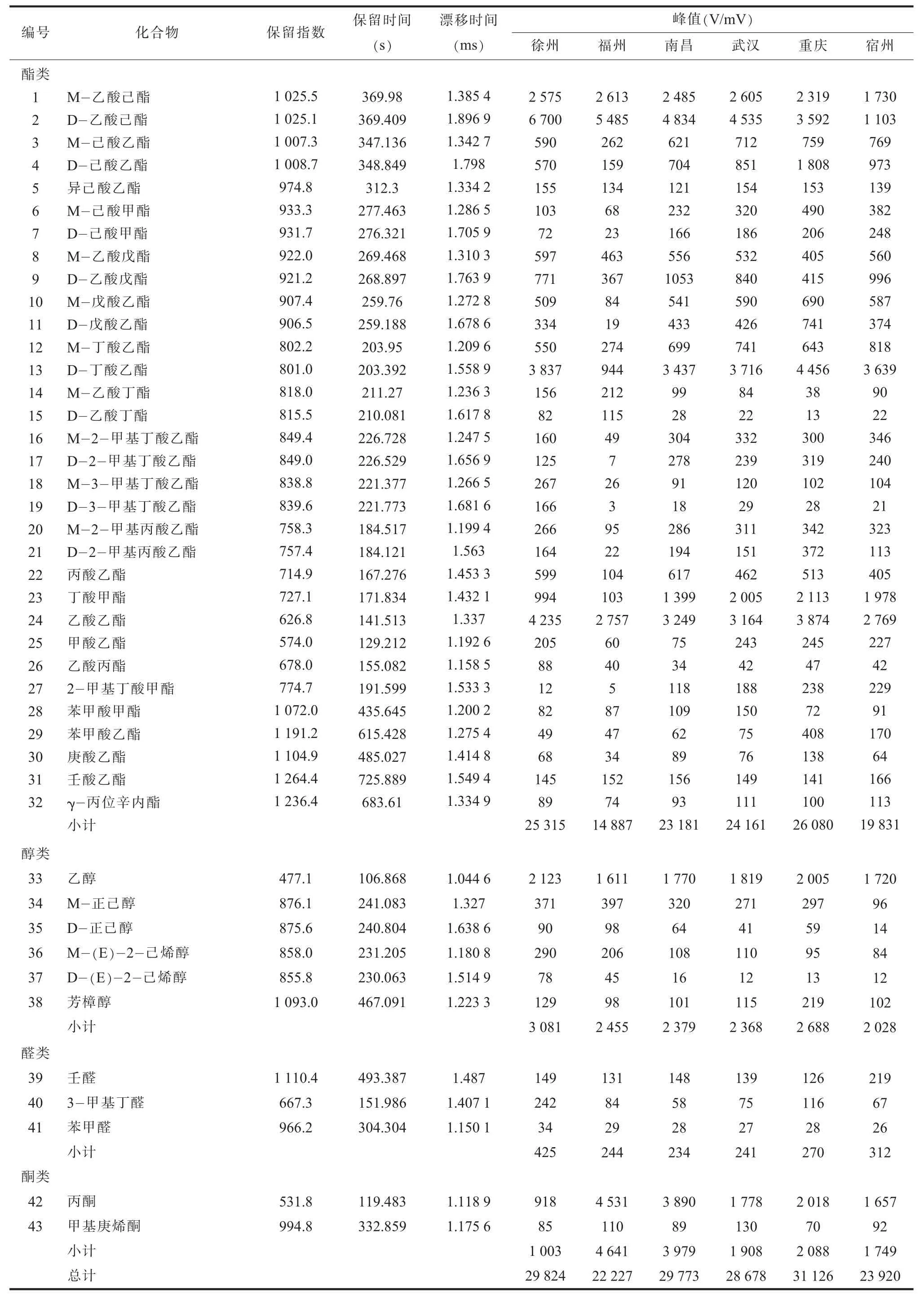
表1 翠冠梨果中主要香气物质
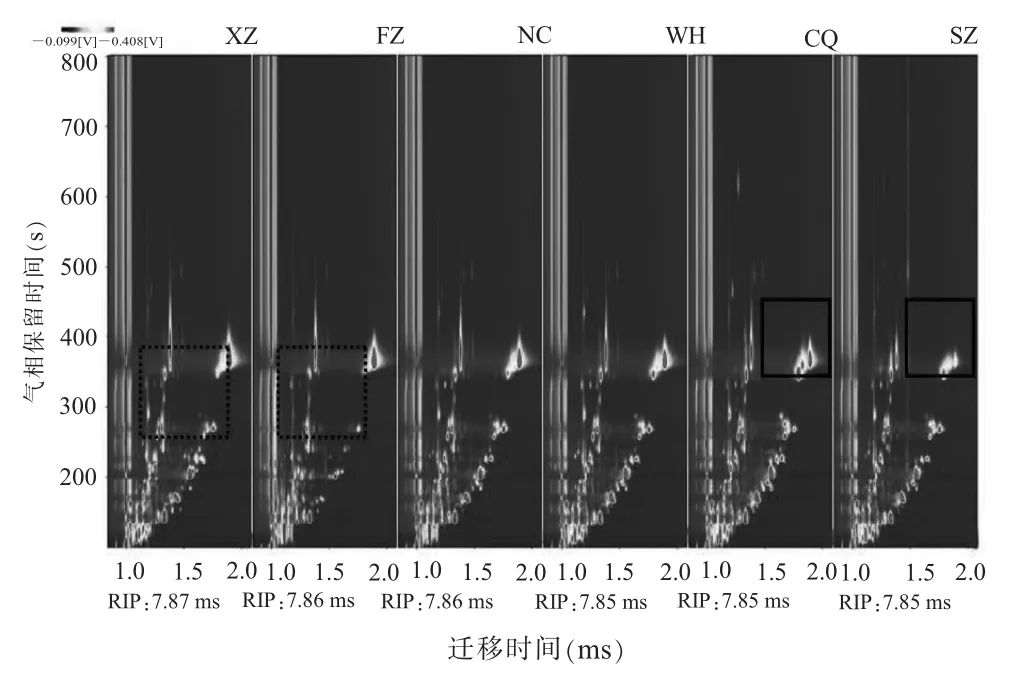
图1 6 地翠冠梨果香气物质离子迁移指纹图谱
为进一步了解不同产区翠冠梨果香气物质的变化情况, 基于Lav 软件的Gallery Plot 分析可以直观看到不同产地之间各香气物质的明显差异 (见图2)。 经纵向比较发现, 福州样品中M-己酸乙酯、M-戊酸乙酯、 D-戊酸乙酯、 M-2-甲基丁酸乙酯、 D-2-甲基丁酸乙酯、 D-丁酸乙酯、 M-2-甲基丙酸乙酯、 D-2-甲基丙酸乙酯、 丙酸乙酯、丁酸甲酯的响应均低于其他5 地; 2-甲基丁酸甲酯、 M-己酸甲酯、 D-己酸甲酯在徐州、 福州样品中响应较低; 甲酸乙酯在福州、 南昌样品中响应较低; D-乙酸己酯在宿州样品中响应较低; 苯甲酸乙酯、 M-3-甲基丁酸乙酯及D-3-甲基丁酸乙酯、 M-乙酸丁酯及D-乙酸丁酯分别只在重庆、徐州、 福州样品中响应较高。 M-正己醇、 D-正己醇在宿州样品中响应较低, 其他产地样品中则较高。 3-甲基丁醛在徐州样品中响应较高, 其余则较低。 丙酮在福州、 南昌样品中有较高响应, 但在徐州样品中响应较低。

图2 6 地翠冠梨果Gallery Plot 分析
结合表1 进行定量分析, 重庆样品中的酯类物质总峰值 (26 080 V/mV) 高于徐州 (25 315 V/mV)、 南昌 (23 181 V/mV)、 武汉 (24 161 V/mV), 明显高于宿州 (19 831 V/mV) 与福州(14 887 V/mV)。 主要酯类物质为D-乙酸己酯、乙酸乙酯、 D-丁酸乙酯、 M-乙酸己酯、 丁酸甲酯、 D-己酸乙酯、 D-乙酸戊酯; D-乙酸己酯在徐州样品中响应峰值可达6 700 V/mV, 但在宿州样品中仅有1 103 V/mV; 乙酸乙酯在徐州和重庆样品中含量较高, 分别为 4 235、 3 874 V/mV, 其余样品中峰值在2 757~3 249 V/mV 之间。 醇类物质总峰值在徐州样品中最高, 为3 081 V/mV, 其余样品在2 368~2 688 V/mV 之间; 主要醇类物质为乙醇、 M-正己醇、 M-(E) -2-己烯醇、 芳樟醇; 乙醇的峰值在 1 611~2 123 V/mV 之间, 为M-正己醇的 4~8 倍, 为 M-(E)-2-己烯醇的6~22 倍, 在徐州样品和重庆样品中响应较高; 芳樟醇在各样品中均有响应, 峰值在98~219 V/mV之间, 重庆样品中的响应是其他4 地1.5 倍多。 醛类物质总峰值同样在徐州样品中最高, 为425 V/mV, 其余样品中响应值均≤312 V/mV; 主要醛类为壬醛和3-甲基丁醛; 壬醛在宿州样品中响应最高, 是其他5 地的1.5 倍多; 3-甲基丁醛在徐州样品中响应最高, 是其他5 地的2 倍多。 福州与南昌样品中酮类物质总峰值较高, 分别为4 641、3 979 V/mV, 是武汉、 重庆及宿州样品的 1.5 倍多, 徐州样品的4 倍多; 丙酮为主要酮类物质, 其峰值变化与总酮类峰值变化一致。 由此发现6 地翠冠梨果中各类香气物质峰值因梨果产地不同而有较大差异。
(二) 不同产地翠冠梨果香气物质的主成分分析通过SPSS 22.0 软件, 对6 地翠冠梨样品 43个香气物质进行PCA, 分析得到各主成分的特征值、 方差贡献率、 累积方差贡献率 (见表 2)。 由表 2 可知, 特征值>1 的共 6 个主成分, 总方差99.71%的贡献率来自前6 个主成分, 其方差贡献率依次为 43.54%、 20.08%、 13.69%、 8.58%、8.29%和5.53%; 说明3 个主成分反映了原始变量的大部分信息。
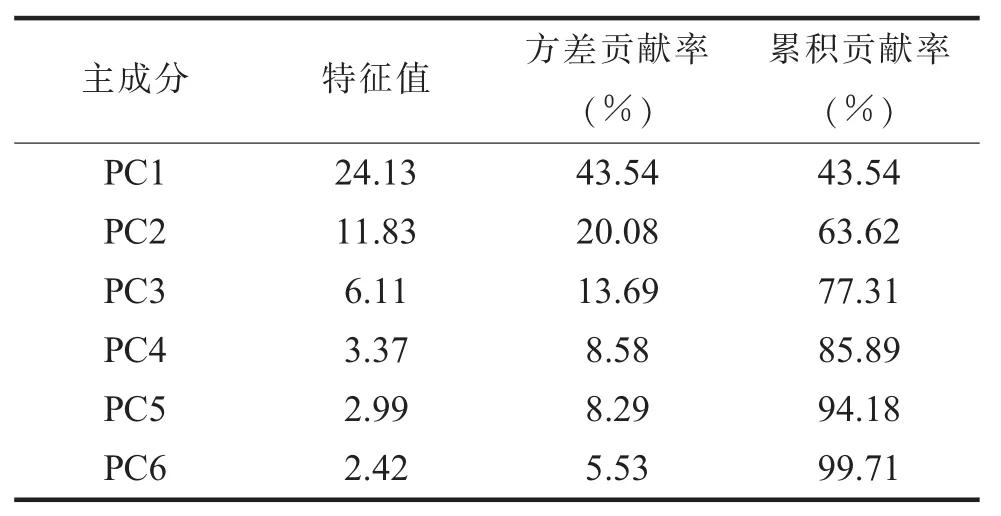
表2 主成分方差贡献率
根据主成分载荷得分可知, PC1 中载荷较高的正影响挥发性物质主要有D-2-甲基丁酸乙酯、D-戊酸乙酯、 M-戊酸乙酯、 丁酸甲酯、 M-2-甲基丙酸乙酯、 D-己酸乙酯、 M-己酸乙酯、 M-己酸甲酯、 D-丁酸乙酯、 M-2-甲基丁酸乙酯、 庚酸乙酯、 D-2-甲基丙酸乙酯、 2-甲基丁酸甲酯,其中D-2-甲基丁酸乙酯的载荷量最高, 为0.977;载荷较高的负影响挥发性物质有M-乙酸丁酯、D-乙酸丁酯, 最高载荷量为0.986。 PC2 中载荷较高的正影响挥发性物质主要有乙酸丙酯、 M-3-甲基丁酸乙酯、 D-3-甲基丁酸乙酯、 3-甲基丁醛、乙醇, 其中乙酸丙酯的载荷量最高, 为0.958; 载荷较高的负影响挥发性物质有丙酮, 其载荷量为0.818。 PC3 载荷较高的正影响挥发性物质主要有壬醛, 载荷量为0.844; 载荷较高的负影响挥发性物质有M-乙酸己酯、 M-正己醇, 其中M-乙酸己酯的载荷量最高, 为0.905。 上述物质为不同产地翠冠梨果产区区分的主要贡献者。
选取6 地翠冠梨果主成分得分绘制散点图 (见图3), 发现平行样品两两聚到一起, 但不同样品完全区分开; 6 地梨果产区辨别度较高, 均能良好区分; 徐州和福州2 地样品与其他4 地差异较大。

图3 不同产地翠冠梨果香气物质的主成分分析
(三) 不同产地翠冠梨果的相似度分析利用LAV 软件分析每种挥发性有机物信号峰的相对强度, 以样品中某物质浓度最大的信号峰定义为1,据此比较其他样品中该物质信号峰的强度, 可推断出该挥发性有机物在不同样品中的相对浓度, 综合分析挥发性有机物的种类与相对浓度可以推断出样品的相似匹配度, 直观反映翠冠梨果样品之间的差异和区分度。 通过R 语言, 得到不同产地翠冠梨果香气物质的匹配矩阵 (见图 4)。 如图4 所示,颜色越靠近红色, 匹配度高, 表示相似程度越高,区分度越低。 由图中看出从香气成分差异上看, 匹配度≥95%时 (红色区域), 6 地翠冠梨果各自仅与同产地梨果相匹配; 当匹配度在90%~95%时(橙色区域), 样品中仅有5%~10%的不同特征成分或成分含量明显差异, 此时6 地样品仍仅与同产地梨果相匹配, 具有良好辨识性; 当匹配度在80%~90%时, FZ、 XZ 及 CQ 样品中的香气特征指纹与其他样品差异明显, 有较高识别性。 NC、SZ、 WH 也能较好辨识, 仅分别和 WH、 WH、 NC及SZ 有一定的相似性。 表明当匹配度≥90%时,HS-GC-IMS 指纹特征谱图中差异特征成分分析可以准确区分6 地翠冠梨果。

图4 不同产地翠冠梨果的匹配矩阵
三、 结论
相对于传统的 GC-MS 法, GC-IMS 技术操作简单, 无需样品前处理, 20 min 即可完成香气指纹信息的采集, 且GC-IMS 法样品处理及分析的温度较低, 可促使热稳定性较差的挥发物能够更真实地被检出, 实现挥发性组分更全面、 精确度更高的分析。 近几年来该技术在食品风味挥发物的定性定量分析及差异性分析中运用广泛, 但是未见在梨果香气物质研究中的应用。 因此本实验选择翠冠梨果为研究对象, 运用GC-IMS 技术分析不同产地梨果挥发性香气指纹图谱, 通过信号峰的数量及强度综合判断不同产地翠冠梨果挥发性香气物质的差异程度; 根据样品PCA 分析及相似度分析发现GC-IMS 技术采集的香气指纹图谱信息可以区分不同产地翠冠梨果, 这为梨果挥发物差异性分析、快速准确的产地区分提供了一条新途径。 在此基础上, 若通过大量样本的监测和大数据分析, 可积累大量基于挥发性香气物质的梨果产地溯源理论基础, 为实现梨果产地溯源模型的建立及修正提供可行依据; 基于挥发性香气物质的差异性筛选, 联合代谢组学、 转录组学分析等, 可深度研究产地的因素、 果园管理过程等如何影响梨果香气物质的变化, 为优化梨果种植及品质提升提供重要理论参考, 同时基于挥发性香气物质指纹图谱的梨果GC-IMS 差异性分析也将在梨果品质评价、 品种选育、 香气物质数据库的建立、 梨果加工工艺优化等方面具有良好的应用前景。

