马蓝染色体制片技术优化
赵云青 黄颖桢 刘保财 陈菁瑛 张武君 俞静

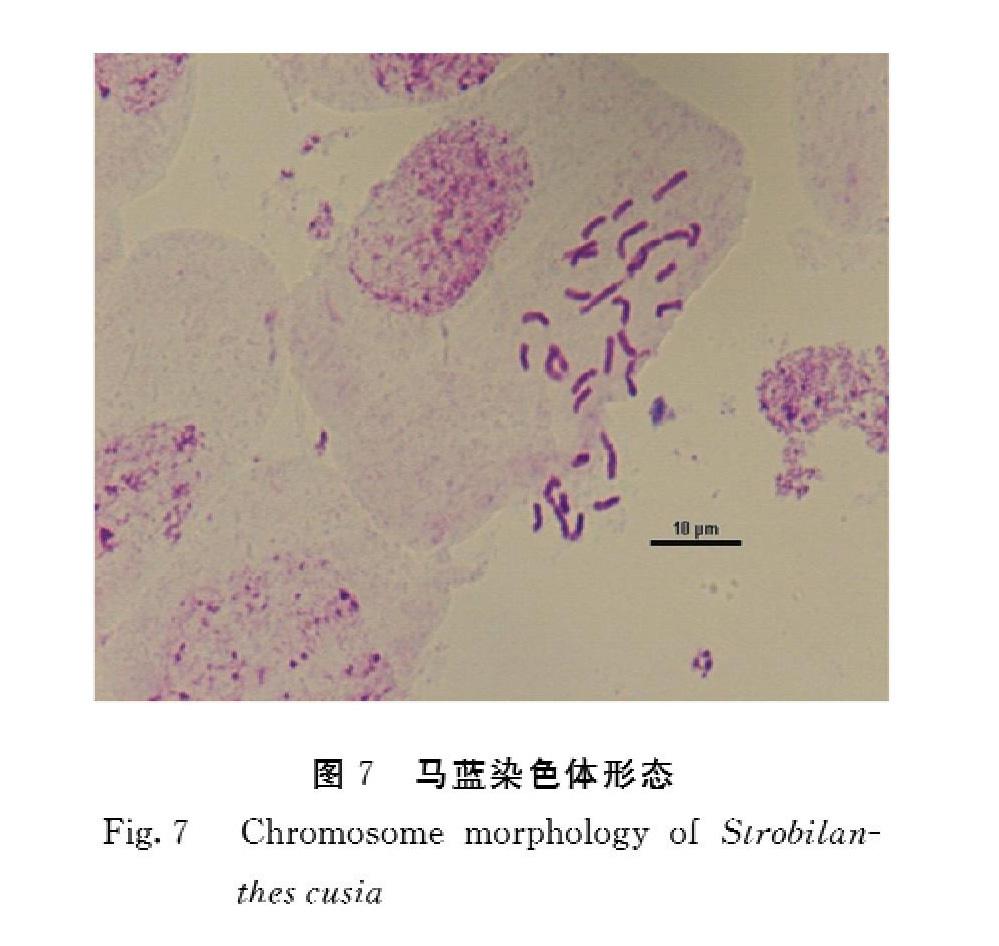
摘 要:以莆田地区马蓝分生组织为材料,采用压片技术,探讨马蓝不同取材部位、不同取材时间、不同预处理试剂处理、不同解离时间等对马蓝染色体制片的影响,并进行核型分析。结果表明:以根尖分生组织为材料,在上午8:00、8:30取材,用0.1%秋水仙素溶液室温预处理0.5 h,用卡诺液固定4 h,然后用1 mol·L-1盐酸在60℃水浴8 min,卡宝品红染色8 min,可获得分散良好,形态清晰的染色体。核型分析表明,马蓝染色体为32条,马蓝的核型公式是2x=2n=32=4sm+28m,核型类型为1 B,不对称系数为59.54%。说明莆田地區马蓝在相对稳定的自然环境中进化速度缓慢。
关键词:马蓝;常规制片;染色体;核型分析
中图分类号:S 567.239 文献标志码:A 文章编号:0253-2301(2021)07-0001-09
DOI: 10.13651/j.cnki.fjnykj.2021.07.001
Technology Optimization of the Preparation of Chromosomes in Strobilanthes Cusia
ZHAO Yunqing1,2, HUANG Yingzhen1,2, LIU Baocai1,2, CHEN Jingying1,2*, ZHANG Wujun1,2, YU Jing1,2
(1. Institute of Agricultural Biological Resources, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China;
2. Medicinal Plant Research Center, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China)
Abstract: By taking the meristem of Strobilanthes cusia cultivated in Putian as the material and using the conventional method, the effects of different sampling sites, sampling time, pretreatment with different reagents and dissociation time on the preparation of chromosomes in Strobilanthes cusia were studied, and the karyotype was analyzed. The results showed that: by taking the root apical meristem as the material, the root apical meristem was sampled at 8:00 and 8:30 a.m., pretreated with 0.1% colchicine solution at room temperature for 0.5 h, fixed with Carnoy for 4 h, and then bathed with 1 mol·L-1 hydrochloric acid at 60℃ for 8 min, and stained with carbol fuchsin for 8 min, thus the chromosomes with good dispersion and clear shape could be obtained. The karyotype analysis showed that there were 32 chromosomes in Strobilanthes cusia. The karyotype formula of Strobilanthes cusia was 2x=2n=32=4sm+28m, the karyotype was 1 B, and the asymmetry coefficient was 59.54%. It indicated that the evolution rate of Strobilanthes cusia cultivated in Putian was slow in the relatively stable natural environment.
Key words: Strobilanthes cusia ; Conventional preparation; Chromosome; Karyotype analysis
马蓝 Baphicacanthus cusia (Nees)Bremek又称板蓝,为爵床科板蓝属草本植物,主产地为福建、四川、云南、湖南、江西、贵州、广东、广西等。马蓝根、茎、叶均可入药,在我国各个地区广泛应用。叶或茎叶经加工制得的干燥粉末、团块称为青黛,青黛为福建省道地药材,具有清热解毒、凉血消斑、清肝泻火、定惊的功效,主治温毒发斑、血热吐衄、咽痛口疮、火毒疮疡、咳嗽胸痛,痰中带血、暑热惊痫、惊风抽搐等。马蓝干燥根和根茎称为南板蓝根,具有清热解毒、凉血消斑的功效,用于温疫时毒、发热咽痛、温毒发斑、丹毒。其干燥茎叶称为南板蓝叶,具有清热解毒、凉血止血的功效,主治温热病、高热头痛、发斑、肺热咳嗽、湿热泻痢、黄疸、淋巴结炎、肝痈、肠痈等[1]。
前人在马蓝人工栽培[2-4]、药用成分、加工炮制[5]等方面进行了较多研究,研究证明马蓝主要含有生物碱、萜类、香豆素酚类、甾类、黄酮类、多炔类、皂苷、木脂素等植物次生代谢产物[6]。马蓝含有的大黄酚具有平喘、止咳、缩短血液凝固时间、兴奋神经、麻痹肌肉、利胆、保肝、利尿[7]、抗菌和抗癌的作用,以及免疫抑制、抗炎、降血脂、泻下[8]及改善糖代谢异常等作用。马蓝研究中发现的生物碱类包括吲哚类生物碱(靛玉红、靛蓝、异靛蓝等)、喹唑酮类生物碱和其他类型生物碱等。生物碱药理活性多样[9-10],靛玉红具有抗肿瘤作用[11],是抗白血病的有效成分,对多种动物移植性肿瘤有较强的抑制作用[12],对慢性粒细胞白血病有较好的疗效[13]。靛蓝可作为着色剂用于染色,还具有抗炎、杀菌作用。国内外学者对靛蓝、靛玉红的物质形成机理等进行了相关研究[14-16]。
近年来马蓝越来越受到关注,马蓝市场需求越来越大,但存在马蓝产量低、野生资源紧缺、栽培马蓝种质退化、成分不稳定等问题。染色体是生物遗传物质的载体,获得的染色体数目和核型在物种系统分类、起源与鉴定、亲缘关系分析等方面具有重要的应用价值。高质量的染色体制片是进行核型分析和原位杂交的保障[17],染色体核型分析技术可识别各个染色体的特征,有助于基因定位的研究,是细胞遗传学的一项基本技术,此技术还可用于染色体工程、细胞分类学和植物育种学、基因组研究等[18-19],植物基因组研究可阐述物种分类地位、起源进化,解析次生代谢物的合成通路,解析环境适应性,阐明重要、特殊表型的调控和形成机制,研究结构变异、基因分型等。
染色体制片技术是指显示染色体的一般形态和结构的技术,染色体制片技术主要有压片法和去壁低渗干燥法等。压片法对去壁要求较低且材料不易丢失,该法适用于大量材料的倍性鉴定、染色体计数、初步的染色体形态观察[20-21]。染色体制片技术成功的关键是获得大量染色体缩短适宜的分裂细胞,压片法还存在压片力度较难把握,染色体不易分散等难点。目前,马蓝染色体压片技术优化仅有吴瑞霞[22]对常规压片技术中的取材部位、取材时间、预处理液、预处理时间、解离方法进行了优化,并对4个地点的马蓝的核型进行分析。本试验在此基础上对马蓝染色体压片技术进行了取材部位、取样时间、预处理液、盐酸解离时间、染色液及染色时间的优化,进一步精细优化了马蓝染色体压片技术,获得清晰、分散度良好的染色体制片,并进行了核型分析,为马蓝后续研究提供支持。
1 材料与方法
1.1 试验材料
供试材料马蓝 Strobilanthes (Nees)Bremek采集自福建莆田仙游,扦插在福建省农业科学院药用植物资源圃,经本课题组鉴定为爵床科板蓝属植物马蓝 Strobilanthes cusia (Nees)Bremek。
1.2 试验方法
1.2.1 不同取材部位选择 取马蓝半木质化枝条采用育苗基质进行扦插,取样前,将生根的马蓝置适当低温(4~10℃)暗培养12 h后转25℃下处理12 h,重复2次,提高细胞分裂指数。于上午8:00分别取马蓝植物根尖、茎尖、嫩叶放入预处理液0.1%秋水仙素中处理0.5 h,取出材料冲洗干净,置于卡诺氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。将固定后的材料投入1 mol·L-1盐酸溶液中60℃水浴解离8 min[13-15]。解离完后清洗材料3~5次,将材料置于载玻片上,滴清水,用镊子将材料捣碎后去掉全部大块组织,在带有细小组织的清水上直接滴加卡宝品红溶液[16]染色8 min。盖上盖玻片,滤纸从盖玻片两侧吸掉过剩的卡宝品红溶液后,手指在滤纸外固定住盖玻片,用铅笔橡皮头的先沿着盖玻片对角线敲击,后再细细敲击整个盖玻片(1~2 min),使材料成分散均匀,在显微镜下观察拍照。
1.2.2 不同取样时间优化 于上午6:00至11:30每隔0.5 h取1次根尖,约2 mm,放入预处理液0.1%秋水仙素中处理0.5 h。预处理完后续操作同1.2.1。
1.2.3 不同预处理液处理 于上午8:00取马蓝植物根尖放入表1预处理液中进行预处理,预处理完后续操作同1.2.1。
1.2.4 解离时间优化 于上午8:00取马蓝植物根尖放入预处理液0.1%秋水仙素中处理0.5 h,取出材料冲洗干净,置于卡诺氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。将固定后的材料投入1 mol·L-1盐酸溶液中60℃水浴解離4、6、8、10 min[23-25]。解离完后续操作同1.2.1。
1.2.5 染色液及染色时间优化 于上午8:00分别取马蓝植物根尖放入预处理液0.1%秋水仙素中处理0.5 h,取出材料冲洗干净,置于卡诺氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。将固定后的材料投入1 mol·L-1盐酸溶液中60℃水浴解离8 min[23-25]。解离完后清洗材料3~5次,将材料置于载玻片上,滴清水,用镊子将材料捣碎后去掉全部大块组织,在带有细小组织的清水上滴加醋酸洋红或卡宝品红溶液[26]染色6 min,后续操作同1.2.1。选取效果佳的染色液分别染色4、6、8、10 min,后续操作同1.2.1。
1.2.6 马蓝染色体核型分析的方法 用NIKON NiUF2正置显微镜观察,NISElements D版软件拍照系统拍照,在显微镜下对处于分裂中期的细胞进行计数。选择30个染色体分散且形态较好的细胞进行染色体数目统计,其中85%以上细胞具有恒定一致的染色体数,即可认为是该植物的染色体数目[17]。核型分析方法根据李懋学等[17]的标准划分。
臂比 (r)=长臂(S)/短臂(L); 染色体相对长度=染色体长度/染色体组总度×100%;
按Arano[27]的方法,核型不对称系数=长臂总长/全组染色体总长×100%,比值越大越不对称。按Levan等[28]方法根据臂比值确定着丝点的命名。
核型分类:按Stebbins[29]的方法,根据臂比值大于2的染色体百分比和最长染色体与最短染色体之比来判定核型类型。
2 结果与分析
2.1 马蓝染色体制片压片法技术优化
2.1.1 不同取材部位对马蓝染色体制片效果的影响 于上午8:00取马蓝的根尖、茎尖及嫩叶,从图1可知,不同取材部位对马蓝染色体制片效果影响较大,3种材料细胞核区最大的为根尖,其次为茎尖及嫩叶。根尖可获得较多的分裂相,嫩叶及尖分裂相细胞较少,染色质浓缩,未见可用于染色体分析的制片。从细胞形态来看,根尖细胞背景干净,染色体较分散,利于染色体计数及后期核型分析,可作为最佳染色体核型处理部位。取样前,将生根的马蓝扦插秒置适当低温(4~10℃)暗培养12 h后转25℃下培养12 h,重复2次,此方法可显著提高细胞分裂指数。
2.1.2 不同取材时间对马蓝染色体制片效果的影响 以根尖为材料,于6:00~11:30每隔0.5 h取样1次,共取样12次,不同取样时间获得的染色体制片效果见图2。由图2可知,6:00(A1)取样材料未获得分裂相,染色体计数及观察。6:30(B2)、7:30(C2)取样可获得较多分裂相,但染色体有重叠,虽然可用于染色体计数,但不利于后期染色体核型分析。8:00(E2)、8:30(E2)取样获得的染色体分散,形态清晰,可用于染色体计数及后期形态观察。取样时间为9:00、9:30、10:00、11:00时获得的染色体制片见图G2~I2,取材细胞处于分裂期后期,可以进行染色体计数等观察,但染色体较密集、浓缩,不利于核型分析。10:30(I2)、11:30(J2)取样获得的染色体制片可获得分裂相,但染色体较聚集,有重叠,不利于核型分析。综合分析适宜进行马蓝染色体分析的根尖取样时间为上午8:00(E2)、8:30(F2),可获得染色体分散良好、清晰的制片。
2.1.3 不同预处理试剂对马蓝染色体效果的影响 预处理是否适宜是染色体制片技术最关键的操作步骤。试验采用6种不同预处理液对马蓝根尖进行预处理,不同预处理液对染色体制片效果影响见图3,结果表明0.1%秋水仙素溶液中室温预处理0.5 h效果最好,见图B3,细胞背景干净,染色体缩缢程度合适,分散适宜且清晰,易于统计染色体数及进行核型分析;0.2%秋水仙素溶液(C3)中室温预处理0.5 h及0.1%秋水仙素与8羟基喹啉混合液(D3)室温处理0.5 h效果较好,细胞背景较干净,染色体较清晰,可用于染色体计数,但有重叠,不利于后期染色体形态观察及核型分析;饱和对二氯苯溶液处理后制片效果见图E3,细胞背景较干净,染色体有分散,但重叠部分较多;8羟基喹啉处理后的制片效果如图F3,细胞背景干净,可见分裂相,但是染色体浓缩,无法进行后续观察;0.05%秋水仙素处理后未观察到分裂中期染色体,无法进行染色体后续观察。本研究还在前期预试验中先用0.05%秋水仙素溶液4℃处理24 h,再用冰水混合物处理24 h,未观察到分裂相,单独用冰水混合物处理24 h也未得到分裂相。综上所述试验中筛选出最适合的预处理液为0.1%秋水仙素溶液,在室温下对马蓝根尖预处理0.5 h可获得染色体形态清晰、易于计数及观察的制片。
2.1.4 不同解离时间对马蓝染色体制片效果的影响 压片中组织的解离主要用盐酸,使细胞壁之间的中层果胶物质以及部分细胞质分散,而使细胞易于分散,同时也可使细胞壁软化而易于压片。试验采用1 mol·L-1盐酸溶液60℃水浴解离4、6、8及10 min,比较不同解离时间对马蓝细胞染色体制片的影响。结果如图4,解离浴4、6 min后获得的制片细胞未分散,染色体较小,无法进行染色体计数及后期染色体观察,而解离10 min时细胞分散,但细胞壁破裂,出现2~3个细胞染色体混合的现象,解离8 min后获得的制片细胞分散程度适宜,细胞壁完整,染色体清晰,观察效果最佳。因此,马蓝染色体制片最佳解离方式为1 mol·L-1盐酸溶液在60℃水浴中解离8 min,可获得细胞分散适宜,染色体清晰,易于观察及计数的制片。
2.1.5 不同染色液及卡宝品红染色时间对马蓝染色体染色效果的影响 本研究先采用醋酸洋红和卡宝品红溶液两种染色液分别染色4、6、8及10 min,然后进行染色效果比较结果见图5。由图5可知,卡宝品红染色液可将染色体染为红色,利于进行染色体观察,而醋酸洋红未获得理想染色效果,总之卡宝品红染色液染色效果优于醋酸洋红染色液。因醋酸洋红进行染色后染色體颜色均不明显,获得的制片杂质较多,不利于观察,故后期未进行不同染色时间的比较,仅进行卡宝品红不同染色时间的效果比较。卡宝品红不同染色时间效果见图6、由图6可知,卡宝品红溶液染色6 min时获得的染色体颜色偏淡,个别染色体尾部不明显,不利于染色体核型分析;卡宝品红溶液染色8 min后获得的染色体较清晰,易于分辨,利于染色体观察;染色10 min获得的染色体颜色偏深,虽然染色体也较清晰,但整体视觉效果略差。综上马蓝染色体制片最佳染色处理为卡宝品红染色8 min,可节约时间,同时获得染色体清晰、利于观察的制片。
2.2 马蓝染色体核型分析
2.2.1 染色体数目 核型分析主要以染色体相对长度、臂比等为依据。选择30个细胞进行染色体计数,选择形态清晰、分散良好的染色体进行核型分析。结果表明马蓝染色体数目为28~32条,其中27个细胞的染色体数为32条,超过总数的85%,综上马蓝染色体的数目为2n=32。
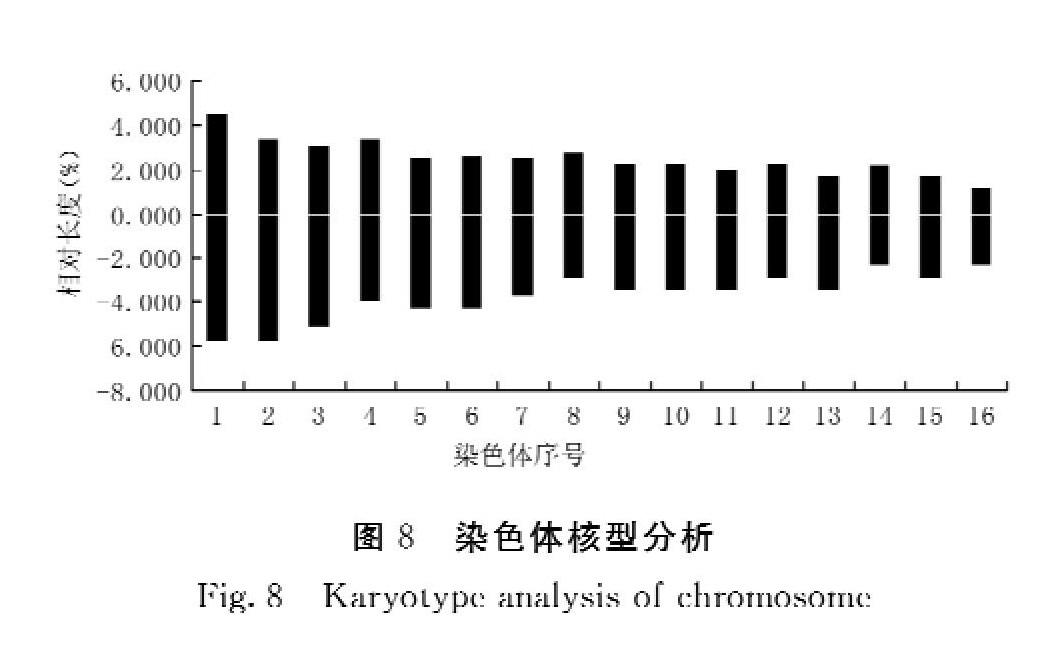
2.2.2 染色体核型特征 获得的马蓝染色体核型参数及形态如表2及图7,结果表明,马蓝染色体核型公式为2x=2n=32=4sm+28m,其中包含了4个亚中部着丝点染色体(sm),28个中部着丝粒染色体(m)。染色体相对总臂长3.428%~10.285%,最长与最短染色体长度比值为3.00,臂比值范围为1.013~1.988,没有臂比值大于2的染色体,核型不对称系数为1B型。核型不对称系数为59.54%。
3 讨论与结论
本试验从马蓝染色体制片压片法的优化着手,对马蓝染色体制片取材的选择、预处理方法、预处理时间、解离时间、染色液选择与染色时间等方面进行筛选,获得马蓝染色体制片压片技术。结果表明上午08:00、08:30取马蓝根尖0.1%秋水仙素室温预处理0.5 h,然后用1 mol·L-1盐酸溶液在60℃水浴中解离8 min,卡宝品红染液染色8 min,可获得染色体清晰、分散度良好的制片。制片过程中预处理时间影响染色体的形态,处理时间过短会出现染色体拖尾现象,而时间过长染色体会凝缩过度。在取材方面李懋学等[17]认为凡能进行细胞分裂的植物组织或单个细胞都可用于染色体观察,但在植物生长发育的过程中,其分生组织或细胞分裂活动,除有自身发育的阶段性外,还受外界环境条件的影响,需要充分掌握其机构及生长发育规律,了解具体植物的生长发育特性,创造适宜的环境条件才能准确获得制备优良染色体的材料。本试验通过变温处理[22]及不同取材部位分析,确认获得马蓝染色体优良染色体的取材部位为根尖。压片时蒿若超等[30]改良的压片技术是先用镊子将材料捣碎后,再将盖玻片放置于上方,笔者在制片过程中将材料压碎后去除全部大块组织,可减少杂质,获得的染色体更清晰。
吴瑞霞[22]研究中对不同地点的马蓝进行核型分析,其中福州本地栽培马蓝的核型类型为3B,染色体数量为32条,南平茫荡山马蓝的核型类型为2B,染色体数量为32条。本试验中材料取自福建莆田的马蓝核型类型为1B,染色体数量为32条。Arano[28]认为,当核型不对称系数低于60%时,核型对称性较高;反之则较低。一般来讲核型进化的基本趋势是由对称向不对称发展的,系统演化上处于比较古老和原始的植物,大多具有较对称的核型,而不对称的核型常见于衍生、特化以及比较进化的植物类群中[31]。对称程度越高,其染色体变异越小,进化程度越低,相反则染色体变异越大,进化程度越高,由此莆田的马蓝类型偏原始。但马蓝核型类型不同可能因为选用的品种、生长环境而形成差异,而染色体数量受品种、生长环境影响较小,形成差异的可能性也小。
致谢:本试验中得到福建农林大学潘大仁老师的悉心指导,在此表示衷心感谢。
参考文献:
[1]国家药委员会.中华人民共和国药典2020版一部[M].北京:化学工业出版社,2020:208.
[2]陈晓庆.南板蓝(马蓝)栽培的关键技术研究[D].广州:广州中医药大学,2011.
[3]李秋菊.冬季栽培马蓝正当时[J].特种经济动植物,2006(11):30-31.
[4]姚洪源,莫礼龙,田华林,等.马蓝高产栽培技术[J].林业实用技术,2010(6):45-46.
[5]黄玉香.马蓝药效物质形成关键基因的挖掘与功能研究[D].泉州:华侨大学,2017.
[6]曾美娟,刁勇.马蓝次生代谢产物研究进展[J].中国农学通报,2016,32(32):30-34.
[7]马燕如,赵肖玉,徐正.大黄酚和大黄酸的合成[J].合成化学,2007,15(2):244-246.
[8]李鋒,王胜春,王新,等.大黄泻下效应的药理学新解释[J].中国中药杂志,2008,33(4):481-483.
[9]李振涛,朱奇,纪宇.植物生物碱抗肿瘤作用机制的研究进展[J].药学进展,2005,29(5):193-197.
[10]沈以红,朱见,李竞.植物生物碱在医药领域的研究与应用[J],蚕学通讯,2008,1(28):25-31.
[11]BARARA C S,MIRZA M H,BARBARA H K,et a1.Transinet induction of cytohromes P450 1A1 and 1B1 in MCF7 human breast cancer cells by indirubin[J]. Biochemical Pharmacol, 2003,66:2313-2321.
[12]NAI K M,CHUNG Y L,XIAO Y W,et al.Inhibtion of RANTES expression by in influenza virusinfected humanbronchial epithelial cell[J]. Biochemical Pharmacol, 2004,67(1):167-174.
[13]吴莲明,杨尧平,朱传先,等.青黛治疗慢性粒细胞白血病有效成分的研究(I)报[J].中草药通讯,1978,4:5-8.
[14]黄以钟,潘大仁,王占成,等.不同生长时期对马蓝药效成分的影响[J].中国农学通报,2009,25(16):75-78.
[15]向小亮,宁书菊,黄延龄,等.外源水杨酸对马蓝叶片中蛋白水平表达的影响[J].应用生态学报,2010,21(3):689-693.
[16]王金坤,成美林,徐艺玮,等.植物靛蓝染料的生物制备[J]. 针织工业,2020(3):40-44.
[17]李懋学,张杶方.植物染色体研究技术[M].哈尔滨:东北林业大学出版社,1991.
[18]杨汉民.细胞生物学实验[M].北京: 高等教育出版社,1997: 208.
[19]王丽平.黄杨属五种植物的核型分析[D].南京:南京林业大学, 2010.
[20]陈瑞阳,宋文芹,李秀兰.植物染色体标本制备的去壁、低渗法及其在高胞遗传学中的意义[J].遗传学报,1982,9(2):151-159.
[21]叶胜海,李春寿,阮关海,等.作物单倍体二倍化及其染色体倍性鉴定研究进展[J].浙江农业学报,2003,15(5):323-326.
[22]吴瑞霞.马蓝的形态组织观察与细胞核型分析[D].福州:福建农林大学,2010.
[23]任琛,孙景景,袁琼.蟛蜞菊属和孪花菊属(菊科-向日葵族)的细胞学研究[J].热带亚热带植物学报,2012,20(2):107-113.
[24]李娟娟,王蕾,贾俊忠,等.黄瓜正常品种及一个芽黄突变体的核型分析[J].湖北农业科学, 2011, 50(2):296-300.
[25]郑金双,张蜀宁,孙成振,等.不结球白菜根尖体细胞染色体制片及其二倍体和四倍体有丝分裂过程观察[J].植物资源与环境学报,2011,20(4):58-63.
[26]丁鸿,邱东萍,陈少雄.植物染色体标本的制备和染色体核型分析研究进展[J].南方农业学报,2012,43(12):1958-1962.
[27]ARANO H.Cytological studies in subfamily Carduoideae(compoitae) of Japan[J]. IX Bot Mag Tokyo, 1963,76:32.
[28]LEVAN A, FREDGA K, SANDBERG A.Nomenclature for centromeric position on chromosomes[J]. Hereditas Band, 1964,52:197-202.
[29]STEBBINS G L I.Chromosome evolution in higher plants[M].London:Adward Arnold,1971:88.
[30]蒿若超,武美燕.一种植物染色体制片改良方法[J].长江大学学报(自然科学版),2011,8(2):236-238,289.
[31]陈盈盈,官锦燕,谭嘉娜,等.辣木的染色体制片优化及核型分析[J].热带作物学报,2020,41(6):1174-1178.
(责任编辑:柯文辉)

