一氧化氮对干旱胁迫下紫花苜蓿氮代谢的影响
赵颖,辛夏青,魏小红
(1.甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;3.甘肃省干旱生境作物学重点实验室,甘肃 兰州730070)
氮素是构成蛋白质和核酸的重要元素,是农作物生长发育不可缺少的3个要素之一。植物只有在固氮酶的催化下把NO3-,NO2-或NH4+无机氮转换为含氮化合物才可被植物吸收利用。硝酸还原酶(nitrate reductase,NR)、谷氨酰胺合成酶(glutamine synthetase,GS)、谷氨酸合成酶(glutamate synthase,GOGAT)及谷氨酸脱氢酶(glutamate dehydrogenase,GDH)是植物氮代谢的主要酶[1],其活性反映了氮代谢的转运速度[2]。高水平的氮代谢可以促进氮的同化,合成脯氨酸和蛋白质等渗透调节物质维持水分平衡[3]。近年来,在小麦(Triticum aestivum)[4]、玉米(Zea mays)[5]、马铃薯(Solanum tuberosum)[6]以及大豆(Glycine max)[7]等植物中发现氮素与干旱胁迫有交互关系,可通过改善气孔导度、光合速率、抗氧化酶活性提高植物对干旱胁迫的适应性[8-10],这说明氮代谢在植物抗旱中具有重要作用。
紫花苜蓿(Medicago sativa)是我国西北干旱半干旱地区种植面积最广的优质多年生豆科牧草,也是畜牧业生产中不可或缺的主要植物蛋白资源,但干旱制约了其生长与品质[11-12]。Santantonio等[13]通过QTL定位发现苜蓿在干旱下的产量和水分利用效率与碳氮代谢显著相关。此外,干旱影响土壤氮素有效性和苜蓿对氮素的吸收同化能力[14]。一氧化氮(nitric oxide,NO)作为一种生物活性分子,参与调控植物生长发育及非生物胁迫响应[15-16]。研究表明,NO通过调节紫花苜蓿抗氧化酶活性[17]、非结构性碳水化合物代谢[18]、苯丙烷类代谢[19]、光合能力[20]来响应干旱胁迫,促进干旱下紫花苜蓿种子的萌发与幼苗的生长。然而,NO是否参与调控干旱胁迫下紫花苜蓿氮代谢还未见报道。
因此,本研究以NO供体硝普钠(sodium nitroprusside,SNP)及NO清除剂(c-PTIO)为调控手段,探讨NO在调控干旱胁迫下紫花苜蓿含氮化合物含量及氮素代谢中的作用及氮素合成代谢的调节机制,以期为揭示紫花苜蓿耐旱机理与提高紫花苜蓿抗旱能力提供理论基础。
1 材料与方法
1.1 试验材料与设计
试验于2018年1-3月在甘肃农业大学生命科学技术学院植物生物技术实验室进行。供试紫花苜蓿种子由甘肃省农业科学院提供,品种为“三得利”,千粒重2.0223 g。NO供体硝普钠[Na2Fe(CN)5](SNP)和NO清除剂2-(4-羧苯基)-4,4,5,5-四甲基咪唑啉-1-烃氧基-3-氧化钠盐(C14H16KN2O4)[2-(4-carboxy-2-phenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide,c-PTIO],购自Sigma公司。
共设6个处理:蒸馏水;15% PEG-6000;0.1 mmol·L-1SNP;15% PEG+0.1 mmol·L-1SNP;200 μmol·L-1c-PTIO;15% PEG+200 μmol·L-1c-PTIO[21]。筛选籽粒饱满的种子用0.1%氯化汞溶液消毒5 min,蒸馏水洗涤去除残留。1)萌发试验:将50粒种子均匀放在垫有双层滤纸的培养皿中(直径9 cm),按实验设计分别添加4 mL处理液,每24 h更换一次,每处理重复3次;在干旱处理的第2、4、6、8天随机取种子样品用于指标测定,每试验重复3次。2)幼苗试验:将种子均匀播种在装有等量营养土的花盆(口径12 cm),待生长30 d后定苗(每盆30株),并按试验设计进行处理。SNP与c-PTIO采用叶面喷施的方式,PEG采用浇灌的方式,每隔24 h处理一次。分别在处理的第2、4、6、8天取幼苗功能叶片用于指标的测定,每个试验3次重复。以上试验材料均在25℃,光周期为12 h光照/12 h黑暗,光照强度为4000 lx的光照培养箱中培养。
1.2 测定方法
采用李合生[22]的方法测定NR活性;参考邹琦[23]的方法测定GS活性;根据Singh等[24]的方法测定GOGAT及GDH活性。参照李合生[22]的水合茚三酮法略作改动测定游离氨基酸总量。参照陈建勋等[25]的方法和考马斯亮蓝G-250法测定总蛋白含量;参照李合生[22]的方法测定可溶性蛋白含量。
采用不连续系统聚丙烯酰胺凝胶垂直板电泳。当指示剂溴酚蓝到达凝胶前沿1~2 cm处,完成电泳。取出凝胶垂直板,将凝胶从玻璃板中剥离浸泡在考马斯亮蓝染色液中,用微波炉染色3~7 min,然后用脱色液(水∶甲醇∶乙酸=5∶3∶3)反复脱色,每次脱色时间约10 min,当胶块背景清晰,蛋白条带明显时进行拍照[16]。
1.3 数据分析
采用Excel 2007软件进行数据处理和作图,SPSS 19.0软件进行差异显著性分析(P<0.05),E-Gel Imager凝胶成像系统对凝胶进行成像,Adobe Photoshop CC 2019软件对电泳图剪辑。
2 结果与分析
2.1 NO对PEG胁迫下紫花苜蓿氮代谢相关酶活性的影响
2.1.1 NO对PEG胁迫下紫花苜蓿NR活性的影响 紫花苜蓿种子萌发期NR活性随时间推移逐渐增加(图1A)。在各时间点,PEG+SNP处理NR活性均最高,且在第8天达到最大值。PEG+c-PTIO较PEG处理在第2、6、8天时,NR活性均无显著差异,而在第4天时,NR活性提高了19.26%。正常情况下外源施加SNP,NR活性显著增加,而施加c-PTIO对NR活性无显著影响。
紫花苜蓿幼苗叶片中NR活性随时间推移逐渐上升。PEG+SNP较PEG处理NR活性在第4,6,8天分别显著增加了13.97%、11.50%、16.31%,而PEG+c-PTIO较PEG处理NR活性无显著差异。c-PTIO处理与CK相比,第2,4,6天时差异不显著,第8天时NR活性显著降低了7.94%。因此,施加SNP能提高紫花苜蓿种子萌发期及其幼苗叶片中NR活性,而施加c-PTIO对NR活性的影响不显著(图1B)。

图1 NO对PEG胁迫下紫花苜蓿萌发期(A)和幼苗期(B)NR活性的影响Fig.1 Effect of NO on NR activity in alfalfa during seed germination(A)and seedling(B)stage under PEG stress
2.1.2 NO对PEG胁迫下紫花苜蓿GS活性的影响 从图2A可知,紫花苜蓿种子萌发期GS活性随时间推移先升高后降低,且第4天时各处理GS活性最大,其中,第4天时,PEG+SNP较PEG处理的GS活性显著升高了25.38%,PEG+c-PTIO与PEG处理差异不显著;在正常条件下,SNP处理与CK相比GS活性升高了8.27%,而c-PTIO处理则降低了5.70%。

图2 NO对PEG胁迫下紫花苜蓿萌发期(A)和幼苗期(B)GS活性的影响Fig.2 Effect of NO on GS activity in alfalfa during seed germination(A)and seedling(B)stage under PEG stress
在紫花苜蓿幼苗叶片中,GS活性变化趋势与萌发期一致(图2B)。正常供水及PEG胁迫下外源施加SNP均可明显增加紫花苜蓿幼苗中GS活性,且在第4天时效果最为显著,PEG+SNP处理较PEG处理的GS活性升高了23.56%,SNP处理与CK相比GS活性升高了3.32%。施加c-PTIO与CK在第2、4、6天无显著差异,在第8天时起显著的抑制作用,此时,PEG+c-PTIO比PEG处理的GS活性降低了3.06%。c-PTIO处理和CK相比GS活性降低了21.99%。
2.1.3 NO对PEG胁迫下紫花苜蓿GOGAT活性的影响 紫花苜蓿种子萌发期GOGAT活性呈先升高后降低的趋势,处理第4天时,GOGAT活性达到最大值。PEG胁迫抑制GOGAT活性,而PEG+SNP会使GOGAT活性不同程度的上升。PEG+SNP处理较PEG处理GOGAT活性在第2、4、6、8天分别升高了45.93%、42.12%、39.03%和60.06%。而NO清除剂c-PTIO在第2天时没有表现出抑制作用,但在第4、6、8天均抑制GOGAT活 性。第8天 时,c-PTIO处理 与CK相比GOGAT活性 降 低 了16.15%;PEG+c-PTIO较PEG处 理 相比GOGAT活性降低了22.19%(图3A)。

图3 NO对PEG胁迫下紫花苜蓿萌发期(A)和幼苗期(B)GOGAT活性的影响Fig.3 Effect of NO on GOGAT activity in alfalfa during seed germination(A)and seedling(B)stage under PEG stress
与萌发期相反,紫花苜蓿幼苗期GOGAT活性变化为先下降再上升,但同一时间各处理间GOGAT活性变化与萌发期一致。在第8天幼苗叶片中GOGAT活性最高,PEG+SNP与PEG处理相比GOGAT活性升高了23.08%。在第2、4、6天,正常及PEG胁迫下施用c-PTIO与CK及PEG相比,对GOGAT活性抑制效果均不稳定;第8天时,c-PTIO与CK相比GOGAT活性降低了15.75%;PEG+c-PTIO较PEG处理相比GOGAT活性降低了8.59%(图3B)。
2.1.4 NO对PEG胁迫下紫花苜蓿GDH活性的影响 紫花苜蓿种子萌发期GDH活性呈先升高后降低的趋势,且在第6天时各处理GDH活性达最大值。与CK相比,PEG处理使GDH活性增加,而PEG+SNP较PEG处理GDH活性均降低,第2、4、6、8天GDH活性分别降低了17.52%、12.75%、21.48%和35.89%。NO抑制剂c-PTIO在整个萌发过程中均起促进作用,c-PTIO处理与CK相比GDH活性平均增加了28.29%;PEG+c-PTIO与PEG处理相比GDH活性平均提高了18.26%(图4A)。

图4 NO对PEG胁迫下紫花苜蓿萌发期(A)和幼苗期(B)GDH活性的影响Fig.4 Effect of NO on GDH activity in alfalfa during seed germination(A)and seedling(B)stage under PEG stress
紫花苜蓿幼苗期GDH活性变化为先下降后上升。在第8天时GDH活性升到最高值,且各处理间呈现显著差异,PEG处理与CK相比GDH活性升高了39.15%,而PEG+SNP较PEG处理GDH活性降低了34.86%。正常条件下喷施c-PTIO与CK相比GDH活性增加了39.28%,PEG+c-PTIO较PEG处理相比GDH活性增加了13.70%(图4B)。
2.2 NO对PEG胁迫下紫花苜蓿游离氨基酸总量的影响
紫花苜蓿种子萌发期氨基态氮含量随胁迫时间增加逐渐上升。在第2、4、6、8天,紫花苜蓿萌发期种子中氨基态氮含量在PEG+SNP下比PEG处理分别降低了26.66%、5.77%、11.85%、15.38%;PEG+c-PTIO较PEG处理在第2、6、8天分别降低了22.00%、7.85%、18.02%,第4天增加了1.75%。在正常情况下,外源施加SNP及c-PTIO均促进氨基态氮的积累(图5A)。
苜蓿幼苗叶片中氨基态氮含量也随着处理时间延长逐渐增加。第4天时,叶片中游离氨基酸含量PEG+SNP较PEG处理显著降低了11.36%,PEG+c-PTIO较PEG处理显著增加了13.11%。而在第6、8天时,施加SNP对氨基态氮含量无显著影响。与CK相比,正常情况下添加c-PTIO,叶片中氨基态氮含量在第4天和6天均显著升高(图5B)。

图5 NO对PEG胁迫下紫花苜蓿种子萌发期(A)及幼苗期(B)氨基态氮含量的影响Fig.5 Effect of NO on amino nitrogen content of alfalfa during seed germination(A)and seedling(B)stage under PEG
2.3 NO对PEG胁迫下紫花苜蓿总蛋白含量的影响
紫花苜蓿种子萌发期总蛋白含量随着处理时间延长呈下降的趋势。PEG+SNP较PEG处理在第2、4、6天提高了紫花苜蓿种子总蛋白含量,且在第4天时提高幅度最大,为59.36%;但在第8天时呈抑制作用,紫花苜蓿种子总蛋白含量降低了36.03%。与CK相比,施加c-PTIO在整个萌发过程中均起抑制作用。如图6B所示,幼苗期紫花苜蓿叶片内的总蛋白水平随胁迫天数的增加而提高。PEG+SNP较PEG处理紫花苜蓿幼苗叶片的总蛋白含量差异不显著,PEG+c-PTIO较PEG处理叶片中总蛋白含量在第8天显著降低(图6)。

图6 NO对PEG胁迫下紫花苜蓿种子萌发期(A)及幼苗期(B)总蛋白含量的影响Fig.6 Effect of NO on total protein content of alfalfa during seed germination(A)and seedling(B)stage under PEG
2.4 NO对PEG胁迫下紫花苜蓿可溶性蛋白含量的影响
紫花苜蓿萌发种子中可溶性蛋白含量随处理时间推移逐渐下降。与PEG处理相比,第2天PEG+SNP与PEG+c-PTIO处理可溶性蛋白含量分别显著提高了33.60%和18.55%,第4、6天差异不显著;第8天,PEG+SNP处理下显著增加了43.12%,PEG+c-PTIO处理影响不显著。与CK相比,SNP处理显著提高了第2天可溶性蛋白含量,第4、6、8天差异不显著;c-PTIO处理显著降低了第4天可溶性蛋白含量,其他天数无显著影响(图7A)。
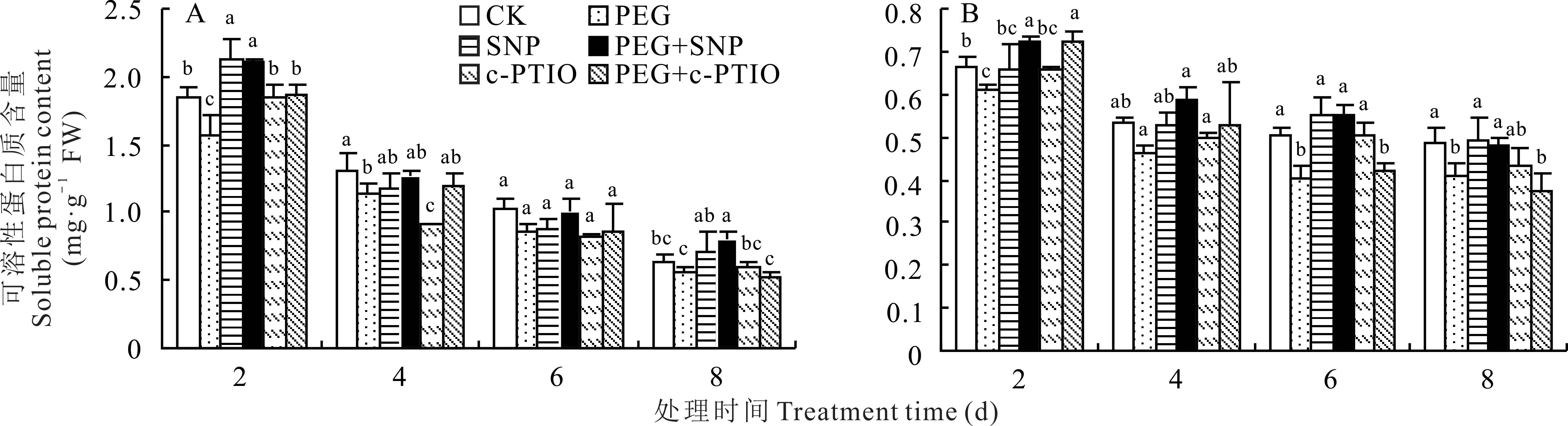
图7 NO对PEG胁迫下紫花苜蓿种子萌发期(A)及幼苗期(B)可溶性蛋白含量的影响Fig.7 Effect of NO on soluble protein content of alfalfa during seed germination(A)and seedling(B)stage under PEG
与萌发期相同,紫花苜蓿叶片中可溶性蛋白含量随处理时间延长逐渐降低(图7B)。PEG+SNP较PEG处理在第2、4、8天可溶性蛋白含量分别显著升高了19.11%、26.58%和17.47%,PEG+c-PTIO较PEG处理仅在第2天差异显著。非胁迫下,SNP处理和c-PTIO处理与CK对叶片可溶性蛋白含量无显著影响。
2.5 NO对PEG胁迫下紫花苜蓿可溶性蛋白SDS-PAGE图谱的研究
萌发期紫花苜蓿幼芽中可溶性蛋白SDS-PAGE电泳如图8A所示,在处理第2天时,蛋白电泳条带数多达12条,且分子量为97.4与47.0 kDa的蛋白含量最多。与处理第2天相比,在第4天分子量为97.4 kDa的蛋白表达量降低,除PEG+c-PTIO处理,分子量为47.0 kDa的蛋白表达量增加;在第6和8天,分子量97.4 kDa的蛋白不表达,且47.0 kDa的蛋白表达量降低。此外,在第4天,与CK相比,PEG和PEG+SNP处理下分子量介于14.4~22.0 kDa的蛋白表达量增加,c-PTIO与PEG+c-PTIO处理下产生了分子量为43.0 kDa的新蛋白条带。
从紫花苜蓿幼苗叶片可溶性蛋白SDS-PAGE电泳图谱(图8B)可以看出,紫花苜蓿幼苗叶片可溶性蛋白只有蛋白质亚基分子量分别为47.0与14.4 kDa的2条电泳条带,且蛋白表达量随时间延长逐渐增加。在同一处理时间,PEG处理较CK增加了47.0 kDa蛋白的表达量;与PEG处理相比,PEG+SNP处理对分子量为47.0 kDa的蛋白表达量影响不大,PEG+c-PTIO降低了其表达量。

图8 PEG胁迫下外施NO对紫花苜蓿种子萌发期(A)及幼苗期(B)可溶性蛋白电泳图谱的影响Fig.8 Effects of NO on soluble protein electrophoresis atlas in alfalfa during seed germination(A)and seedling(B)stage under PEG stress
3 讨论与结论
干旱胁迫下植物生长受到抑制是最明显的形态特征。本课题组前期研究结果表明,干旱胁迫抑制了紫花苜蓿种子的萌发与幼苗的生物量,而施加外源NO则对该抑制作用具有显著的缓解作用,这与NO改变植物体内生理代谢过程有关[26]。氮代谢是影响植物生长最基本的生理过程之一[27-29],它通过氮吸收、同化及有机含氮化合物合成等方面调节植物的抗逆性[30]。NR是影响氮代谢速率的关键酶,可以将植物从土壤吸收的NO3-在细胞质中还原为NO2-,然后在叶绿体中经亚硝酸还原酶还原为NH4+[31]。本研究中,PEG胁迫下NR活性在萌发期及幼苗期均降低,外源施加SNP显著提高了NR活性,这说明NO促进了干旱下苜蓿对NO3-的同化。NR活性越高植物体内NO3-同化能力越强[32],且植物体内的硝态氮转化为铵态氮引导着作物对氮肥的吸收和利用[33-34]。
GS-GOGAT循环可将光呼吸产生的NH4+转变为氨基酸[35],此途径中,NH4+首先与谷氨酸在GS的催化作用下合成谷氨酰胺(glutamine,Gln),随后Gln和α-酮戊二酸在GOGAT的催化作用下形成两分子谷氨酸[36]。其中一分子谷氨酸用于合成其他氨基酸和酰胺,形成可被植物直接利用的氮素化合物;另一分子则作为原料再次进入GS-GOGAT循环中[37]。植物中的GDH是存在于线粒体中的应激反应酶[38],以NADH为辅酶在逆境中行使NH4+同化的功能[39]。GDH催化NH4+和α-酮戊二酸缩合形成谷氨酸,且该过程是可逆的。当植物在逆境时,GS和GOAT活性被抑制,NO3-同化和蛋白质降解产生的NH4+积累引起氨中毒,此时,GDH活性增加,在诱导胁迫保护分子合成[40]及解除氨中毒方面发挥了独特作用[41]。在本研究中,在PEG胁迫下紫花苜蓿萌发期及幼苗期GS和GOGAT活性都降低,GDH活性升高,说明干旱胁迫下紫花苜蓿生长受到抑制是由NH4+中毒引起的,而PEG+SNP处理增加了紫花苜蓿GS与GOGAT的活性,GDH活性下降,缓解了干旱下NH4+的过量积累。此外,GS、GOGAT和GDH作为NH4+同化过程关键酶,还与脯氨酸等渗透调节物质合成密切相关,维持水分平衡[42]。周万海等[43]发现,盐胁迫下紫花苜蓿NR、GS和GOGAT活性降低,外施NO缓解了盐胁迫对NR、GS和GOGAT活性的抑制作用。本研究中,PEG胁迫下紫花苜蓿萌发期种子及幼苗叶片中NR、GS和GOGAT活性降低,而PEG+SNP处理增加了NR、GS和GOGAT活性,这说明干旱下施加外源NO促进了紫花苜蓿对氮素的吸收同化。施加c-PTIO抑制了紫花苜蓿中NR、GS、GOGAT的活性,提高了GDH活性。因此,干旱胁迫下内源NO也参与了紫花苜蓿的氮素转运。相同处理下,外源SNP对紫花苜蓿苗期叶片中NR、GS、GDH活性的提高幅度远大于种子萌发期,说明NO对叶片氮素代谢酶的影响要大于根系。
植物吸收的无机态氮在植物体内大多数形成氨基酸,进一步合成蛋白质,少部分参与核酸等含氮物质的代谢。氨基酸和蛋白质作为植物氮代谢的主要产物,其含量直接影响着植物的生长进程、生物量及品质[44]。本研究发现,PEG胁迫下紫花苜蓿中游离氨基酸总量增加,蛋白质含量降低,说明干旱引起蛋白质合成受阻,而PEG胁迫下外施SNP可使游离氨基酸的含量不同程度降低,蛋白质含量可以不同程度的提高,促进游离氨基酸向合成蛋白质的方向转运。这与邵瑞鑫等[45]以及魏小红等[46]的研究一致。也有研究表明,水分胁迫下作物体内游离氨基酸增加,尤其是游离脯氨酸含量明显增加是由于蛋白质水解占优势,使可溶性蛋白质含量下降[47]。本研究中,干旱胁迫下可溶性蛋白含量降低,外施SNP其含量增加,这是因为NO抑制了蛋白质的降解。高浓度游离氨基酸有助于植物抵御逆境,高水平可溶性蛋白含量有利于细胞正常发挥功能。此外,干旱及NO引起蛋白质的组分发生变化,这些外界信号的感知与转导调节基因的表达,产生新的蛋白,从而引起生理代谢的变化[48]。
综上所述,PEG模拟的干旱胁迫使紫花苜蓿氮代谢紊乱,而干旱下施加外源NO供体(SNP)处理通过调节氮代谢关键酶活性介导紫花苜蓿萌发期及幼苗期叶片氮代谢,缓解了干旱胁迫NH4+对紫花苜蓿种子萌发及幼苗的伤害。此外,游离氨基酸与可溶性蛋白含量增加,提高了紫花苜蓿的渗透调节能力使其含水量增加[26]。因此,NO通过调节紫花苜蓿氮代谢过程来提高其抗旱性。

