熟地黄多糖对前列腺癌PC-3细胞增殖凋亡的作用及对VEGF/Akt信号通路的影响
夏旭 崔洪泉 胡培森 王交托
河南省中医院(河南中医药大学第二附属医院)泌尿外科(郑州450000)
前列腺癌为男性生殖系统常见恶性肿瘤之一,对男性健康的危害性在全部肿瘤中位列第二[1]。目前,关于前列腺癌的传统疗法往往对局限性和激素敏感性病变有较好疗效,但仍有小部分患者复发并转移、转化为激素抵抗型前列腺癌,这是泌尿肿瘤学最复杂的问题[2]。地黄是传统补益类中药,可经炮制、加工为熟地黄,熟地黄中多糖成分含量高,有抑瘤、增强免疫作用,已被证实在鼻咽癌等治疗中获取较为理想的效果[3-4],但对前列腺癌细胞尤其是对雄激素非依赖性前列腺癌细胞作用的科学评价报道鲜见。据报道[5],血管内皮生长因子(vascular endothelial growth factor,VEGF)/蛋白激酶B(protein kinase B,Akt)信号通路在多种恶性肿瘤发展中有重要作用,参与细胞增殖、侵袭、凋亡。本实验猜测VEGF/Akt 信号通路在雄激素非依赖性前列腺癌发展中发挥了作用,故基于该通路分析熟地黄多糖对前列腺癌PC-3 细胞增殖、侵袭、凋亡的影响,为熟地黄多糖在雄激素非依赖性前列腺癌治疗中的进一步开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞人前列腺癌PC-3 细胞(上海传秋生物科技有限公司,批号:CQ80165)。
1.1.2 药物、试剂和仪器熟地黄多糖(陕西慈源生物有限公司,测定纯度在90%以上),细胞凋亡AnnexinV/PI 检测试剂盒(美国BD 公司),鼠抗人血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)、Akt、磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)、p-Akt单克隆抗体(一抗)(美国Abcam 公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的纯化山羊抗小鼠IgG 二抗、β-actin 抗体(北京百奥莱博科技有限公司)。Transwell 小室(美国BD 公司),CytoFLEX 流式细胞仪(美国贝克曼库尔特公司)。
1.2 方法
1.2.1 细胞培养与分组将冻存的人前列腺癌PC-3 细胞复苏,再置入含10%胎牛血清的DMEM培养液内,在5% CO2、37 ℃条件下培养,常规更换培养液,细胞贴壁后,采用0.25%胰蛋白酶消化、传代,选取对数生长期细胞作为实验对象。将PC-3细胞接种在96 孔板内,确保每个培养孔内约有1 ×106个细胞,每孔加入0.18 mL DMEM 培养液,继续孵育24 h,PC-3 细胞贴壁后可分为4 组:空白组、低、中、高剂量组,分别予以0、20、40、60 μmol/L 熟地黄多糖溶液处理,每组平行设置5 个样本。
1.2.2 MTT 法检测人前列腺癌PC-3 细胞增殖情况取各组细胞,按上述方法培养24、48、72 h 后,滴入20 μL MTT 溶液(5 mg/mL)继续培养4 h,弃上清,在培养孔内加入150 μL DMSO,摇床轻微震荡10 min。采用Bio-Tek808 酶标仪检测570 nm 波长处每孔吸光度值,计算细胞增殖抑制率,细胞增殖抑制率=(1-剂量组平均吸光度值/空白组平均吸光度值)×100%。
1.2.3 Transwell 侵袭实验检测PC-3 细胞侵袭能力采用OPTI-MEM培养基按3∶1比例稀释Matrigel基质胶,铺于Transwell 小室内,每孔40 μL,置入37 ℃孵箱内反应1 h,待Matrigel 基质胶凝固后备用。取各组细胞,按上述方法培养细胞72 h 后,采用胰蛋白酶消化、重悬,将细胞数调节为1 × 106个/mL,再将200 μL 细胞悬液接种在Transwell 小室上室(铺有Matrigel 基质胶),再取600 μL 完全培养基加入下室,置入37 ℃培养箱内持续培养24 h。取出Transwell 小室,拭净Transwell 小室膜上PC-3细胞,4%多聚甲醛固定10 min,以0.2%结晶紫对膜下PC-3 细胞进行染色,光镜下随机计数5 个高倍视野下细胞数,计数紫色染色穿膜细胞,取平均值,即细胞侵袭能力。
1.2.4 流式细胞仪检测PC-3 细胞凋亡率采用Annexin-V-FITC/PI 双染法检测PC-3 细胞凋亡情况,取各组细胞,(1 × 106/孔)接种至6 孔板培养至72 h,再收集细胞,参考Annexin-V-FITC/PI 凋亡试剂盒步骤染色,即去离子水稀释10×Binding Buffer为1×Binding Buffer,收集细胞,使用预冷1×PBS 重悬细胞1 次,2 000 rpm 离心10 min,洗涤细胞,加入300 μL 的1×Binding Buffer 悬浮细胞,Annexin-VFITC 标记,上机前5 min 加入5 μL 的PI 染色进行PI 标记,上机前补加200 μL 的1×Binding Buffer,上流式细胞仪检验,以相应软件分析。
1.2.5 Western blot 法检测细胞内VEGF/Akt 信号通路相关蛋白表达取各组细胞,接种至6 孔板培养至72 h,转入离心管,2 500 ×g离心10 min,弃上清液,按细胞量加入细胞抽提试剂,裂解15 min。1 000 ×g离心10 min,弃上清液,BCA 法提取总蛋白。调节蛋白浓度,加入1/5 体积的5×Buffer,沸水浴10 min 变性,每孔上样20 μg,采用10%浓度的SDS-聚丙烯酰胺凝胶电泳后,转膜,5%脱脂奶粉封闭2 h,0.1% TBST 洗膜5 次。一抗孵育VEGFR2(1∶400)、Akt(1∶500)、PI3K(1∶500)、p-Akt(1∶1 000)、β-actin(1∶1 000)抗体,4 ℃过夜,TBST 缓冲液洗膜2 次,HRP 标记的纯化山羊抗小鼠IgG 二抗(1∶2 000)室温孵育0.5 h。ECL 显色,采集图像分析,目的蛋白与β-actin 灰度值之比为VEFGR2、Akt、p-Akt 蛋白相对表达量。
1.3 统计学方法采用SPSS 19.0 统计软件分析数据,计量资料以均数±标准差表示,采用单因素方差分析,再用t检验行两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 熟地黄多糖对人前列腺癌PC-3 细胞增殖的抑制作用随着熟地黄多糖处理浓度增加,PC-3细胞增殖抑制率逐渐升高,呈明显浓度依赖性,且呈时间梯度升高(P<0.05)。见表1、图1。
表1 不同时间点、不同浓度熟地黄多糖对PC-3 细胞增殖抑制率Tab.1 Inhibitory rate of Rehmannia glutinosa polysaccharide on PC-3 cell proliferation at different time and concentrations ±s,%
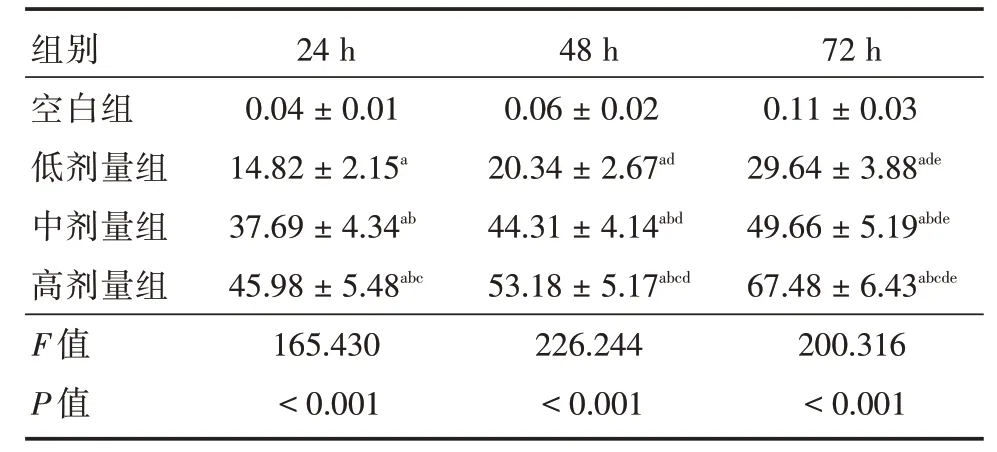
表1 不同时间点、不同浓度熟地黄多糖对PC-3 细胞增殖抑制率Tab.1 Inhibitory rate of Rehmannia glutinosa polysaccharide on PC-3 cell proliferation at different time and concentrations ±s,%
注:a 与空白组比较,P<0.05;b 与低剂量组比较,P<0.05;c 与中剂量组比较,P<0.05;d与24 h比较,P<0.05;e与48 h比较,P<0.05
组别空白组低剂量组中剂量组高剂量组F 值P 值24 h 0.04±0.01 14.82±2.15a 37.69±4.34ab 45.98±5.48abc 165.430<0.001 48 h 0.06±0.02 20.34±2.67ad 44.31±4.14abd 53.18±5.17abcd 226.244<0.001 72 h 0.11±0.03 29.64±3.88ade 49.66±5.19abde 67.48±6.43abcde 200.316<0.001
2.2 熟地黄多糖对人前列腺癌PC-3 细胞侵袭能力的影响随着熟地黄多糖处理浓度增加,PC-3细胞的穿膜细胞数逐渐减少,有明显浓度依赖性(P<0.05)。见表2、图1。
表2 不同浓度熟地黄处理PC-3 细胞的穿膜细胞数Tab.2 The number of penetrating cells in PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s

表2 不同浓度熟地黄处理PC-3 细胞的穿膜细胞数Tab.2 The number of penetrating cells in PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s
注:a 与空白组比较,P<0.05;b 与低剂量组比较,P<0.05;c 与中剂量组比较,P<0.05
组别 空白组 低剂量组 中剂量组 高剂量组F 值P 值穿膜细胞数(个/视野)44.78±3.5236.14±3.38a25.58±2.46ab12.78±1.08abc122.899<0.001
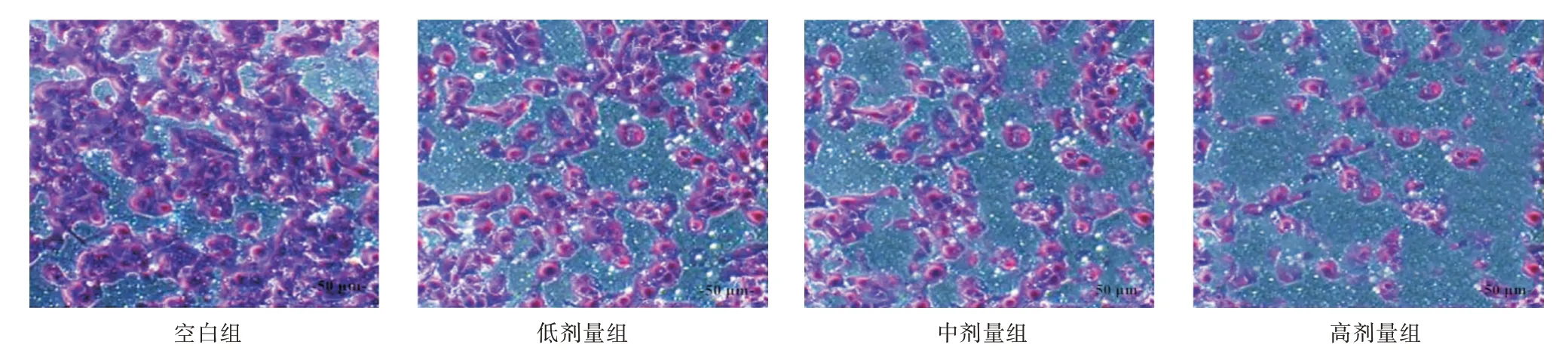
图1 不同浓度熟地黄处理PC-3 细胞的穿膜细胞数(结晶紫染色,×40)Fig.1 The number of invasive cells in PC-3 cells treated with different concentrations of Rehmannia glutinosa(crystal violet staining,×40)
2.3 熟地黄多糖对人前列腺癌PC-3细胞凋亡率的影响随着熟地黄多糖处理浓度增加,PC-3 细胞凋亡率逐渐升高,有明显浓度依赖性(P<0.05)。见表3、图2。
表3 不同浓度熟地黄处理PC-3 细胞凋亡率Tab.3 apoptosis rate of PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s

表3 不同浓度熟地黄处理PC-3 细胞凋亡率Tab.3 apoptosis rate of PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s
注:a 与空白组比较,P<0.05;b 与低剂量组比较,P<0.05;c 与中剂量组比较,P<0.05
空白组 低剂量组 中剂量组 高剂量组F 值P 值组别凋亡率1.03±0.19 8.77±0.69a 17.57±1.42ab 21.97±1.71abc 318.803<0.001
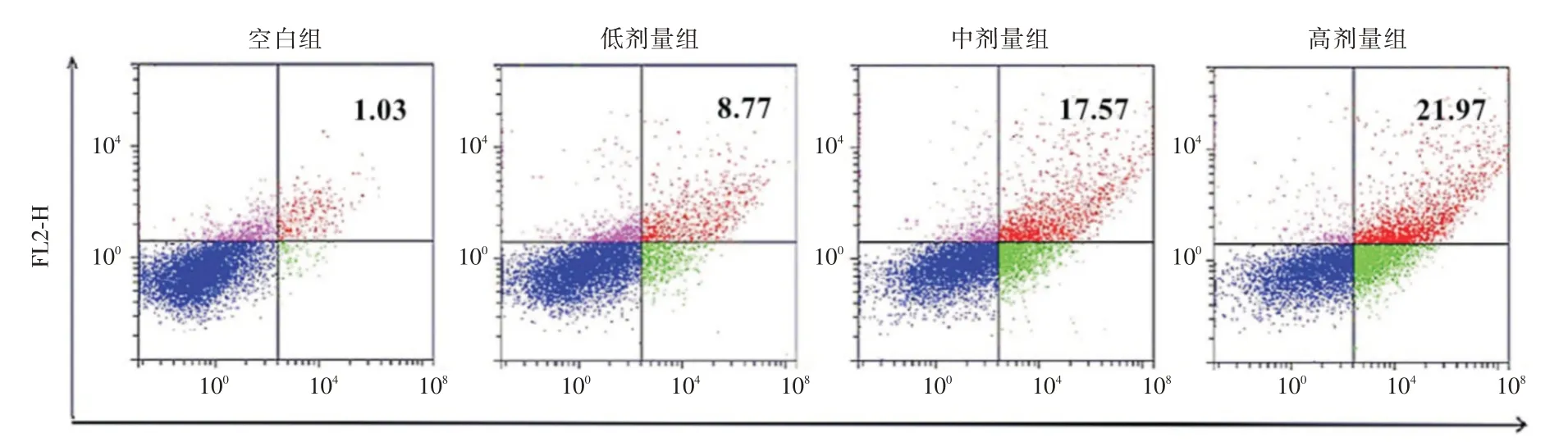
图2 不同浓度熟地黄处理PC-3 细胞凋亡率Fig.2 Apoptosis rate of PC-3 cells treated with different concentrations of Rehmannia glutinosa
2.4 人前列腺癌PC-3细胞中VEGF/Akt 信号通路相关蛋白表达随着熟地黄多糖处理浓度增加,PC-3 细胞中VEGFR2、p-PI3K、p-Akt 蛋白表达逐渐下调,有明显浓度依赖性(P<0.05),PI3K、Akt 蛋白表达组间对比差异无统计学意义(P>0.05)。见表4、图3。
表4 不同浓度熟地黄处理PC-3 细胞中VEGF/Akt 信号通路相关蛋白表达Tab.4 expression of VEGF/Akt signaling pathway related proteins in PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s
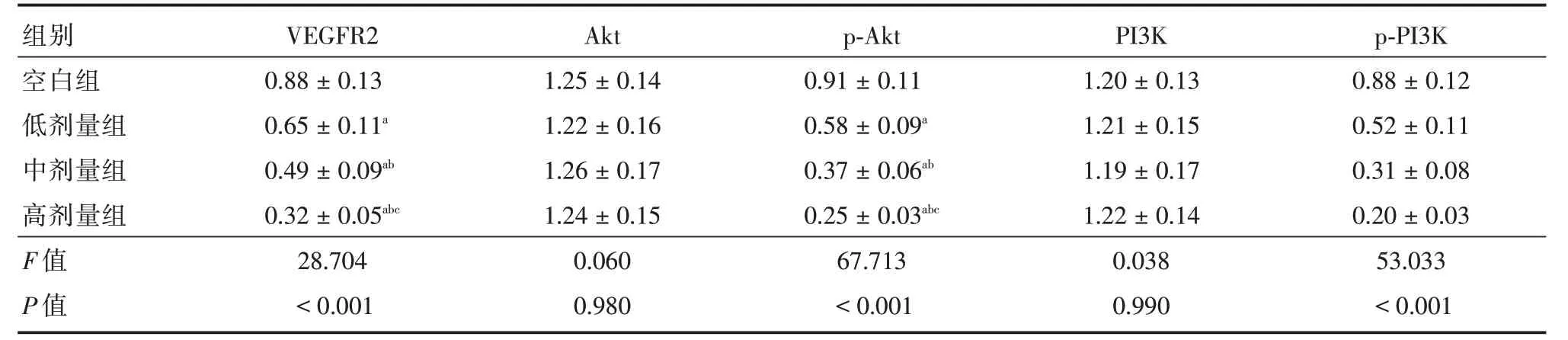
表4 不同浓度熟地黄处理PC-3 细胞中VEGF/Akt 信号通路相关蛋白表达Tab.4 expression of VEGF/Akt signaling pathway related proteins in PC-3 cells treated with different concentrations of Rehmannia glutinosa ±s
注:与空白组比较,aP<0.05;与低剂量组比较,bP<0.05;与中剂量组比较,cP<0.05
组别VEGFR2Aktp-AktPI3Kp-PI3K空白组0.88±0.131.25±0.140.91±0.111.20±0.130.88±0.12 aa 低剂量组中剂量组高剂量组F 值P 值0.65±0.11 0.49±0.09ab 0.32±0.05abc 28.704<0.001 1.22±0.16 1.26±0.17 1.24±0.15 0.060 0.980 0.58±0.09 0.37±0.06ab 0.25±0.03abc 67.713<0.001 1.21±0.15 1.19±0.17 1.22±0.14 0.038 0.990 0.52±0.11 0.31±0.08 0.20±0.03 53.033<0.001
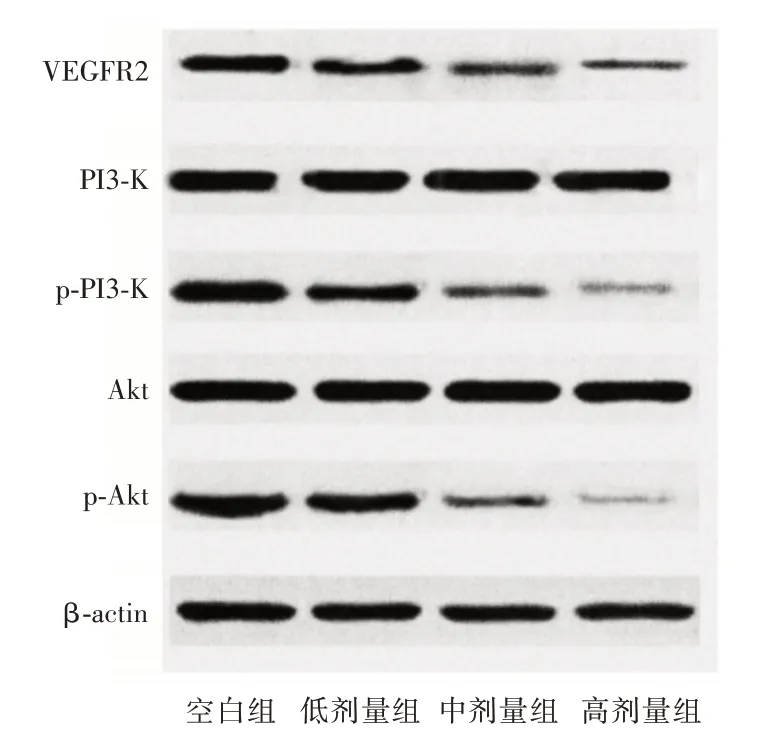
图3 PC-3 细胞中VEGF/Akt 信号通路相关蛋白表达Western blot 条带图Fig.3 Expression of VEGF/Akt signaling pathway related proteins in PC-3 cells by Western blot
3 讨论
前列腺癌发病机制与原癌基因激活,抑癌基因失活密切相关,细胞增殖、凋亡失衡为其发生和发展的主要因素[6]。中药乃我国药用资源宝库,大约50%的癌症化疗药物源自中药材天然产物及其衍生物,部分中药具有抑制癌细胞增殖、诱导癌细胞凋亡的效果[7-8]。地黄有“补血之君,壮水之主”的美称,是传统延年益寿的中药,熟地黄多糖作为地黄有效成分之一,在改善肿瘤微环境、抑制肿瘤增殖转移等有良好效果。因此选用熟地黄多糖为实验药物,分析治疗前列腺癌中的抗肿瘤活性以及诱导凋亡机制,为新药研发奠定药理基础。
李哲等[9]在抑制鼻咽癌增殖转移中靶向采用熟地黄多糖治疗,发现熟地黄多糖在鼻咽癌增殖转移抑制中有一定时间、剂量依赖性;董静等[10]报道熟地黄多糖可诱导肝癌细胞凋亡,共同提示了熟地黄多糖在抑制癌细胞增殖、凋亡方面有一定作用。本研究结果显示:在0、20、40、60 μmol/L 熟地黄多糖处理前列腺癌PC-3 细胞72 h 后,PC-3 细胞增殖抑制率随着熟地黄多糖浓度、培养时间延长而持续提高,提示地黄多糖对前列腺癌PC-3 细胞有增殖抑制作用,呈剂量、时间依赖效应;在抑制前列腺癌PC-3 细胞侵袭、诱导凋亡方面,熟地黄多糖亦呈现出明显剂量依赖性,初步证明了熟地黄多糖对雄激素非依赖性前列腺癌有治疗作用。
恶性肿瘤的产生、进展实质上是打破了细胞增殖、凋亡的动态平衡,因而研究癌细胞增殖、侵袭以及凋亡机制十分必要[11-12]。信号通路是相关学者研究癌细胞凋亡的重点关注问题,林星长等[13]研究发现,前列腺癌PC-3 细胞抗凋亡的主要机制是抑制VEGF/Akt 信号通路。VEGF 受体家族包括VEGFR1、VEGFR2、VEGFR3 三个成员,其中VEGFR2 是负责调节肿瘤血管生成的信号转导通路,可特异性抑制癌细胞转移、增殖并诱导凋亡[14]。因VEGFR2 能够促进肿瘤细胞生成,天然成为抑制实体瘤生长的靶标,阻断VEGF/VEGFR2 信号转导可谓抗癌过程中的重要策略[15-16]。Akt 为VEGFR2 下游效应因子,可在不同信号刺激下经磷酸化诱导下游靶点,刺激肿瘤细胞生成[17-18]。Akt 是PI3K/Akt 信号传导通路的重要激酶,被上游激酶激活后,进入细胞核磷酸化转录因子,从而调节细胞增殖、侵袭、凋亡等细胞行为[19-20]。本研究结果显示:随着熟地黄多糖处理浓度增加,PC-3 细胞中VEGFR2、p-PI3K、p-Akt 蛋白表达逐渐下调,有明显浓度依赖性,提示熟地黄多糖可能通过抑制VEGF/Akt 信号通路发挥抗前列腺癌的作用。
综上所述,熟地黄多糖对前列腺癌PC-3 细胞有抑制增殖、侵袭以及诱导凋亡的作用,可能通过抑制VEGF/Akt 信号通路实现的。本次研究成果丰富了关于中药治疗雄激素非依赖性前列腺癌的报道,有一定参考价值。但前列腺癌PC-3 细胞增殖、侵袭、凋亡可能受多条信号通路调控,本研究不足之处在于仅完成了VEGF/Akt 信号通路研究,且局限于雄激素非依赖性前列腺癌的治疗,应进一步进行其他相关通路研究,不断完善熟地黄多糖抗前列腺癌PC-3 细胞的具体机制方面研究,为中医药治疗前列腺癌提供新道路。

