磁共振扩散峰度成像与Gleason评分的相关性研究
赵芯一,印隆林,,印培源,蒲杨梅,张传德
(1.西南医科大学附属医院放射科,四川 泸州 646000;2.四川省医学科学院·四川省人民医院放射科,四川 成都 61007;3.成都医学院临床医学院,四川 成都 610500)
前列腺癌是中老年男性最常见的泌尿系统恶性肿瘤,发病率近年来逐步升高,死亡率仅次于肺癌[1]。目前临床工作中多以Gleason病理评分(GS)系统对其进行分级,GS评分越高,预后越差。不同级别的前列腺癌需采取不同的治疗方法,MRI为临床常用的术前无创性检查手段,对前列腺癌定位优于直肠指检和超声引导下穿刺活检,能够更好地帮助临床医生制定治疗方案。扩散加权成像(DKI)成像是以水分子非高斯运动扩散为基础的MR技术,相较弥散加权成像(DWI)可更准确的反应微结构特征。本研究收集了进行DKI扫描的前列腺癌患者41例,探讨DKI对于不同级别前列腺癌的诊断效能。
1 资料与方法
1.1 一般资料2018年12月至2020年12月在四川省人民医院行MRI检查并经穿刺活检证实为前列腺癌的患者41例。纳入标准:①穿刺活检均在MR 扫描后7天内完成;②在MRI扫描前均未进行肿瘤相关治疗者;③MR图像清晰,病史资料完整。排除标准:①MRI图像质量不佳;②在进行MR扫描前已进行肿瘤相关治疗者;③在行MR检查前已进行穿刺活检。年龄56~92岁[(73±9.82)岁],24例表现为排尿困难,9例出现全身骨痛症状,8例因体检发现PSA升高进行检查。
1.2 检查设备及方法
1.2.1扫描设备及方法 MRI检查设备为西门子Aera 1.5 T扫描仪,8通道相控阵体部线圈。所有患者均行常规平扫,其中30例患者行增强扫描。MRI常规平扫包括轴位T1 W、T2 W、高清压脂T2 W矢状、冠状位T2 W序列;DWI扫描:使用EPI序列,b值分别为0、50、800 s/mm2;DKI扫描:使用EFI序列,FOV=192×130,层厚3.5 mm,弥散方向3个,b值分别为0、700、1400、2100 s/mm2。增强扫描:GRE T1 W压脂序列,包括轴位动态增强扫描及常规矢状、冠状位增强扫描;增强对比剂为Gd-DTPA(钆喷酸葡胺注射液,北京北陆药业股份公司),对比剂使用高压注射器经前臂静脉注入,对比剂用量为0.2 mmol/kg,注射速率为2 ml/s。
1.2.2病理活检 采用超声引导下标准13针穿刺活检法进行穿刺,部分病例结合MRI图像对相应区域补穿2~3针。Gleason评分由病理科专业医师对前列腺各区结构进行评估得出。按照GS评分系统将41例患者分为低级别组4例(GS<7),中等级别组17例(GS=7)和高级别组20例(GS>7)。
1.2.3MRI图像分析及多模态MRI参数的测量 由2名高年资放射科主治医师分别对前列腺癌患者MRI图像进行分析,意见不一致时经协商取得共识。观察内容包括肿瘤的位置、信号及强化方式等影像学特征。DKI图像通过Kurtosis拟合法获取多b值的拟合曲线,并自动生成D值及K值图像。结合病理结果及MRI图像的信号特点,使用Radiant dicom软件同时在ADC map、D map及K map上勾画感兴趣区(ROI)。ROI选取相应参数图像上病灶的最大层面(当肿瘤多发时,选取直径最大的病灶),勾画ROI时尽量避开病灶内囊变坏死、出血、钙化等区域;每个病灶选取三个不同区域进行参数测量,取测得相应参数的平均值作为最终值。
1.3 统计学方法使用SPSS 19.0统计学软件分析数据。计量资料比较采用单因素方差分析及LSD-t检验;相关性分析采用Spearman相关性分析;诊断效能分析采用受试者工作特征曲线(ROC曲线)。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌的影像学表现41例患者中,10例病灶仅在外周带、20例外周带中央腺体同时存在、11例仅在中央腺体。MRI平扫肿瘤均呈为等、稍长T1 W等、稍长T2 W,DWI弥散受限。30例行增强检查患者中,19例病灶呈TIC-Ⅲ型强化模式(即速升速降型)、11例呈TIC-Ⅱ型强化模式(即上升平台型)。DKI原始图示,肿瘤在D值图上呈低信号、K值图上呈高信号,肿瘤信号随b值得增加而增高,对比度明显增强。
2.2 不同GS评分组间参数比较低级别组与中等级别组比较,仅D值差异有统计学意义(P=0.026),两组与高级别组各参数比较,差异均有统计学意义(P<0.05)。见表1。

表1 不同GS评分组间参数比较 (×10-3 mm2/s)
2.3 GS评分和DKI参数值、ADC值的相关性分析ADC值和D值与GS评分呈负相关(r分别为-0.501、-0.600,P<0.05);K值与GS评分呈正相关(r=0.694,P<0.05)。
2.4 各参数值对不同级别前列腺癌的诊断效能D值、K值和ADC值鉴别诊断不同级别前列腺癌的ROC曲线下面积(AUC)分别为0.787、0.878、0.743,特异性分别为68.4%、94.7%、94.7%,敏感性分别为81.8%、77.3%、50%(见表2),相应的分界点分别为0.719×10-3、0.132×10-3、0.560×10-3mm2/s(见图1)。
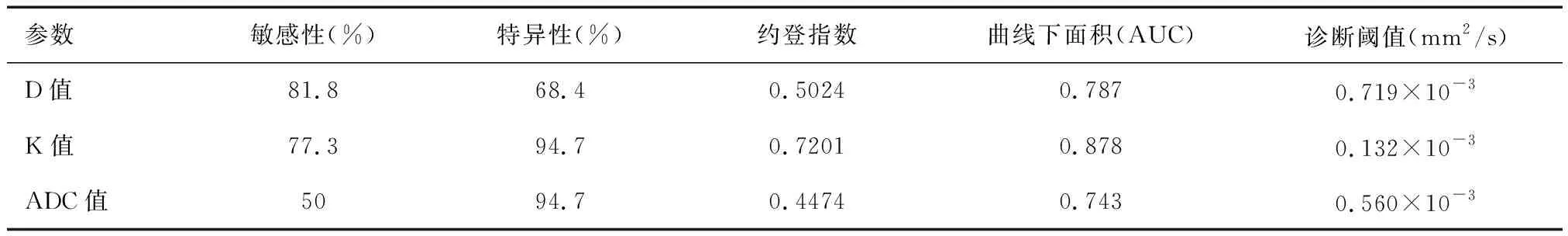
表2 各参数值鉴别诊断前列腺癌的ROC曲线下面积及诊断阈值
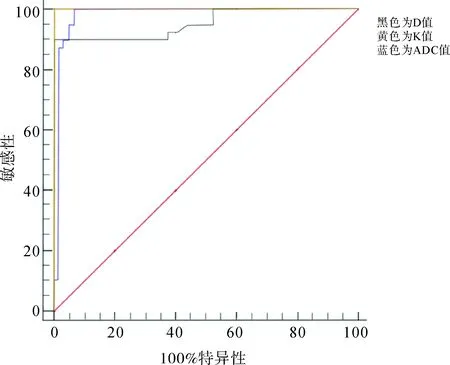
图1 各参数值鉴别诊断前列腺癌的ROC曲线
3 讨论
前列腺癌的治疗和诊断目前依然面临着挑战,目前其病因尚不明确,系与慢性炎症、生活习惯、遗传等因素有关[2,3]。早期前列腺癌多无明显症状,早期前列腺癌的筛查尚无统一标准,目前在中国临床工作中依然以前列腺特异性抗原(PSA)检测为主。进展期前列腺癌可有压迫、侵犯相邻组织等临床表现,如进行性排尿困难、血尿、尿潴留等,当前列腺癌出现骨转移时,常表现为病理性骨折、贫血以及骨痛等症状。本组患者临床表现与之相符。
DKI成像技术是Jensen等[4]近年来提出的一种基于水分子非高斯扩散运动原理成像的新MR成像技术,是DWI成像技术的一种延伸。DWI成像技术已经在前列腺癌各方面进行了广泛的研究,普遍认为ADC值对前列腺癌的诊断具有重要价值。然而,DKI成像技术在前列腺癌中的应用却较少。DKI的定量参数K值代表了给定方向上的表观峰度系数,用于量化真实情况下水分子扩散偏离高斯分布的程度;D值代表经非高斯分布模型矫正过的扩散运动扩散系数,是指单位时间内水分子扩散位移的距离,能更真实的反应组织内水分子状态。目前DKI成像技术在前列腺癌的诊断和评估方面还存在一定的争议。多数学者认为b值较高(b值>1000 s/mm2)时细胞内相互作用可促进水分子非高斯扩散运动,导致弥散峰度增加,此时的K值才能反映真实的水分子运动状态,以及当采用高b值扫描时,DKI模型较单、双指数模型具有更高的诊断效能和可重复性。本组研究b值的选取为0、700、1400、2100 s/mm2,因为多b值及高b值的应用可减少灌注效应的影响,保证数据的可靠性及准确性,能为临床提供更加真实的参考价值。部分研究[5~10]认为DKI成像技术在前列腺癌的诊断与鉴别高、低级别前列腺癌方面较传统DWI有更好的诊断效能,D值与GS呈负相关,K值与GS呈正相关。本组研究中多模态MRI各参数值在鉴别中低级别与高级别的前列腺癌方面均具有统计学意义,表明三者对于不同级别的前列腺癌诊断均具有一定效能。三者中,ADC值和D值与GS评分呈负相关、K值与GS评分呈正相关,即肿瘤的级别越高,K值越高,D值与ADC值越低,与之相符。ADC值及D值与GS评分呈负相关,这可能与肿瘤生长过程中血管上皮的增加以及基质、血管间隙减少相关,K值与GS评分呈正相关,系与肿瘤微观结构复杂程度有关[6,11]。本研究结果还表明与传统DWI相比,DKI的D值在鉴别中低级别与高级别前列腺癌方面优势不明显,而K值则具有更好的诊断能力(AUC=0.878),这与Hectors等[12,13]结论一致,这可能是因为细胞内分子的相互作用促进了水分子的非高斯运动导致峰度分布的增高,所以K值具有较好的诊断效能。然而,Rosenkrantzet等[7]认为,高b值较长的回波时间可能会降低信噪比以及ADC值,这导致了与ADC相比K值偏高。除此之外,一项大样本量研究[14]的结果显示ADC值与DKI各定量参数高度相关,且具有相似的诊断性,但相较传统DWI,DKI并未显示出更明显的附加价值。部分研究[15,16]类似地亦认为DKI较传统的DWI在前列腺癌的诊断和分级方面并未显示出更多的诊断价值,这可能与有的研究使用的b值较低有关。还有研究表明将DWI与DKI成像技术相结合,对前列腺癌的诊断效能明显高于单独的K值或ADC值,在评估前列腺分级方面的特异性亦有显著提高。
本研究有以下几点局限性:①此研究为回顾性研究,样本量相对较少,偏倚难以完全避免;②本组研究仅以穿刺活检及MRI图像为参考,缺乏手术标本病理活检,因此存在一定偏倚;③本组研究没有对中等级别的前列腺癌进行具体区分,对结果的可靠性可能有一定影响。因此,本组研究的结论尚需以前列腺癌手术切除后的病理结果作为金标准的大样本研究进一步探讨、证实。综上所述,笔者认为ADC值、D值、K值均可作为鉴别低中级别及高级别前列腺癌的定量参数,其中K值具有更明显的优势,但DKI成像是否能作为传统DWI的补充序列在未来临床工作中进行应用尚需探讨。

