PARK2基因变异致早发型帕金森病一例
李茂林 曾涛 冯芹 王淳
患者 男性,44岁,中专学历。因右侧肢体抖动、行动迟缓8年,加重10余天,于2020年6月20日入院。患者入院前8年无明显诱因出现右上肢不自主抖动、右下肢行动迟缓,右上肢摆臂动作减少,洗脸、系纽扣、穿衣等精细活动缓慢,其余活动正常,无日间症状波动,无肢体无力、感觉异常、构音障碍、饮水呛咳等。外院门诊诊断为帕金森综合征,予吡贝地尔50 mg/次、3次/d和金刚烷胺0.10 g/次、3次/d口服,症状改善不明显,故未坚持门诊随访。入院前10天症状加重,右上肢抖动明显,双下肢行走缓慢、拖曳。为求进一步诊断,至我院就诊。既往史、个人史及家族史无特殊。入院后体格检查:卧立位血压正常,表情淡漠,言语清晰,对答切题,计算力和记忆力正常;双侧瞳孔等大、等圆,直径约3 mm,直接和间接对光反射灵敏,各向眼动充分,无眼震,未见角膜K-F环;双侧鼻唇沟对称,伸舌居中,软腭上抬好,悬雍垂居中,咽反射存在,无饮水呛咳;四肢无肌萎缩,肌力5级,肌张力增高,右侧肢体齿轮样肌张力增高,四肢腱反射正常,右侧肢体不自主抖动,右上肢摆臂动作减少,四肢深浅感觉和共济运动正常,病理征和脑膜刺激征阴性。实验室检查各项指标均于正常值范围。心脏、腹部、泌尿系统超声未见异常,膀胱残余尿量45 ml。肌电图无神经源性或肌源性损害。头部MRI未见明显异常。统一帕金森病评价量表第一部分(UPDRSⅠ)评分为1,UPDRSⅡ评分10,UPDRSⅢ评分27,UPDRSⅣ评分1;Hoehn-Yahr分期2.5级。简易智能状态检查量表(MMSE)评分为27,蒙特利尔认知评价量表(MoCA)评分为27。汉密尔顿焦虑量表(HAMA)评分为2,汉密尔顿抑郁量表(HAMD)评分为8,提示轻度抑郁。采集患者外周静脉血3 ml,送检广州金域医学检验中心行帕金森病相关基因检测,采用多重连接依赖性探针扩增(MLPA)技术,结果显示,患者存在PARK2基因外显子2、3和4杂合缺失(图1)。进一步行多巴丝肼(美多芭)试验,最佳症状改善发生于服药后第2小时,UPDRSⅢ评分自基线的27降至13,最佳症状改善率为51.85%(14/27)。临床诊断为早发型帕金森病(EOPD)。遂予以普拉克索0.125 mg/次、3次/d,多巴丝肼0.625 g/次、3次/d和金刚烷胺0.10g/d口服,运动症状逐渐改善。患者共住院12天,出院时运动迟缓改善;出院后2周门诊随访时偶有轻度右上肢抖动,暂未调整药物剂量。目前仍在随访中。
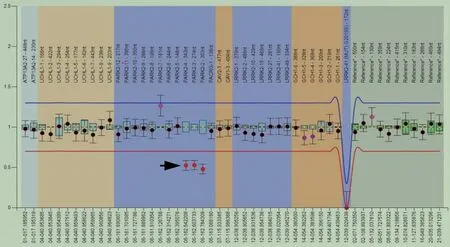
图1 MLPA扩增显示,患者存在PARK2基因外显子2、3和4杂合缺失(箭头所示)Figure 1 MLPA amplification showed deletion of heterozygosity in patient on exons 2,3,and 4 of PARK2 gene(arrow indicates).
讨 论
帕金森病(PD)是一种神经变性病,其特征为运动迟缓、静止性震颤、肌强直以及各种非运动症状(NMS)[1]。1987年,Quinn等[2]将早发型帕金森病定义为21~40岁出现运动症状的帕金森病。本例患者发病年龄<40岁,临床考虑为早发型帕金森病。有文献报道,西半球早发型帕金森病占全部帕金森病的5%~7%,日本则占10%~14%[3],我国尚缺乏大规模、多中心的流行病学资料。尽管帕金森病的病理生理学机制尚不清楚,但遗传因素和环境因素均认为与其潜在的发病机制相关[4]。已报道的基因变异位点越来越多,包括PARK1~23和GBA,这些基因变异约占早发型帕金森病的50%[3,5],其中,PARK2基因变异是早发型帕金森病患者常见变异基因,占10%~25%[6],男女比例无明显差异[7]。PARK2基因变异致早发型帕金森病遵循常染色体隐性遗传模式,目前已发现180种致病性变异,>50%定位于外显子2~4,以外显子3和4杂合或纯合缺失、外显子2碱基缺失、外显子3和5点突变居多[8-10]。PARK2基因外显子重排较点突变或小片段插入、缺失的致病性更高,导致疾病早发[8,11]。但现有研究并未见PARK2基因错义突变或截短突变与发病年龄、临床表现或疾病进展存在明确关联[8]。PARK2基因(NM-004562.2)定位于第6号染色体,编码Parkin蛋白,广泛表达于大脑黑质和蓝斑等部位,而Parkin蛋白最初被认为是E3泛素蛋白连接酶,是泛素-蛋白水解酶的重要组成部分,可被PINK1蛋白激活[12-13]。众所周知,多巴胺能神经元依赖于特定亚型钙离子通道以维持其自主起搏活动以及多巴胺代谢高能要求,故极其脆弱;而损伤的线粒体释放的活性氧(ROS)即为损伤多巴胺能神经元的主要有毒物质[14]。动物实验显示,PINK1蛋白在损伤的线粒体外膜聚集,招募Parkin蛋白,通过参与线粒体自噬而降解损伤的线粒体,从而抑制神经炎症和减少多巴胺能神经元丢失,维持多巴胺能神经元正常功能[15]。PARK2基因R42P、R46P、K211N、C212Y、C253Y、C289G和C441R变异可以导致PINK1蛋白募集的Parkin蛋白减少,损伤的线粒体自噬降解被抑制,从而揭示遗传性帕金森病的可能分子病理学机制[5]。本例患者存在PARK2基因外显子2、3和4杂合缺失,符合上述致病性变异类型。早发型帕金森病头部CT和MRI检查通常无异常。PET或SPECT研究显示,携带PARK2基因杂合突变的无症状个体纹状体18F-DOPA摄入量和突触前多巴胺转运体(DAT)密度均下降,证实该杂合突变对帕金森病的遗传易感性[16]。PARK2基因变异致早发型帕金森病在临床表现上与原发性帕金森病鉴别诊断困难,两种疾病均不同程度表现为运动迟缓、静止性震颤、肌强直,但前者病情进展缓慢,常合并一些非典型症状如腿部明显受累、冻结步态、自主神经功能障碍等,亦可出现左旋多巴诱导的症状波动和运动障碍,尽管认知功能障碍较少见,但冲动控制障碍可能更严重[3,17-20]。目前尚无针对早发型帕金森病治疗的随机对照试验,临床主要参照帕金森病临床治疗指南。Kasamo等[21]纳入131例早发型帕金森病患者,接受多巴胺激动剂、左旋多巴和抗胆
碱能药物治疗的患者比例分别为77.10%(101/131)、44.27%(58/131)和27.48%(36/131)。本文患者发病年龄较早,临床表现存在典型的运动迟缓、静止性震颤、肌强直,基因检测存在PARK2基因杂合突变,支持早发型帕金森病的诊断,但是患者父亲已死亡、母亲拒绝基因检测,未能完成先证者父母的基因检测结果以补充家系来源;治疗方面予以小剂量左旋多巴和普拉克索即可达较好疗效,后期随访时应注意运动并发症的发生。
早发型帕金森病的临床诊断与治疗仍面临较大挑战,一是神经科医师更倾向帕金森病以外的诊断,另一是青年患者对该病的接受程度降低[3],这也导致诊断与治疗的延误,严重影响患者生活和工作。本文病例提示临床医师面对青年患者,在排除其他疾病的同时,可借助基因检测明确诊断,予以及时和正规的帕金森病治疗和全程管理。
利益冲突无

