水生动物C1qDC蛋白研究进展
高园园,朱 雷,孔祥会
( 河南师范大学 水产学院,河南 新乡 453007 )
C1q是构成补体系统C1的重要成分,具有与配体结合的“球形”蛋白结构域,在结构上与肿瘤坏死因子十分类似。当C1q与免疫球蛋白IgM或IgG的Fc段结合后,C1q结构发生变化,进而导致C1r和C1s的相继活化,并启动补体经典激活途径[1-2]。C1q还具有清除凋亡细胞、识别病原和调节细胞生长等功能[3-6]。研究人员发现,许多非补体蛋白分子C末端也含有C1q“球形”结构域,并将这些蛋白统称为C1q结构域蛋白(C1qDC蛋白)[7-8],这些数量庞大的蛋白分子共同组成了一个崭新的蛋白家族——C1qDC蛋白家族。通过分析C1qDC蛋白在不同种类物种中的分布特点,研究人员认为C1qDC基因起始于原口类动物,并逐渐辐射至脊椎动物[9]。随着现代分子生物学技术的不断进步和发展,越来越多的C1qDC蛋白分子在水生无脊椎和低等脊椎动物中被发现和鉴定。研究发现,水生动物C1qDC蛋白在识别病原、抵御病原入侵等先天性免疫活动中发挥重要作用。因此,笔者综述了水生动物C1qDC蛋白近年来的最新研究进展,以期为水生动物C1qDC蛋白的相关研究提供理论依据。
1 C1qDC蛋白在水生动物中的鉴定及分布特点
C1qDC蛋白在贝类中广泛分布。通过全基因组和转录组序列数据库分析和挖掘,研究人员在长牡蛎(Crassostreagigas)中鉴定到337个具有完整编码区的C1qDC基因序列,这些C1qDC基因通常是成簇出现,且CDS区域较为完整,这一现象被认为和基因扩张有关。长牡蛎C1qDC基因组织表达具有显著特异性,在鳃和消化腺中的表达水平最高[10]。Zhang等[11-12]对生长在河口环境下的长牡蛎基因组数据的研究显示,C1qDC基因在长牡蛎消化腺中高丰度表达,并推测高丰度表达的C1qDC基因与抵御外界病原体感染有关。C1qDC基因的扩张现象在地中海紫贻贝(Mytilusgalloprovincialis)中亦有发现,地中海紫贻贝中的168个C1qDC基因序列在血细胞、消化腺和鳃中表达水平较高[13]。基于海湾扇贝(Argopectenirradians)EST数据库,Kong等[14]使用RACE技术鉴定到C1qDC基因全长序列,并发现其在肝胰腺中的表达丰度最高。Zhao等[15]利用RACE技术在三角帆蚌(Hyriopsiscumingii)中克隆鉴定到4个C1qDC基因全长序列,发现其在血细胞、肝胰腺、鳃、外套膜等免疫相关组织中广泛分布。Zhang等[16]自菲律宾蛤仔(Ruditapesphilippinarum)血细胞cDNA文库中克隆鉴定到4个C1qDC基因全长序列。郑哲[17]在马氏珠母贝(Pinctadafucatamartensii)中克隆鉴定到4个C1qDC基因,发现其在外套膜中表达量较高。
随着研究的深入,C1qDC基因在鱼类中也被陆续鉴定和发现。刘阁等[18]在七鳃鳗(Lethenteroncamtschaticum)肝脏cDNA文库中克隆获得19个结构各异的C1qDC基因序列,并将其分成了3个亚家族,为进一步深入研究C1qDC基因的结构和功能奠定了基础。通过对斑马鱼(Daniorerio)EST、cDNA和基因组数据库的综合检索,Mei等[19]共筛选出52个独立的C1qDC基因序列,并且该类基因编码的氨基酸序列结构呈现显著多样性。基于EST数据库,研究人员也从半滑舌鳎(Cynoglossussemilaevis)基因组中克隆鉴定到C1qDC基因,并对其编码的蛋白功能进行了一系列研究[20]。Nakamura等[21]在兰氏褐海鲫(Neoditremaransonnetii)血浆中分离鉴定到一种与岩藻糖结合的C1qDC蛋白,并且该C1qDC蛋白序列具有一些保守结构位点。
目前,C1qDC基因已经在多种水生动物中得到鉴定,主要包括长牡蛎[10,22-24]、地中海紫贻贝[13,25]、海湾扇贝[14,26]、栉孔扇贝(Chlamysfarreri)[27]、三角帆蚌(Hyriopsiscumingii)[15]、七鳃鳗[28]、许氏平鲉(Sebastesschlegelii)[29]、文昌鱼(Branchiostomafloridae)[30]、斑马鱼[31]、半滑舌鳎[20]和兰氏褐海鲫[21]等。C1qDC基因在水生无脊椎和脊椎动物中广泛存在,并在双壳类生物长牡蛎和地中海紫贻贝中发生较大规模的基因扩张,其数量远多于鱼类和人类中的C1qDC基因的数量,出现这一现象的原因可能与无脊椎动物缺乏获得性免疫、抵御外界不良环境和病原的能力较弱有关。
2 C1qDC基因扩张特点
2011年,Gerdol等[13]对地中海紫贻贝进行Sanger测序后,发现并鉴定到168个不同的C1qDC基因序列,随着新一代测序技术的出现,地中海紫贻贝中C1qDC基因数量增加至232个[32]。2015年,Gerdol等[10]通过深入挖掘牡蛎基因组数据,发现双壳类动物长牡蛎中C1qDC基因发生了基因扩张。随着研究的不断深入,研究人员发现C1qDC基因家族的扩张不局限于地中海紫贻贝中,在长牡蛎和美洲牡蛎(C.virginica)中也均有发生[10,33]。基于此,研究人员推测双壳类中C1qDC基因发生了大规模的基因扩张事件。
通过对地中海紫贻贝和牡蛎等基因组和转录组数据的研究,发现C1qDC基因在扩张过程中存在以下特点:(1)C1qDC基因序列丰度高、多样性高,C1qDC蛋白结构域呈现高变异性;(2)C1qDC基因在扩张过程中存在碎片化,如马氏珠母贝有234个C1qDC预测基因序列,但是生物信息学软件HMMER分析显示,在其基因组中有多达720个C1qDC基因位点[34];(3)与其他软体类动物相比(腹足类和头足类物种),双壳类动物的C1qDC转录本数目众多,这表明C1qDC基因家族的扩张可能仅限于双壳类动物。进一步研究发现,C1qDC基因的大规模扩张只发生在双壳纲的畸形亚纲和异齿亚纲中,而原鳃亚纲和古异齿亚纲中几乎不存在[10,13]。
3 水生动物C1qDC蛋白的结构及保守性
水生动物中C1qDC蛋白分子结构与人类补体C1复合物的C1qA、B和C肽链结构类似但也存在一些不同之处(表1)。根据C1qDC蛋白分子的结构域构成特点[9],发现水生动物C1qDC蛋白主要以C1q-like和球形头状C1q (ghC1q)两种类型存在。

表1 补体C1q分子与C1qDC蛋白结构与功能比较Tab.1 Comparison of structure and function between complement C1q and C1qDC protein
C1q-like蛋白羧基端编码一个“球形”C1q结构域[9],氨基端存在Gly-Pro-X(其中X可以是任何其他氨基酸)的氨基酸重复序列,可形成胶原样区。与C1q-like蛋白不同的是,ghC1q蛋白氨基端缺乏胶原样区,没有特定的基序。根据氨基末端是否编码信号肽序列,ghC1q蛋白又可分为头状分泌型C1q蛋白(sghC1q)和头状胞内型C1q蛋白(cghC1q)。sghC1q型蛋白氨基末端编码一段信号肽序列,所编码的蛋白具有胞外分泌能力,cghC1q型蛋白不含信号肽序列,不具有分泌到胞外的能力[9]。据此可知,C1qDC蛋白家族成员呈现出多样化的特点,这一结果与关键氨基酸的变化、胶原样区的有无以及与其他结构域的组成有关。
进一步分析水生动物C1qDC蛋白的“球形”C1q结构域发现其具有明显的保守性和高度的序列变异性[13]。对斑马鱼所有C1qDC序列进行多序列比对发现,这些蛋白序列虽然某些位置的氨基酸位点出现较大变异,但其C1q结构域的β折叠处氨基酸位点具有明显的保守性[19]。长牡蛎的多个C1qDC蛋白在C1q结构域处的氨基酸序列仅有1/4呈现出一定保守性,其余区域显示出高度变异性[10]。同样,地中海紫贻贝中C1qDC蛋白序列C1q结构域也呈现高度的序列变异性,仅有少量氨基酸残基显示保守性[13]。基于当前的研究结果,笔者将已经报道的水生动物和人类的C1qDC蛋白序列的数目与结构域构成特点进行了归纳总结(表2),可以发现C1qDC蛋白在不同物种中数目差异较大,结构域构成呈现多样化。
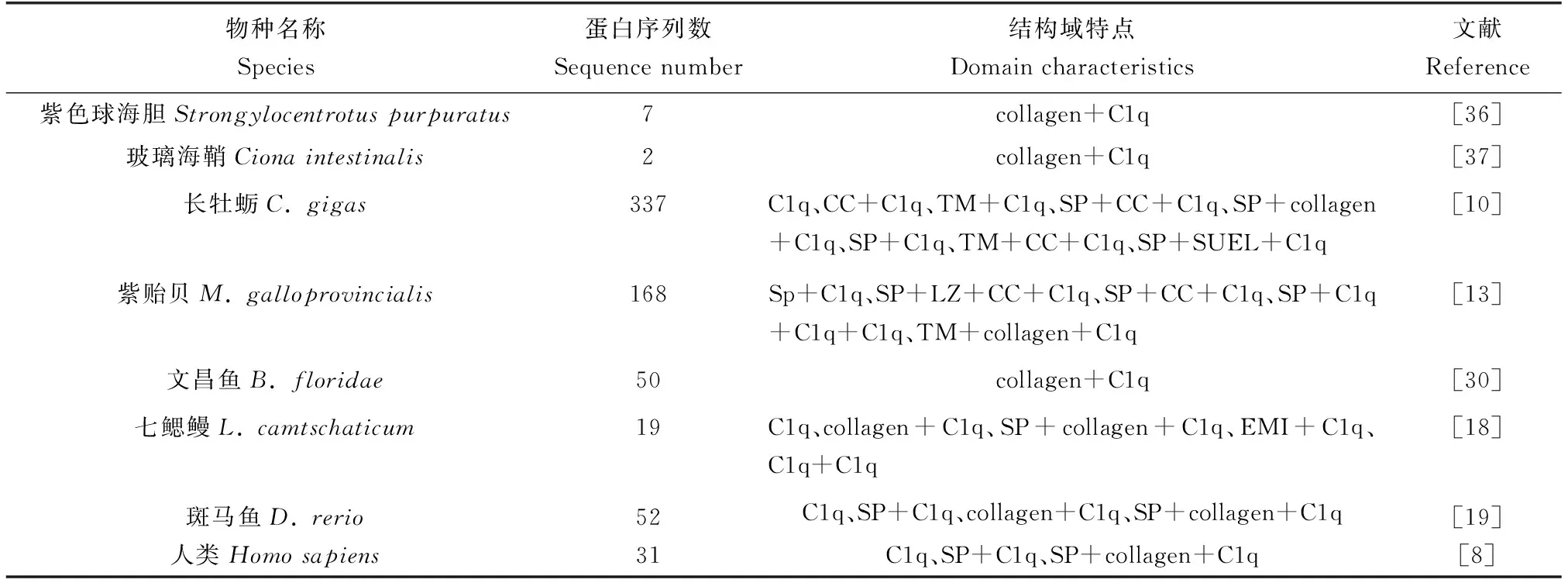
表2 不同物种C1qDC蛋白序列数目与结构特征Tab.2 Number and structural characteristics of C1qDC protein sequences in different species
4 水生动物C1qDC蛋白分类
4.1 贝类C1qDC蛋白分类
贝类C1qDC蛋白存在C1q-like和ghC1q 两种类型。Gerdol等[10]研究了C1qDC蛋白结构域组成,发现长牡蛎C1qDC蛋白主要存在C1q-like和ghC1q类型,但也发现C1q-like和ghC1q蛋白结构域组成具有多样性,有些具有胶原样区和C1q结构域,有些具有与胶原样区功能类似的卷曲螺旋结构和C1q结构域,有些具有信号肽和C1q结构域,有些仅具有C1q结构域,有些具有SUEL凝集素结构和C1q结构域。SUEL凝集素结构可与D-半乳糖苷/L-鼠李糖结合[35]。Gerdol等[13]根据相同的分类方法对地中海紫贻贝168个C1qDC蛋白序列进行分类,发现地中海紫贻贝中仅1个C1qDC蛋白序列以C1q-like类型存在;其他均以ghC1q类型蛋白存在。另外,在三角帆蚌[38]、栉孔扇贝[27]等贝类中,C1qDC蛋白均以ghC1q类型存在。
4.2 鱼类C1qDC蛋白分类
鱼类中C1qDC蛋白也有C1q-like和ghC1q两种类型。Mei等[19]在斑马鱼基因组数据库中鉴定到52条C1qDC蛋白序列,根据其N端是否含有胶原样区和信号肽结构,将斑马鱼C1qDC蛋白主要分为:(1)仅具有C1q结构域以及具有信号肽和C1q结构域的ghC1q类型蛋白;(2)具有胶原样区和C1q结构域以及具有信号肽、胶原样区和C1q结构域的C1q-like类型蛋白。刘阁等[18]根据七鳃鳗C1qDC蛋白结构域构成特点将其分为:(1)具有信号肽、胶原样区和C1q结构域以及具有胶原样区和C1q结构域的C1q-like类型蛋白;(2)仅具有C1q结构域的ghC1q类型蛋白。Huang等[30]在文昌鱼中获得50个C1qDC蛋白序列,其中42个蛋白为C1q-like类型,由胶原样区和C1q结构域组成。另外,在半滑舌鳎[20]、许氏平鲉[29]、牙鲆(Paralichthysolivaceus)[39]、兰氏褐海鲫[21]等鱼类中,C1qDC蛋白均以ghC1q类型存在。
4.3 其他水生动物C1qDC蛋白分类
C1qDC蛋白不仅在多种鱼类和贝类中被广泛研究,而且在海胆、海鞘和水蛭(Hirudomedicinalis)等其他水生动物中也被研究和分类。研究发现,紫色球海胆中有7个C1qDC蛋白序列,且均以C1q-like类型存在[36],玻璃海鞘中发现的2个C1qDC蛋白序列也均为C1q-like类型蛋白[37]。此外,Tahtouh等[40]发现,水蛭中C1qDC蛋白同样以C1q-like类型存在。
5 水生动物C1qDC蛋白的功能特性
5.1 C1q-like类型蛋白功能特性
C1q-like蛋白的免疫功能已在多种水生动物中得到研究。牡蛎C1q-like蛋白不仅具有抗菌活性,且可作为调理素增强牡蛎血细胞的吞噬作用,还能够介导牡蛎血细胞的迁移[41]。水蛭C1q-like蛋白具有趋化活性,可参与早期受损小神经间质细胞的恢复,在水蛭中枢神经修复过程中起着重要作用[40]。脊索动物海鞘中所发现的C1q-like蛋白具有类似补体C1q分子的作用,推测其可以特异性识别和结合病原微生物表面的寡聚糖结构[37]。文昌鱼中C1q-like蛋白可通过与脂多糖相互作用来抑制血小板聚集反应的发生[42]。七鳃鳗中分离出的C1q-like蛋白能够和N-乙酰葡糖胺相结合,并且可以与丝氨酸蛋白酶-A形成复合体进而裂解七鳃鳗体内的补体C3蛋白[43],推测其可能执行类似于凝集素的功能,参与补体凝集素途径。斑马鱼中C1q-like蛋白能够特异性结合斑马鱼免疫球蛋白IgM及人免疫球蛋白IgG和IgM,还能抑制经典途径引起的溶血反应[44],该结果也表明硬骨鱼中可能存在补体经典途径,而C1q-like蛋白在其中发挥启动补体经典途径的作用。通过以上研究可以看出,C1q-like蛋白可以识别细菌、增强细胞吞噬作用以及参与补体途径,以此在水生动物先天性免疫中发挥重要作用。
C1q-like蛋白不仅具有重要免疫功能,还有一些其他功能。Gerdol等[10]认为长牡蛎中具有卷曲螺旋结构域的C1q-like蛋白序列,可作为胶原样区结构域的一种替代,协助C1qDC蛋白形成多聚体,由此可见,该蛋白具有组织和稳定多组分C1qDC蛋白复合物的作用[45]。除此之外,C1q-like蛋白还在幼体发育过程中发挥重要调控作用。长牡蛎中C1q39基因在幼体发育的原肠胚到鼓膜幼虫阶段表达水平极高,而在成年组织中表达水平极低[10],说明C1q39蛋白在长牡蛎幼体发育过程中至关重要。
5.2 ghC1q类型蛋白功能特性
ghC1q蛋白分为sghC1q和cghC1q两类。sghC1q蛋白在双壳贝类和鱼类中广泛分布,并且在机体先天性免疫过程中发挥重要功能。三角帆蚌中sghC1q基因不仅参与了抗细菌免疫响应过程,而且敲除该基因后会导致免疫基因(TNF和WAP)表达水平降低,表明sghC1q蛋白在免疫信号通路中发挥关键作用[15,38]。海湾扇贝中鉴定到的sghC1q蛋白,对细菌和真菌具有明显的凝集活性,可发挥类似凝集素的功能[14]。研究人员推测在免疫球蛋白进化之前,C1qDC蛋白可以通过凝集素途径激活古老的补体系统[26]。在长牡蛎[46]、栉孔扇贝[27]及地中海紫贻贝[13]中,sghC1q蛋白可与多种细菌或病原类似物结合,执行模式识别受体功能。在鱼类中,sghC1q蛋白同样具有模式识别受体功能和凝集素活性。在虹鳟(Oncorhynchusmykiss)[47]、斑马鱼[31]和半滑舌鳎[20]中鉴定到的sghC1q基因可参与细菌刺激鱼体后的免疫响应过程。在兰氏褐海鲫血浆中分离得到的sghC1q蛋白可发挥凝集素活性,且在非还原条件下sghC1q蛋白可以形成多聚体[21]。许氏平鲉[29]中的sghC1q蛋白可作为模式识别受体,发挥结合LPS和PGN的作用,还可结合免疫球蛋白参与补体经典途径,以及作为调理素增强巨噬细胞对副溶血性弧菌(Vibrioparahaemolyticus)的吞噬活性。sghC1q蛋白不仅具有重要的免疫功能,而且参与机体幼体发育过程。斑马鱼受精后0~48 h,sghC1q基因表达水平受到严格调控并呈现出不同的表达模式。其中sghC1q01和sghC1q04以及sghC1q14基因在受精后约24 h开始转录,这一时期是咽部形成过渡期,说明其与咽部发育相关[31]。
cghC1q蛋白主要存在于环节动物之前的物种中,最早可追溯到芽孢杆菌属(Bacillus)细菌[18]。存在于低等生物中的cghC1q蛋白与哺乳动物的细胞周期相关蛋白高度相似,细胞周期相关蛋白能参与细胞增殖等细胞内的许多反应[48]。目前水生动物中关于cghC1q蛋白的报道较少,仅在长牡蛎[49]中鉴定得到cghC1q类型蛋白。该蛋白不仅可作为模式识别受体结合细菌,也可作为调理素来促进长牡蛎血细胞的吞噬作用[49],进而增强长牡蛎血细胞对大肠杆菌(Escherichiacoli)和灿烂弧菌(V.splendidus)的吞噬能力[50]。
根据已报道的水生生物中C1q-like和ghC1q蛋白的研究结果,可以发现两种类型的C1qDC蛋白均具有识别结合病原、促进细胞吞噬作用以及可能参与补体激活途径等免疫功能,并且在水生动物幼体发育过程中发挥重要调控作用。
6 总结与展望
补体系统是先天免疫系统的重要组成部分,其组成成分在先天性免疫反应中发挥至关重要的作用[51-56]。C1qDC蛋白作为水生动物补体系统的重要成分,数目繁多,功能多样[57-60]。C1qDC蛋白不但参与水生动物抵御外界病原入侵的过程,而且具有模式识别和调节补体的功能。随着测序技术不断提高,越来越多的水生动物C1qDC蛋白序列被鉴定出来,为该蛋白家族成员的研究工作提供了丰富的数据支撑;既扩展了对该家族蛋白成员的认识,又为深入探索C1qDC蛋白家族蛋白成员的功能和补体系统激活等相关研究提供重要的理论依据。
目前,关于水生低等脊椎动物和无脊椎动物C1qDC蛋白的研究还处于初级阶段,尚有许多科学问题值得进一步探索,主要体现于:(1)C1qDC蛋白家族序列在从低等脊椎动物到哺乳类中广泛存在,但是对于该基因的起源和系统进化关系尚待深入研究;(2)水生动物C1qDC蛋白能与病原或免疫球蛋白结合,这种相互作用已被映射到“球形”C1q结构域的不同结合位点[61],然而,尚未发现促进这种相互作用的特定氨基酸基序;(3)C1qDC蛋白家族成员的功能及其调控的分子机制仍需深入研究。查明C1qDC蛋白家族成员的起源、功能及其调控的分子机制,对于提高水生动物免疫能力和疾病防控水平具有重要理论意义。

