糖皮质激素受体功能对大鼠前额叶单胺氧化酶A的影响及其交互作用*
陈燕惠 卢洪珠 郑 杰 章飞霞 林晓霞
(福建医科大学附属协和医院儿科,福州 350001)
中枢神经系统糖皮质激素(glucocorticoid,GC)改变与GC受体(glucocorticoid receptor,GR)表达异常,与行为异常如注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)、情绪改变、认知行为关系密切[1-2]。已有研究表明,GC 能够通过多种途径影响五羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)等单胺类神经递质[3-4]。单胺氧化酶A(monoamine oxidase A,MAO A)是单胺类神经递质的关键降解酶之—,能够直接调控5-HT、NE、DA 的水平[5-8]。GC-GR 复合物能够与MAO A 启动子中的GC 反应元件(glucocorticoid response elements,GRE)结合,促进MAO A 基因的表达。MAO A 启动子区存在Sp 结合位点,能够与Sp1 Krüppel 样转录因子家族成员结合。GC可增加Krüppel 样转录因子-11(transcription factor Krüppel-like factor 11,KLF11)的mRNA 及蛋白水平,过表达的KLF11 可增加MAO-A 的mRNA 水平及其活性[9-10]。提示GC/GR 可能通过KLF11、Sp1 与MAO A 发生交互作用。本课题拟探究GR 激动剂、抑制剂对神经细胞KLF11、Sp1和MAO A 表达的影响,及GR 与MAO A 交互作用的可能通路,以期为揭示ADHD 的发病机制和治疗新途径提供依据。
1 材料和方法
1.1 实验动物
新生48 h 内SD 乳鼠24 只(清洁级,由福州吴氏实验动物中心提供)。大鼠实验前均置于洁净环境中自由进食饲料和饮用自来水,室温控制于23℃±2℃,湿度保持在约56%,12 h 间断照明,24 h 定期进行紫外杀菌消毒和排风,避免强光和强声刺激。实验动物的使用严格遵循《实验动物管理条例》相关规定。
1.2 细胞培养及药物干预
SD 乳鼠75%乙醇消毒,用乙醚吸入麻醉后断颈处死,分离出前额叶,于37℃培养箱中消化25 min,接种于1%多聚赖氨酸预包被的6 孔板中,置于37℃培养箱培养。前额叶神经细胞培养48 h 后,观察其神经细胞形态并拍照。换液后,根据添加药物来分组,前额叶神经细胞随机分为DEX 组、米非司酮(mifepristone,RU486)组、对照组3 组。DEX 组将2 μL 100×103nmol/L DEX 溶液加入含2 mL 神经元专用培养基的6 孔板中,使DEX 终浓度为100 nmol/L;RU486 组则将20 μL100 μmol/L RU486 溶液加入含2 mL 神经元专用培养基的6 孔板各孔中,使RU486 终浓度为1 μmol/L;对照组的各孔加入20 μL 相同溶剂干预。各组神经细胞继续培养48 h。
1.3 KLF11、Sp1 和MAO A 表达测定
KLF11(北京博奥森生物技术有限公司)单克隆抗体按照1∶500 稀释,一抗Sp1(Cusabio 公司)和MAO A(美国 Abcam 公司)均1∶100 稀释,依照迈新KIT 9706 超敏免疫组织化学试剂盒操作说明,孵育一抗及生物素化二抗,DAB 染色3 min,梯度乙醇脱水,中性树胶封片,呈现棕黄色部分为阳性表达。
1.4 图像分析
各个组别的玻片于普通光学显微镜下观察,并拍摄结果。先在10 倍×10 倍下定位,每张玻片40倍×10 倍下随机取5 个不重叠视野,利用 Image-Pro-Plus 6.0 图像分析软件分别分析GR 平均积分光密度值(mean optical density,MOD= IOD SUM/AREA SUM),前额叶神经细胞KLF11、Sp1和MAO A 免疫细胞化学显色的累积光密度值,结果取均值。所有组别光密度值的测量均在相同的光学环境下完成。
1.5 统计学处理
计量资料以±s表示。使用SPSS 21.0统计学软件进行数据分析和处理,两组均数的比较采用两独立样本t检验,多组均数间的比较采用单因素方差分析,其中Sp1和 MAO A累积光密度值符合双变量正态分布,相关性分析用Pearson 相关分析,以上分析检验水准α=0.05,P<0.05表示差异具有统计学意义。使用软件GraphPad Prism 6.02进行绘图。
2 结果
2.1 前额叶神经细胞KLF11 表达
与对照组(0.108±0.01)比较,DEX 可明显提高KLF11 的表达(0.139±0.01)(P<0.05),RU486 对KLF11 的表达(0.124±0.00)也有促进作用(P<0.05),但较DEX 低(P<0.05)(图1)。

图1 各组前额叶区神经细胞KLF11 表达结果,免疫细胞化学染色,×200。A:对照组;B:DEX 组;C:RU486 组.
2.2 前额叶神经细胞Sp1 和MAO A 表达
结果显示(表1),Sp1 表达水平DEX 组较对照组明显增高(P<0.01);RU486 组Sp1 表达水平较对照组降低(P<0.05)。MAO A 的表达水平DEX 组比对照组显著增多(P<0.01);RU486 组较对照组MAO A 表达水平降低(P<0.05)(图2)。
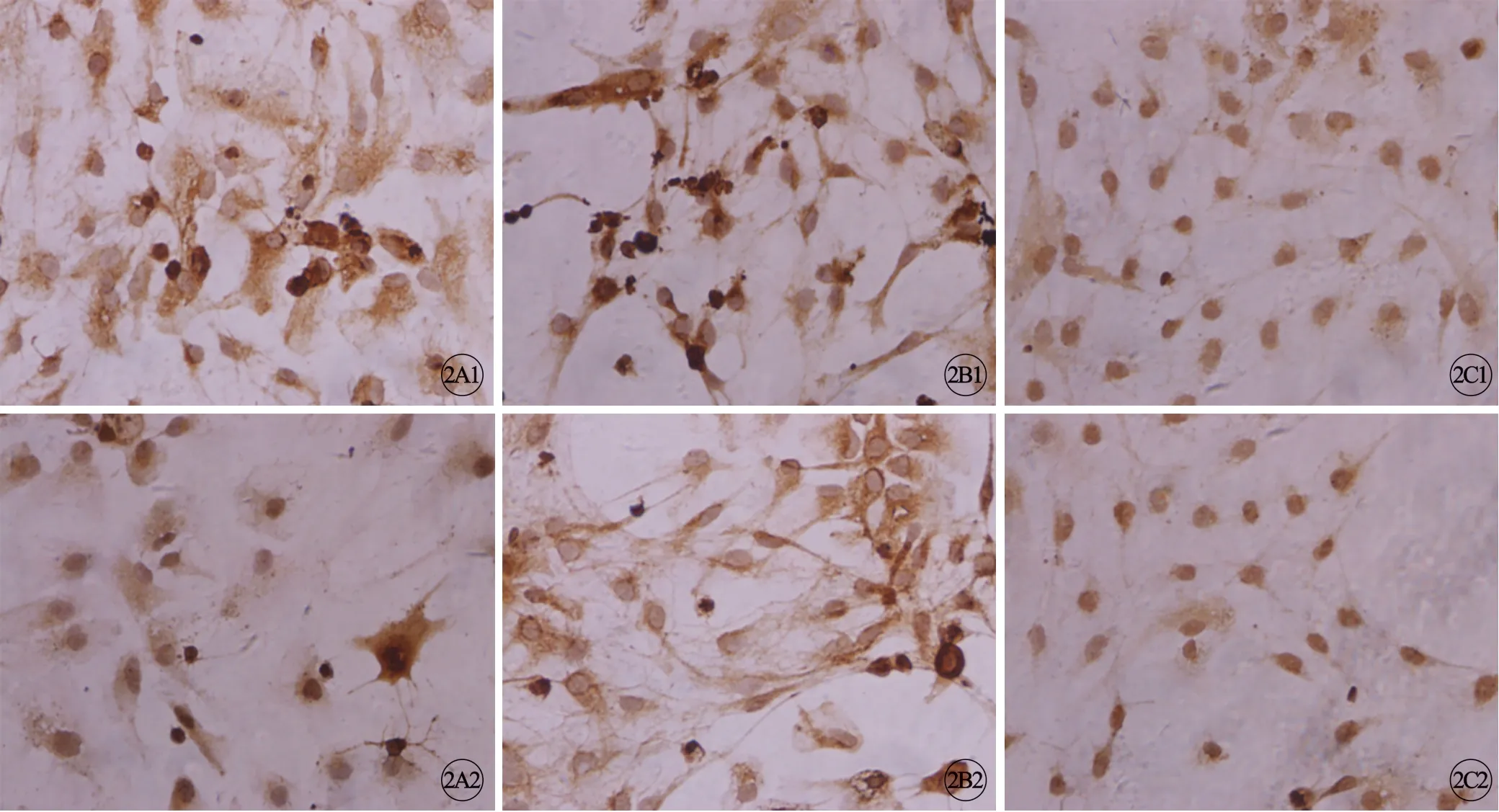
图2 各组前额叶区神经细胞Sp1(A1~C1)和MAO A(A2~C2)表达结果,免疫细胞化学染色,×400。A:对照组;B:DEX 组;C:RU486 组.
表1 前额叶区各组细胞Sp1 和MAO A累积光密度(IOD)值(n=8,±s)
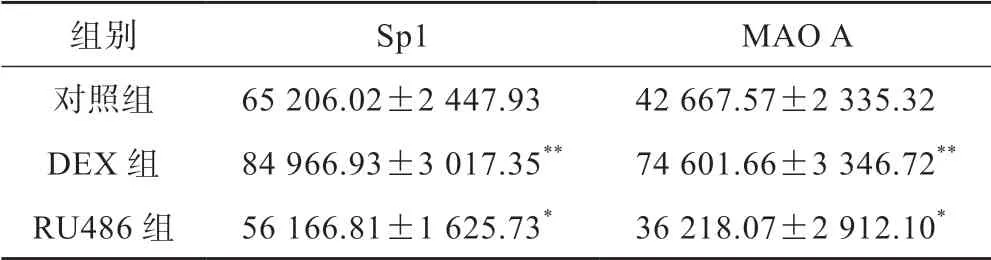
表1 前额叶区各组细胞Sp1 和MAO A累积光密度(IOD)值(n=8,±s)
*P<0.05,**P<0.01 vs 对照组
组别Sp1MAO A对照组65 206.02±2 447.9342 667.57±2 335.32 DEX 组84 966.93±3 017.35**74 601.66±3 346.72**RU486 组56 166.81±1 625.73*36 218.07±2 912.10*
2.3 前额叶神经细胞Sp1 和MAO A 表达相关性分析
前额叶神经细胞Sp1 和MAO A 的累积光密度值统计学资料均符合双变量正态分布,相关分析显示r=0.965,两者呈正相关(P<0.01)(图3)。
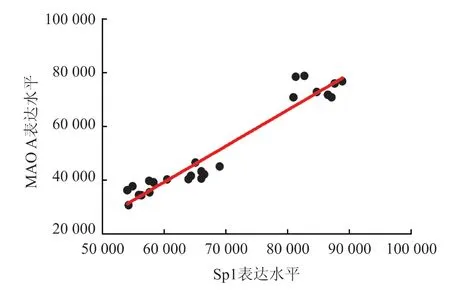
图3 前额叶神经细胞Sp1 和MAO A 累积光密度值散点图和相关关系
3 讨论
近年研究表明,ADHD 患者存在与下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA 轴)密切相关的应激时GC 反应迟钝,GC 觉醒反应低下及日间血清GC 水平低下,GC 水平/知觉压力比率较高等特征[11-12]。单胺类神经递质在ADHD 发病中发挥重要作用[13]。
MAO 是单胺类神经递质最主要的降解酶,该基因缺陷导致的Brunner 综合症患者存在ADHD 样表现如冲动、睡眠障碍、低智商等[14-15]。动物实验表明长期暴露于DEX 可以表现出剂量依赖的前额叶区MAOA 及MAOB 的活性增加及5-HT 周转率增加[16]。Manoli 等[17]报道在人类骨骼肌细胞中,GC 能促进MAO A 基因和蛋白的表达,并存在剂量和时间效应,而GR 抑制剂RU486 或Sp1 结合位点的阻滞剂光神霉素会影响MAO A mRNA 的表达。
MAO A 的水平在转录及分解代谢等环节接受多种途径的调控。MAO A 的转录涉及转录因子SP1、KLF11,自噬相关的经典通路SIRT1-FOXO1等[18]。其中KLF11 属于Sp1 Krüppel 样转录因子家族,是一种启动或关闭基因组其他基因的角色“主要调节子”,在体内广泛表达并通过在启动子区域绑定不同的序列,触发RNA 聚合酶Ⅱ调节转录起始[19]。KLF11 能结合MAO A 启动子进而促进MAO A 表达,抑郁症及慢性压力能够诱导前额叶KLF11-MAO A 通路的异常,该通路在调节神经细胞的生长、分化、凋亡中发挥重要作用[19]。
GR 功能是否受KLF11-MAO A 通路介导而影响MAO A 表达?本研究应用GR 抑制剂观察其对前额叶原代培养神经细胞KLF11 表达的影响,结果显示RU486 也能提升KLF11 的表达,尽管RU486对KLF11 表达的促进作用较DEX 为低。提示GR抑制剂RU486 对MAOA 表达的影响可能还涉及其他调节通路。
Sp1 是Sp/KLF 家族26 个成员中的一个转录因子,几乎存在于所有哺乳动物细胞中,和许多蛋白质存在交互作用,包括其他转录因子、转录起始复合体、调节因子等,能增强目的基因的调节功能[20]。Sp1 结合于细胞基因启动子区富含GC 序列和Sp1 结合位点处。GR 通过转录因子Sp1 间接作用于MAO A 的Sp1 结合位点,4 个Sp1 结合位点结合到Sp1 上对MAO A 的活性和蛋白表达影响不同,第3 个Sp1 结合位点影响最大。过表达的Sp1 可增强MAO A 启动子的活性,siRNA 介导的Sp1 水平降低抑制内源性MAO A 启动子活性和表达水平,其机制涉及Sp1 和cAMP 信号传导途径,提示GC/GR 可能通过Sp1 与MAO A 有交互作用[21]。本研究结果显示原代培养前额叶和海马区的神经细胞予以GR 激动剂DEX、GR 抑制剂RU486 干预后,不论是前额叶还是海马区神经细胞Sp1 的累积光密度值DEX 组比对照组显著增多,RU486 组较对照组Sp1表达水平降低,提示GR 激动剂可以提高Sp1 的表达水平。
研究提示GR 和Sp1 对于GC 诱导的MAO A mRNA 的表达是必须的[20]。本实验结果与该研究结果相似,前额叶神经细胞Sp1 和MAO A 累积光密度值的相关性分析均显示两者存在正相关,提示GC/GR 与MAO A 之间可能通过Sp1 起交互作用。
综上所述,GR 功能与前额叶神经细胞MAO A 表达水平密切相关,经GC 作用后的神经细胞,KLF11、Sp1 和MAO A 表达水平均明显升高,其中Sp1 和MAO A 的表达存在正相关,提示GC/GR与MAO A 之间可能通过KLF11、Sp1 起交互作用。这一机制也有助于解释如ADHD 等行为障碍患者HPA 轴功能与MAO A 之间的交互作用及机制,为这些行为异常发生机制和防治提供了新的思路。