3种脂肪酸对生物被膜形成及厚壳贻贝幼虫附着变态的影响
梁箫,丁文扬,张驰,蔡雨珊,杨金龙,3*
(1.上海海洋大学 国家海洋生物科学国际联合研究中心,上海 201306;2.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;3.南方海洋科学与工程广东省实验室(广州),广东 广州 511458)
厚壳贻贝Mytiluscoruscus隶属于贻贝科Mytilidae,是中国重要的海产经济贝类之一,广泛分布于中国的渤海、黄海、东海等海区[1-3]。厚壳贻贝也是一种典型的大型污损生物,常出现在船舶的底部、桥墩及其他水下设施上,对其进行腐蚀, 从而造成巨大的经济损失[4]。厚壳贻贝在其生活史中会经历由浮游生活向底栖生活转变的过程,这一过程被称为附着变态[5]。附着变态的成功与否不仅关系到厚壳贻贝的生长发育,同时对于海洋大型污损生物的防治也具有重要意义。
在海洋环境中,细菌主要以生物被膜形式存在,且这种存在形式对厚壳贻贝等大型污损生物的附着变态有一定的影响[6]。研究发现,自然生物被膜的细菌密度与地中海贻贝、鹿角杯形珊瑚的附着变态率呈正相关[7-9];单一海洋细菌形成的生物被膜的细菌密度和厚壳贻贝幼虫附着变态间存在非常明显的关联性[10]。通过影响生物被膜的形成,如降低其细菌密度等生物学特性的方法可能对抑制厚壳贻贝等大型污损生物的附着变态具有一定的作用。影响生物被膜形成的因素较多,其中,脂肪酸作为一种天然分子具有抑制微生物被膜形成的巨大潜力[11]。研究发现,细胞膜的脂肪酸组成会影响其生物的物理性质(即流动性和柔韧性),通过影响细胞黏附改变细胞膜流动性及调节群体感应系统从而抑制生物被膜的发育[12-13]。可见,可以考虑使用脂肪酸抑制细菌生物被膜的形成,从而降低其细菌密度的方式来控制厚壳贻贝幼虫的附着变态率,达到防治大型海洋生物污损的效果。
本研究中,选取海假交替单胞菌Pseudoalteromonasmarina[14]为研究对象,选取3种效果较为有效的脂肪酸,通过3种脂肪酸与海假交替单胞菌形成的生物被膜的特征变化,探究脂肪酸对海假交替单胞菌生物被膜的细菌密度、膜厚、胞外物质等生物学特性的影响,从而解释脂肪酸、细菌生物被膜及厚壳贻贝幼虫附着变态三者间的关系,旨在为大型海洋污损生物的防治工作及厚壳贻贝的养殖产业提供科学参考。
1 材料与方法
1.1 材料
试验用厚壳贻贝幼虫取自浙江省舟山市嵊泗县(N 30°69′、E 122°46′),幼虫在实验室条件下暂养7 d后进行试验。暂养条件为18 ℃充气培养,每天换水投喂饵料。
试验用细菌海假交替单胞菌[14]分离自自然微生物被膜(保藏号MCCC 1K03544),保存于-80 ℃冰箱中。棕榈酸(十六烷酸,Palmitic acid)、硬脂酸(十八烷酸,Stearic acid)、油酸(十八烯酸,Oleic acid)(Anpel,中国)使用二甲基亚砜(DMSO)(Sigma,美国)助溶于灭菌过滤海水。
1.2 方法
1.2.1 生物被膜的制备 参考Yang等[10]的方法,将海假交替单胞菌在2216E固体培养基上划线,挑选单菌落使用2216E液体培养基在25 ℃下以200 r/min培养24 h。将扩配后的细菌收集在离心管中,以3 500 r/min离心15 min,弃上清,留沉淀。加入灭菌过滤海水吹打混匀,以3 500 r/min离心15 min,弃上清,留沉淀,重复上述步骤3次。最终将沉淀使用灭菌过滤海水定容至50 mL,充分混匀至细菌悬浊液。取100 μL细菌悬浊液加入9 900 μL灭菌过滤海水稀释,充分混匀后取1 mL使用0.22 μm滤膜(Whatman)过滤,然后用体积分数0.1%的吖啶橙染色5 min,待染色液风干后使用荧光显微镜(Olympus BX51)在1 000倍下随机选10 个显微镜视野进行细菌计数,最终通过计算确定细菌密度。根据所得细菌密度向装有无菌载玻片(12.7 mm×38.1 mm)的无菌培养皿(64 mm×19 mm)中加入相应量菌液,并使用灭菌过滤海水定容至20 mL,培养48 h。
1.2.2 海假交替单胞菌与脂肪酸共同形成生物被膜 将灭菌处理后的载玻片置入无菌培养皿中,根据细菌密度分别加入相应细菌菌液和棕榈酸、硬脂酸、油酸及混合脂肪酸(质量比1∶1∶1),使用灭菌过滤海水定容至20 mL,最终使得细菌菌液浓度为5×108cells/mL,脂肪酸质量浓度为0、0.01、0.1、1、5 μg/mL,同时设置DMSO、肾上腺素(EPI)和空白组,每个组设9个平行,各组细菌于18 ℃黑暗环境下培养48 h,最终形成生物被膜。
1.2.3 生物被膜细菌密度计数 参考Yang等[10]方法,采用体积分数为5%的福尔马林将培养好的生物被膜进行固定,然后采用体积分数为0.1%的吖啶橙溶液对生物被膜染色5 min,待染色液风干后使用镜油制片,然后通过荧光显微镜(Olympus BX51)在1 000倍视野下随机选取10个细菌视野进行统计,每组设置3个平行。
1.2.4 幼虫附着试验 取出培养好的细菌生物被膜,使用灭菌过滤海水轻轻涮洗,洗去表面浮游细菌。然后将生物被膜载玻片放入盛有20 mL灭菌过滤海水的无菌培养皿中,使用解剖镜向培养皿中分别加入20只厚壳贻贝的眼点幼虫,于18 ℃黑暗环境下培养,并分别统计12、24、48、96 h后的变态个体,并除以样本基数,计算出变态率。
1.2.6 生物被膜激光共聚焦 染色后的生物被膜采用共聚焦显微镜(徕卡TCS SP8)与LAS X软件进行共聚焦拍摄。共聚焦显微镜及软件设置为物镜63倍,z-step 0.2 μm,像素1 024×1 024。每片生物被膜随机选取3个显微镜视野拍摄,每组设置3个平行进行拍摄分析。
1.3 数据处理
采用JMP 10.0.0软件对数据进行统计分析和相关性检验。附着变态率与细菌密度、膜厚、胞外产物生物量的相关性检验采用多元分析方法,显著性水平设为0.05。用Image J软件处理共聚焦显微镜拍摄图像,计算生物被膜胞外产物共聚焦体积。
2 结果与分析
2.1 脂肪酸与海假交替单胞菌共同形成的生物被膜对厚壳贻贝幼虫附着变态的影响
从图1可知,加入不同种类及质量浓度的脂肪酸与海假交替单胞菌共同形成的生物被膜会对厚壳贻贝幼虫有不同的诱导活性。当单独加入一种脂肪酸时,与海假交替单胞菌单独形成的生物被膜的幼虫附着变态率相比棕榈酸和硬脂酸分别只在质量浓度为5 mg/L时,幼虫附着变态率显著上升(P<0.05),而油酸在4个浓度下的幼虫附着变态率均无显著性差异(P>0.05)。相比而言,混合脂肪酸(质量比1∶1∶1)则显示出了不同的结果,随着混合脂肪酸质量浓度的增加,其共同形成的生物被膜对厚壳贻贝幼虫的附着变态率逐渐升高;当混合脂肪酸质量浓度为0.01 mg/L时,其所共同形成的生物被膜的附着变态率(32.8%),相比海假交替单胞菌单独形成的生物被膜的幼虫附着变态率(30.5%)无显著性差异(P>0.05);当混合脂肪酸质量浓度为5 mg/L时,其所共同形成的生物被膜的附着变态率(40.5%)达到最高,相比海假交替单胞菌单独形成的生物被膜的幼虫附着变态率显著性升高(P<0.05)(图1)。
2.2 混合脂肪酸对生物被膜细菌密度的影响
从图2可见:所有组海假交替单胞菌初始细菌密度均为5×108cells/mL,不同质量浓度的混合脂肪酸与海假交替单胞菌共同形成的生物被膜细菌密度会产生不同结果;当混合脂肪酸质量浓度为0.01 mg/L时,共同形成的生物被膜细菌密度(1.79×107cells/cm2)与单一细菌(脂肪酸质量浓度为0 mg/L)形成的生物被膜细菌密度(1.78×107cells/cm2)无显著性差异(P>0.05);当混合脂肪酸质量浓度为0.1 mg/L时,共同形成的生物被膜细菌密度(1.70×107cells/cm2)相比单一细菌显著降低(P<0.05);随着混合脂肪酸质量浓度的升高,生物被膜细菌密度随之降低,混合脂肪酸质量浓度为5 mg/L时,共同形成的生物被膜细菌密度(1.40×107cells/cm2)达到最低(P<0.05)。
2.3 混合脂肪酸对生物被膜形态与厚度的影响
从图3可见:所有组海假交替单胞菌初始细菌密度均为5×108cells/mL,不同质量浓度的混合脂肪酸会影响其与海假交替单胞菌共同形成的生物被膜细菌分布及生物被膜膜厚;当混合脂肪酸质量浓度为0.01 mg/L时,共同形成的生物被膜膜厚(4.82 μm)与单一细菌(脂肪酸质量浓度为0 mg/L)形成的生物被膜膜厚(4.89 μm)无显著性差异(P>0.05);当混合脂肪酸质量浓度为0.1 mg/L时,共同形成的生物被膜膜厚(4.51 μm)相比单一细菌形成的生物被膜膜厚显著降低(P<0.05);随着混合脂肪酸质量浓度的增加,共同形成的生物被膜的膜厚随之降低,当混合脂肪酸质量浓度为5 mg/L时,其与海假交替单胞菌共同形成的生物被膜的膜厚(3.44 μm)达到最低,且具有显著性差异(P<0.05)。

图3 共聚焦显微镜下不同质量浓度混合脂肪酸的生物被膜形态与膜厚
2.4 混合脂肪酸对生物被膜胞外多糖的影响
选取5 mg/L混合脂肪酸与海假交替单胞菌共同形成生物被膜,观察其对生物被膜胞外多糖的影响。从图4可见,5 mg/L混合脂肪酸与海假交替单胞菌共同形成生物被膜的α多糖、β多糖的生物量均与单一细菌形成的生物被膜无显著性差异(P>0.05)。

图4 共同形成的生物被膜胞外α多糖和β多糖的共聚焦显微镜图像和生物量
2.5 混合脂肪酸对生物被膜胞外蛋白质的影响
选取5 mg/L混合脂肪酸与海假交替单胞菌共同形成生物被膜,观察其对生物被膜胞外蛋白质的影响。从图5(a)、(b)可知,5 mg/L混合脂肪酸与海假交替单胞菌共同形成的生物被膜胞外蛋白质与海假交替单胞菌单独形成的生物被膜胞外蛋白质相比无显著性差异(P>0.05)。
2.6 混合脂肪酸对生物被膜胞外脂类的影响
选取5 mg/L混合脂肪酸与海假交替单胞菌共同形成生物被膜,观察其对生物被膜胞外多糖的影响。由图5(c)、(d)可知,5 mg/L混合脂肪酸与海假交替单胞菌共同形成的生物被膜胞外脂类(生物量体积为150 μm3)与海假交替单胞菌单独形成的生物被膜胞外脂类相比(生物量体积为89.60 μm3)有显著升高(P<0.05)。
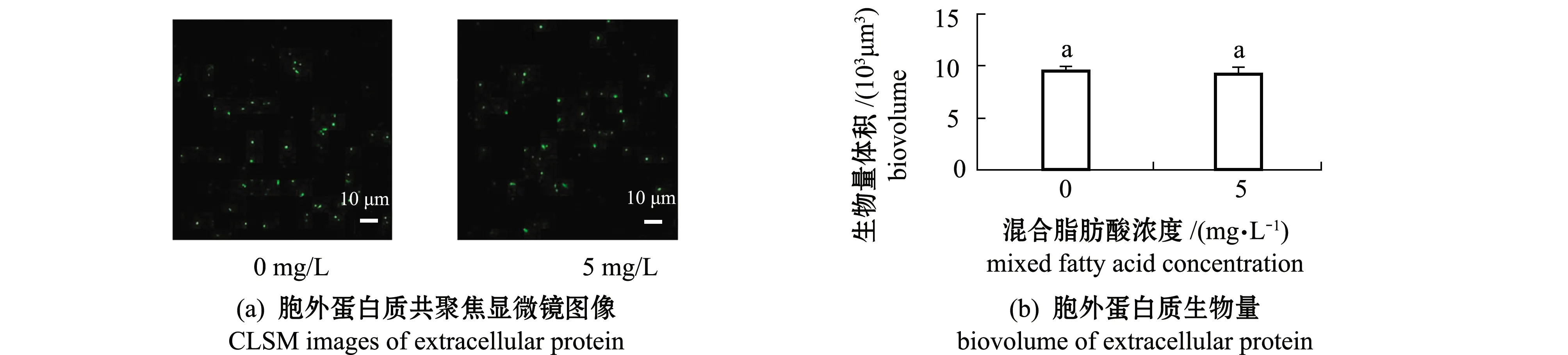
图5 共同形成的生物被膜胞外蛋白质和脂类的共聚焦显微镜图像和生物量
3 讨论
脂肪酸是一种天然分子,广泛分布于所有生命形式中[11]。脂肪酸能够影响生物被膜的形成,如某些脂肪酸可以选择性地抑制或破坏金黄色葡萄球菌[16-17]、铜绿假单胞菌[18-19]、白色念珠菌[20-21]、黏质沙雷氏菌、伯克霍尔德菌及弧菌等[22-24]生物被膜的形成。同时生物被膜会诱导厚壳贻贝幼虫的附着变态[3,10]。然而脂肪酸是否可以通过影响细菌生物被膜的形成抑制厚壳贻贝幼虫附着变态尚未有试验验证。因此,本研究中使用不同质量浓度的棕榈酸、硬脂酸、油酸及3种脂肪酸的混合物与海假交替单胞菌共同培养生物被膜,并对所形成生物被膜的密度、膜厚、胞外产物,以及对厚壳贻贝幼虫附着变态的诱导活性进行了研究。
3.1 3种脂肪酸对生物被膜形成的影响
本试验中,不同质量浓度脂肪酸对生物被膜形成有不同的影响,当3种混合脂肪酸质量浓度为5 mg/L时,生物被膜的细菌密度和膜厚达到最低值。同时,通过共聚焦图像可以看出,其相比海假交替单胞菌单独形成的生物被膜细菌数量更少且更加分散。有研究表明,棕榈酸质量浓度为12.8 mg/L时,将会抑制Pseudomonasaeruginosa生物被膜的形成[18];外源添加油酸抑制了金黄色葡萄球菌的黏附和生物被膜的形成[25-26];此外,含有棕榈酸、硬脂酸、油酸和亚油酸的牛肉正己烷提取物及其合成混合物对大肠杆菌生物被膜的形成具有抑制作用[27]。这些结果均与本试验研究结果一致,表明脂肪酸可以抑制细菌生物被膜的形成。
3.2 脂肪酸与海假交替单胞菌共同形成的生物被膜对厚壳贻贝幼虫附着变态的影响
被脂肪酸所影响的生物被膜是否也能导致厚壳贻贝幼虫附着变态率的下降,本试验中幼虫试验结果发现,经过脂肪酸处理后密度和厚度下降的生物被膜反而促进了厚壳贻贝幼虫的附着变态,这与最初试验设计时所预想的结果完全相反。这表明,影响厚壳贻贝幼虫附着变态的因素除了生物被膜的细菌密度及膜厚之外,还存在其他影响因素。生物被膜作为细菌的一种主要存在形式,可以诱导厚壳贻贝等海洋无脊椎动物的附着变态[6-10]。生物被膜的组成成分较为复杂,主要包含细菌及胞外产物两大部分。生物被膜的细菌密度、膜厚等生物学特征是影响海洋无脊椎动物附着变态的重要诱因[7-9]。此外,本试验中还对混合脂肪酸处理后的海假交替单胞菌生物被膜的细菌密度与厚壳贻贝幼虫附着变态率进行了相关性分析,结果发现,生物被膜的细菌密度与幼虫附着变态率无显著相关性(P<0.05)。
生物被膜的胞外产物主要包含多糖、蛋白质、脂类等[28]。对Pseudoalteromonaslipolytica的研究发现,AT00_08765基因的敲除导致纤维素的过量产生,从而抑制厚壳贻贝幼虫的附着[29]。海假交替单胞菌中01912基因的缺失导致可拉酸含量增加,从而促进了厚壳贻贝幼虫的附着变态[30]。海假交替单胞菌中鞭毛蛋白可以促进厚壳贻贝幼虫的附着变态[31]。对Pseudoalteromonasatlantica和Shewanellaloihica生物被膜与厚壳贻贝幼虫附着变态的研究发现,其附着变态率的下降可能是由于生物被膜胞外多糖或胞外脂含量的减少所导致[32]。这些研究结果均表明,厚壳贻贝幼虫附着变态除与生物被膜细菌密度有关外,还可能与生物被膜胞外产物有关。因此,本研究中通过共聚焦染色分析法,对3种脂肪酸混合物质量浓度为5 mg/L时(厚壳贻贝幼虫附着变态率最高)所形成的生物被膜的胞外多糖、胞外蛋白质、胞外脂类进行了分析。结果显示,胞外多糖、胞外蛋白质含量无明显变化,而生物被膜胞外脂含量显著升高。通过以上结果推测,幼虫附着变态率的上升可能与生物被膜胞外脂含量的升高有关。但生物被膜胞外脂含量的升高是由于脂肪酸刺激细菌分泌而生成新的脂类,还是试验所添加的脂肪酸,还有待进一步研究。
综上所述,海假交替单胞菌生物被膜的形成过程中添加3种脂肪酸混合物,促进了生物被膜胞外脂的产生从而促进了厚壳贻贝幼虫的附着变态。在实际生产应用中,添加脂肪酸可以有效提高厚壳贻贝幼虫附着变态率,且此结果对于了解脂肪酸、细菌生物被膜及厚壳贻贝幼虫附着变态三者间的关系提供了新的思路,为脂肪酸未来在厚壳贻贝养殖产业中的应用提供科学参考。
4 结论
1)棕榈酸、硬脂酸和油酸3种混合脂肪酸抑制了海假交替单胞菌生物被膜的形成,当混合脂肪酸质量浓度为5 mg/L时,海假交替单胞菌生物被膜的细菌密度和膜厚达到最低值。
2)3种脂肪酸混合物质量浓度为5 mg/L时,导致了海假交替单胞菌生物被膜胞外脂含量显著升高,从而促进了厚壳贻贝幼虫的附着变态。

