1-磷酸鞘氨醇受体2(S1PR2)通过保护肠黏膜屏障功能缓解炎症性肠病的作用
薛海波 宋冰欣 丁莉 马丽丽 潘贻飞 陈坛辀
[关键词] 1-磷酸鞘氨醇;1-磷酸鞘氨醇受体2;肠黏膜屏障功能;炎症性肠病
[中图分类号] R331.3 [文献标识码] A [文章编号] 1673-9701(2021)15-0032-05
Effect of 1-phosphossphingosine receptor 2(S1PR2) on relieving inflammatory bowel disease by protecting intestinal mucosal barrier function
XUE Haibo1 SONG Bingxin1 DING Li1 MA Lili2 PAN Yifei3 CHEN Tanzhou1
1.Department of Gastroenterology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000,China; 2.Department of Rheumatology and Immunology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China; 3.Department of Colorectal and Anal Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China
[Abstract] Objective To investigate the effects of 1-phossphingosine receptor 2(S1PR2) on relieving inflammatory bowel disease (IBD) by protecting the intestinal mucosal barrier. Methods S1PR2 gene knockout mice were constructed. Dextran sulfate sodium salt (DSS) was used to induce colitis. Serum fluorescein isothiocyanate (FITC) concentration was measured for intestinal permeability of mice in vitro and in vivo. The levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and interferon-γ (IFN-γ) in cell suspensions were determined by enzyme-linked immunosorbent assay (ELISA). Results The survival rate and body weights of wild-type(WT) mice were higher than those of S1PR2-/- mice, and the differences were statistically significant(P<0.05). The concentrations of IFN-γ, IL-6 and TNF-α in colon cell suspension of mice in the DSS group were higher than those in the control group, and the differences were statistically significant(P<0.05). Conclusion S1PR2 alleviates inflammatory bowel disease by protecting intestinal mucosal barrier function.
[Key words] 1-phosphossphingosine; 1-phosphossphingosine receptor 2 (S1PR2); Intestinal mucosal barrier function; Inflammatory bowel disease
炎癥性肠病(Inflammatory bowel disease,IBD)是一种胃肠黏膜存在持续性炎症反应导致胃肠结构和功能紊乱的特发性肠道炎症性疾病,临床表现为腹泻、腹痛,甚至可有血便,主要包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)。炎症性肠病的病因和发病机制尚未完全明确,已知肠道黏膜免疫系统异常反应所导致的炎症反应在IBD发病中起重要作用,认为其是由多因素相互作用所致,主要包括遗传、免疫因素、环境和微生物[1]。其治疗手段有限,反复发作的特性和可能的恶变倾向给临床医师和患者带来很大困扰,急需研究其发病机制,为临床治疗提供依据。
肠黏膜屏障是机体抵御外环境侵袭的重要屏障。肠黏膜屏障主要由机械屏障、生物屏障、化学屏障及免疫屏障组成。其中机械屏障最为重要,机械屏障由肠上皮细胞及其连接构成,调控着水和溶质的跨上皮运输。肠上皮细胞间的连接方式有多种,包括紧密连接、粘附连接和缝隙连接及桥粒等[2]。肠上皮紧密连接的损伤参与了多种疾病的进展。因此,维持完整的肠上皮细胞紧密连接对保护肠屏障功能、防止细菌移位及毒性大分子进入人体有重要的意义。由细胞间连接变化引起的细胞通透性改变导致的肠黏膜屏障功能失调是IBD的发病机制中的一个关键因素。
1-磷酸鞘氨醇(Sphingosine-1,S1P)是一种在生理和病理条件下参与调解多种细胞功能的活性鞘脂。S1P可以直接作为细胞内信号分子或细胞外通过激活5个G蛋白偶联受体(G protein-coupled receptors,GPCRs)发挥作用[3]。过去二十年,对S1P及其受体在健康和疾病中的作用进行了大量的研究。研究已经表明S1P是多种类型的细胞增殖、迁移和存活的一个关键调节因子[4]。在不同的组织或器官中5种S1PRs的表达具有差异性[5]。在人肠道内,所有5种(Sphingosine-1-phosphate receptors,S1PRs)均能被检测到,但是S1PRs表达水平不一。前期已有文献报道,S1P通过激活S1PR1调节粘着连接蛋白E-cadherin的表达增强肠上皮细胞屏障功能[6]。同时也有文献报道,S1P通过Akt依赖途径防止肠上皮细胞凋亡[7]。这些研究表明,S1P及其受体能够促进肠上皮细胞增殖和增强上皮细胞屏障功能,对肠黏膜屏障起到保护作用。S1PR2在肠上皮细胞增殖和上皮细胞屏障中的作用未见报道,而笔者的前期研究发现,S1PR2在肠上皮细胞高表达,是S1P在肠上皮细胞的主要受体,因而S1PR2对肠黏膜屏障保护作用值得研究。
1 对象与方法
1.1 研究对象
采用C57BL/6小鼠,8~12周,体重中位数22.5 g,雌雄不限,生活环境控温控湿,具有12 h昼夜循环,并提供充足食水,每周换笼2次。S1PR2基因敲除小鼠[实验动物许可证:SYXK(浙)2018-0017]如前制备[8-9]。
1.2 方法
1.2.1 动物处理 繁殖并验证C57BL/6来源的S1PR2-/-小鼠品系。利用S1PR2-/-小鼠,并以野生型(Wild type,WT)鼠为对照。用含有2.5%的硫酸葡聚糖钠盐(Dextra sulfare sodium,DSS)的水喂养小鼠7 d,以诱导结肠炎。1周后更换正常不含DSS的水,继续喂养小鼠1周,并在第14天处死。本动物实验通过温州医科大学附属第一医院伦理委员会。
1.2.2 小鼠一般状况观察 以喂食DSS开始算起,取0、4、7和14 d小鼠结肠和血,每个时间点各取WT和KO 6只,解剖小鼠并检测结肠长度。每天称量小鼠体重和收取粪便,记录小鼠体重变化和生存情况。
1.2.3 小鼠肠通透性检测 使用异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的葡聚糖(FITC-葡聚糖,Sigma-Aldrich,St.Louis,MO,USA)测量活体小鼠肠通透性。采小鼠外周血与磷酸缓冲液(Phosphatic buffer solution,PBS)溶液1∶3体积稀释,测血清中FITC含量,进而绘制标准曲线。简单来说,先将小鼠禁食6 h,然后给予50 mg/mL的FITC-葡聚糖灌胃处理(0.6 mg/g体重)。1 h后,经尾静脉采血120 μL。然后按照前述方案给予小鼠DSS。14 d后,在实验结束或处死小鼠前同样给予50 mg/mL FITC-葡聚糖灌胃(0.6 mg/g体重),后经心脏采血120 μL。将收集到的血液离心,用PBS溶液1∶1体积稀释血浆。使用多功能酶标仪(BioTek,Winooski,VT,USA)在激发波长485 nm和发射波长535 nm下测FITC-葡聚糖浓度。
1.2.4 结肠组织学 10%福尔马林固定结肠切片组织,苏木精和伊红染色(H&E)。显微镜(Olympus IX70,Olympus,Shinjuku,Tokyo,Japan)下观察。
1.2.5 制备结肠组织细胞悬液 颈椎脱位法处死小鼠,取仰卧位,打开腹腔。切取结肠测量长度,清理肠道内容物,并用含1%胎牛血清(Foetal bovine serum,FBS)和不含钙镁离子的平衡盐溶液(Free of calcium and magnesium,CMF-HBSS)清洗肠道。将结肠切至2 mm大小,浸泡在含有3 mM[3]乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)的CMF-HBSS中,置于台式恒温振荡器振荡,37℃,180 rpm/min。振荡30 min后离心,用含1 mg/mL Ⅳ型胶原酶和DNA酶I的HBSS溶液消化沉淀1.5 h,300目网筛过滤去除杂质和未消化的组织块后,得到小鼠结肠组织的细胞悬浮液。
1.2.6 酶联免疫吸附试验(ELISA) 将上述得到的小鼠结肠细胞悬液离心,用PBS液洗2次,然后用含10%FBS的无血清细胞冻存培养基(Roswell park memorial institute,RPMI)1640重悬。细胞计数后,接种细胞至24孔板(每孔4×105细胞),培养24 h。ELISA试剂盒(R&D Systems,Minneapolis,MN,USA)测上清中肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-6(Interleukin-6,IL-6)、γ-干扰素(Interferon-γ,IFN-γ)浓度。
1.3 统计学处理
所有实验至少重复3次,结果以均数±标準差表示。使用GraphPad Prism5.0(GraphPad,San Diego,CA),采取单因素方差分析(One-way ANOVA)和邓肯检验(Duncan′s test)分析数据。P<0.05表示差异有统计学意义。
2 结果
2.1 S1PR2-/-小鼠易感DSS诱导的结肠炎
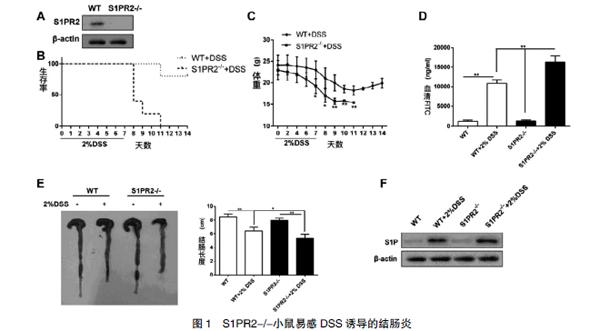
本研究构建了S1PR2基因敲除小鼠(S1PR2-/-),以正常小鼠作为对照,比较两者对DSS诱导的结肠炎的敏感性。给予小鼠2%DSS溶液共7 d以诱导结肠炎,最终在第14天处死小鼠。体重减轻30%可视为人道终点。图1A显示了小鼠结肠组织中S1PR2蛋白的表达,表明成功建立了S1PR2-/-小鼠。2%DSS处理7 d后,WT和S1PR2-/-小鼠的存活率分别为80%和40%,表明DSS处理后S1PR2-/-小鼠的存活率较低(图1B)。此外,WT小鼠的体重总是高于S1PR 2-/-小鼠,表明S1PR2-/-小鼠的体重下降比WT小鼠更显著(图1C)。
将小鼠分为4组(WT组,2%DSS+WT组,S1PR2-/-组,2%DSS+S1PR2-/-组)。如图1D,血清FITC浓度代表了小鼠肠道通透性,结果显示DSS+小鼠的血清FITC浓度高于对照组小鼠。此外,S1PR2-/-小鼠血清FITC浓度亦高于WT小鼠,表明S1PR2-/-小鼠体内存在更严重的肠黏膜损害。图1E表示,DSS处理后,小鼠结肠长度明显缩短,且S1PR2-/-小鼠的结肠缩短比WT小鼠更明显。接下来,检测四组结肠组织中S1P蛋白的表达,结果显示DSS处理的WT和S1PR2-/-小鼠中S1P蛋白表达明显增加(图1F)。
2.2 2%DSS+S1PR2-/-小鼠诱发更严重的肠炎
为研究其结肠组织病理学,用H&E染色小鼠结肠切片,并制备结肠组织细胞悬浮液。如封三图5A所示,对照组WT和S1PR2-/-小鼠结肠上皮完整,可见杯状细胞,未见炎性细胞浸润。DSS处理组的WT小鼠肠黏膜变得松弛,尽管黏膜层仍完整,但可见炎性细胞浸润。而DSS处理组的S1PR2-/-小鼠黏膜上皮可见大量炎细胞浸润,肠屏障结构有实质性破坏,杯状细胞消失。
制备的小鼠结肠细胞悬液用RPMI1640完全培养基培养24 h,ELISA法检测TNF-α,IL-6和IFN-γ,结果分别如封三图5B,封三图5C和封三图5D所示。DSS处理组小鼠结肠细胞悬液中IFN-γ、IL-6和TNF-α浓度较对照组水平升高,其中,2%DSS+S1PR2-/-组的细胞因子水平高于2%DSS+WT组。
3 讨论
炎症性肠病(IBD)是一组不明原因的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎和克罗恩病。IBD发病机制目前尚不明确,普遍认为与免疫异常、遗传易感性、肠道菌群失调以及感染、环境、心理等因素相关。近年研究表明,IBD患者均存在肠黏膜屏障受损,这可能会引起细胞因子分泌异常、肠黏膜萎缩、通透性改变及肠道菌群移位,导致炎症的反复发作及加重。目前,临床上治疗IBD以免疫抑制剂或激素治疗为主,然而这些药物使用规范较为严格,不规范的用法极易产生不良反应及耐药;对于严重的IBD患者,虽可采取外科治疗手段,但也有出现吻合口难以愈合,需要反复手术,并有短肠综合征、超短肠综合征手术并发症。
近年来研究表明通过黏膜修复或可以诱导IBD患者持续的临床缓解,减少住院和手术次数,改善患者的生存质量[10]。肠黏膜屏障是由机械屏障、化学屏障、免疫屏障和生物屏障4个部分构成,其中任何一个屏障的损伤均会导致肠黏膜屏障被破坏,致使其功能受损,诱发肠源性感染[11-12]。肠上皮屏障完整性的破坏与多种病理状态有关。过去20年,对S1P及其受体在健康和疾病中的作用进行了大量的研究,表明S1P是多种类型的细胞增殖、迁移和存活的一个关键调节因子。S1P是一种高度活跃的脂质信号分子,具有广泛的生物活性,包括调节细胞骨架重排、血管生成和血管成熟、细胞增殖和存活、钙稳态、免疫细胞迁移以及内皮和上皮屏障功能[13-14]。S1P的组织分布分析表明,其在肠道中的含量非常高[15]。有报道指出,S1P能够抑制肠上皮细胞凋亡,调节粘连蛋白E-cad的表达,还可以提高肠上皮细胞屏障功能[16-17]。
小鼠急性DSS诱导结肠炎是一种在人体病理生理学领域常用的肠黏膜屏障损害模型。本实验中,小鼠结肠组织中S1PR2蛋白低表达,表明成功构建S1PR2-/-基因敲除小鼠。DSS处理后,S1PR2-/-小鼠的存活率明显低于WT小鼠,体重下降比WT小鼠更显著,结肠缩短比WT小鼠更显著。S1PR2-/-小鼠血清FITC浓度亦高于WT小鼠,说明S1PR2-/-小鼠比WT小鼠对DSS诱导的结肠炎更易感。结肠组织切片H&E染色显示,对照组WT和S1PR2-/-小鼠结肠上皮完整,可见杯状细胞,未见炎性细胞浸润。DSS处理组的S1PR2-/-小鼠黏膜上皮可见大量炎细胞浸润,肠屏障结构有实质性破坏。本文研究小鼠结肠组织来源的炎症因子IFN-γ、IL-6和TNF-α,结果表明DSS处理组小鼠结肠细胞悬液中IFN-γ、IL-6和TNF-α浓度较对照组水平升高。这些数据表明,DSS在S1PR2-/-小鼠体内诱发了更严重的肠炎。大量研究表明DSS诱导的急性结肠炎与大量炎症因子有关,如IFN-γ、IL-6和TNF-α[18],这与本研究结果一致。有研究指出,S1P诱导的DRA表达上调是由S1PR2介导的,DRA是参与哺乳动物肠道吸收电中性盐的主要Cl-/HCO3-交换器[19]。最近的几项研究进一步表明,激活S1PR2可以减少活性氧的形成,抑制细胞死亡,负调控巨噬细胞活化[20]。这些研究结果说明S1PR2还能保护肠黏膜化学屏障的完整性,进一步提高肠道屏障功能。
笔者目前的研究表明,S1P介导的S1PR2激活在维持肠道屏障功能方面起着关键作用。S1P/S1PR介导的信号通路是否参与了与屏障功能障碍相关的胃肠道疾病的发病机制尚不清楚。了解这些信号通路将为发掘肠黏膜发育不全、短肠综合征等胃肠道疾病的新治疗方法提供重要信息。许多研究主要受限于定义不同、研究设计不同等,导致对肠黏膜修复的定义尚不十分明确,不同药物的效应规模也无法准确估计。这均有待于制定一個标准的黏膜修复定义和进一步的研究。
综上所述,肠道屏障功能是维持肠道稳态的关键。本次研究表明,S1PR2通过保护肠黏膜屏障功能缓解炎症性肠病。笔者希望本次研究结果能为今后研究改善肠黏膜屏障功能、减轻炎症反应、促进肠黏膜屏障修复提供新的方向和思路。
[参考文献]
[1] Ananthakrishnan,AN.Epidemiology and risk factors for IBD[J].Nat Rev Gastroenterol Hepatol,2015,12(4):205-217.
[2] Salim SY,Soderholm JD.Importance of disrupted intestinal barrier in inflammatory bowel diseases[J].Inflamm Bowel Dis,2011,17(1):362-381.
[3] Strub GM.Extracellular and intracellular actions of sphingosine-1-phosphate[J].Adv Exp Med Biol,2010,688:141-155.
[4] Aarthi JJ,Darendeliler MA,Pushparaj PN.Dissecting the role of the S1P/S1PR axis in health and disease[J].J Dent Res,2011,90(7):841-854.
[5] Hla T,Brinkmann V.Sphingosine 1-phosphate (S1P):Physiology and the effects of S1P receptor modulation[J].Neurology,2011,76(8 Suppl 3):S3-8.
[6] Greenspon J.Sphingosine-1-phosphate regulates the expression of adherens junction protein E-cadherin and enhances intestinal epithelial cell barrier function[J].Dig Dis Sci,2011,56(5):1342-1353.
[7] Greenspon J.Sphingosine-1-phosphate protects intestinal epithelial cells from apoptosis through the Akt signaling pathway[J].Dig Dis Sci,2009,54(3):499-510.
[8] Ishii I,Ye X,Friedman B,Kawamura S,et al.Marked perinatal lethality and cellular signaling deficits in mice null for the two sphingosine 1-phosphate(s1p) receptors,s1p2/lpb2/edg-5 and s1p3/lpb3/edg-3[J].J Biol Chem,2002,277(28):251-259.
[9] Ishii I,Friedman B,Ye X,et al.Selective loss of sphingosine 1-phosphate signaling with no obvious phenotypic abnormality in mice lacking its g protein-coupled receptor,lp(b3)/edg-3[J].J Biol Chem,2001,276(36):697-704.
[10] Takizawa Y,Kishimoto H,Tomita M,et al.Changes in the expression levels of tight junction components during reconstruction of tight junction from mucosal lesion by intestinal ischemia/reperfu-sion[J].Eur J Drug Metab Pharmacokinet,2014,39(3):211-220.
[11] Di Sabatino A,Ciccocioppo R,Luinetti O,et al.Increased en-terocyte apoptosis in inflamed areas of Crohn′s disease[J].Dis Colon Rectum,2003,46(11):1498-1507.
[12] Hagiwara C,Tanaka M,Kudo H.Increase in colorectal epithelial apoptotic cells in patients with ulcerative colitis ultimately requiring surgery[J].J Gastroenterol Hepatol,2002,17(7):758-764.
[13] Maceyka M,Harikumar KB,Milstien S,et al.Sphingosine-1-phosphate signaling and its role in disease[J].Trends Cell Biol,2012,22(1):50-60.
[14] Nagahashi M,Hait NC,Maceyka M,et al.Sphingosine-1-phosphate in chronic intestinal inflammation and cancer[J].Adv Biol Regul,2014,54:112-120.
[15] Yatomi Y,Welch RJ,Igarashi Y.Distribution of sphingosine 1-phosphate,a bioactive sphingolipid,in rat tissues[J].FEBS Lett,1997,404(2-3):173-174.
[16] Greenspon J,Li R,Xiao L,et al.Sphingosine-1-phosphate regulates the expression of adherens junction protein E-cadherin and enhances intestinal epithelial cell barrier function[J].Dig Dis Sci,2011,56(5):1342-1353.
[17] Greenspon J,Li R,Xiao L,et al.Sphingosine-1-phosphate protectsintestinal epithelial cells from apoptosis through the Akt signaling pathway[J].Dig Dis Sci,2009,54(3):499-510.
[18] Xiao YT,Yan WH,Cao Y,et al.Neutralization of IL-6 and TNT-α ameliorates intestinal permeability in dss-induced colitis[J].Cytokine,2016,83:189-192.
[19] Anbazhagan AN,Priyamvada S,Alakkam,A,et al.Transcriptional Modulation of SLC26A3(DRA) by Sphingosine-1-Phosphate[J].Am J Physiol Gastrointest Liver Physiol,2016,310(11):G1028-1035.
[20] Herr DR,Reolo MJ,Peh YX,et al.Sphingosine 1-phosphate receptor 2(S1P2) attenuates reactive oxygen species formation and inhibits cell death:Implications for otoprotective therapy[J].Sci Rep,2016,6:24 541.
(收稿日期:2021-01-12)

