哺乳动物类白蛋白家族的结构、功能与演化
苑剑锐, 风 英, 张晓慧, 汲广东
哺乳动物类白蛋白家族的结构、功能与演化
苑剑锐, 风 英, 张晓慧, 汲广东
(中国海洋大学海洋生命学院海洋生物多样性与进化研究所, 山东 青岛 266003)
哺乳动物类白蛋白家族成员包括白蛋白(albumin, ALB)、维生素 D 结合蛋白(vitamin D binding protein, DBP)、甲胎蛋白(alpha-fetoprotein, AFP)和alpha-白蛋白(afamin, AFM)以及甲胎蛋白相关蛋白(alpha-fetoprotein related protein, ARG), 以含有白蛋白结构域为主要特征。前4种蛋白都存在于血清中, 参与脂肪酸或激素等的转运, 后一种可能存在于细胞中。文中就类白蛋白家族的主要结构特点、相关功能及进化图式等进行阐述, 为后续探索该家族成员的演化和应用提供了参考。
白蛋白; 结构; 生理功能; 进化
白蛋白(albumin, ALB)一词来源于德语里面对蛋白的称呼albumen, 其起源于拉丁语albus(白色), 这个颜色是禽蛋被煮熟时围绕蛋黄的蛋清所显示的白色。现在, albumen一词仍然用于卵清蛋白以及尿液中的蛋白等, 而albumin是指血浆中的特定蛋白或具有相似性质的蛋白。
白蛋白的研究历史非常悠久, 远在约公元前400年, 希波克拉底就指出, 慢性肾病可以通过泡沫尿的存在来判断, 产生这一现象的原因是白蛋白的存在。16世纪一名瑞士医生Paracelsus用醋在尿液中沉淀出白蛋白, 而在18世纪戴克(Frederick Dekkers)通过煮沸的方法也在尿液中沉淀出白蛋白, 直到1894年白蛋白被A. Gürber结晶出来, 人们认识到白蛋白是一种单一的可再生物质, 随后在1926年科学家通过超速离心法确定了其分子量为70 000 Da。之后, 关于这个蛋白的研究不断推向前进, 从蛋白片段的测序, 对蛋白结构的认识, 到20世纪80年代左右人类白蛋白基因的分离, 90年代其晶体蛋白结构确立, 是一个波澜壮阔的研究和认识过程[1]。
在这一过程中, 人们还发现了其他的与白蛋白相似的维生素D结合蛋白(vitamin D-binding protein, DBP)[2], 甲胎蛋白(alpha-fetoprotein, AFP)[3], alpha-白蛋白(alpha-albumin, afamin, AFP)[4-6]。在2010年, 有研究者通过生物信息学方法从某些哺乳动物中获得了甲胎蛋白相关蛋白(alpha-fetoprotein related gene, ARG)基因, 但并非在所有哺乳动物种中存在[7]。至此, 已有上述5种类白蛋白家族成员被发现, 本文主要论述类白蛋白家族的蛋白结构、执行的生理功能以及可能的分子演化图式。
1 类白蛋白家族的蛋白结构
以小鼠(Mus musculus)为例, 其类白蛋白家族的5个成员在结构上有明显的相似性, 除了DBP含有2个串联重复的白蛋白结构域(albumin domain)以及一个维生素D结合域, 其他都含有3个串联重复的白蛋白结构域, 如图1所示。在蛋白一级结构上, 我们发现, 除了ARG外, 其他4个序列都在氨基端含有信号肽, 说明DBP, ALB, AFP以及AFM都是分泌蛋白, 而ARG很有可能在细胞内表达。尽管蛋白质序列比对发现这5个旁系同源蛋白同源性不高(17.5%~37.6%), 然而当其基因结构上的内含子时相映射到对应的蛋白序列上, 发现在albumin 结构域上存在保守的2-0-2模式, 而且结构域之间都是保守的0模式, 除了说明对应基因结构的保守性, 也暗示了其蛋白高级结构的保守性。在蛋白三维结构上, 上述结构域内部被一系列二硫键连接, 形成了C-(X)18-44-CC-(X)5-9-C-(X)12-14-CC-(X)9-C-(X)20-26-C- (X)39-43-CC-(Xs)7-C等模式, 每个结构域都含有大量α-螺旋, 除 DBP 在第 3 个结构域被截断以外, 其余成员的三维结构分析显示呈一个球状的心形蛋白。这一系列保守的二硫键使得类白蛋白家族成员形成非常稳定的结构。有报道表明在生理条件下, 当白蛋白在结合配体使分子形状发生改变时, 众多的二硫键会帮助分子恢复到原来的形状[8]。
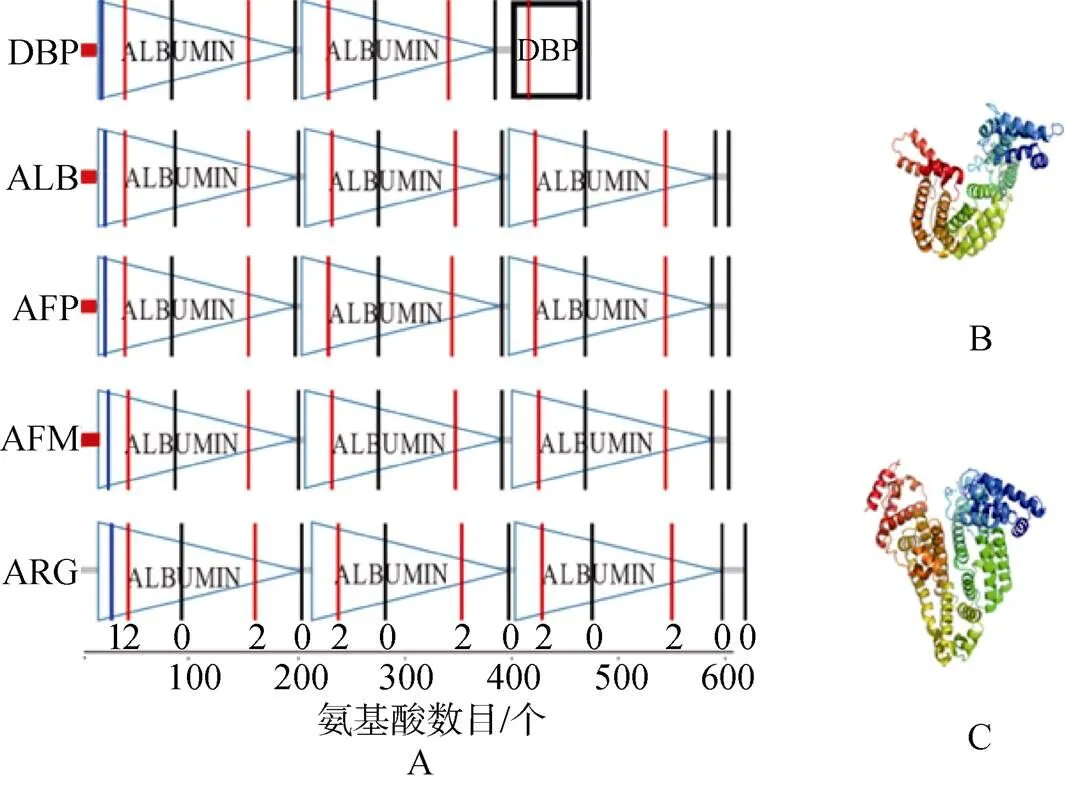
图1 类白蛋白家族成员结构域组成及三维结构
A. 类白蛋白家族成员结构域组成, 由SMART在线分析网站(http: //smart.embl-heidelberg.de/)预测; B. 人DBP(1J78)的三维结构; C. 人ALB(1AO6)的三维结构
A. The domain composition of albumin multigene family, predicted by the SMART online analysis website (http://smart.embl-heidelberg. de/); B. The three-dimensional structure of human DBP (1J78); C. The three-dimensional structure of human ALB (1AO6)
2 类蛋白家族的表达和调控
类白蛋白家族成员主要在肝脏中表达, 除此以外, 在其他组织(如AFP和AFM在肾脏, DBP在胆囊等)也有不同程度的表达, 受到不同程度的调节。ALB和AFP在胎儿肝脏发育早期开始表达, 出生后ALB在成人肝脏中继续高水平表达, AFP的转录却迅速被抑制到几乎检测不到的水平, 但在肝脏再生期和肝癌发生时可以被重新激活。AFM基因围产期被激活, DBP的表达在妊娠中期, 二者在胎儿出生后中继续高水平表达。小鼠中, ARG在胎肝中的表达水平较低, 表达时期与AFM类似[7]。
ALB、AFP、AFM和ARG这4种基因串联排布, 转录方向相同, DBP位于ALB的5’端上游, 与其他4种基因转录方向相反, 它们位于同一条染色体上[7, 9], 如图2所示。类白蛋白家族之间在染色体上紧密联系以及它们主要在肝脏中的表达模式表明它们可能存在共同的调节因子。在启动子调节方面, ALB、AFP、AFM和DBP启动子附近均含有肝细胞核因子1 (HNF1)结合位点, HNF1α和HNF1β能够特异性结合这些结合位点, 激活启动子活性, 而ARG附近没有HNF1结合位点, 这解释了ARG表达量如此低的原因[1, 8]。在增强子调控方面, ALB增强子在胎肝中表达活性较低, ALB的表达需要AFP增强子进行调控, 在妊娠后期ALB增强子被激活, 胎儿出生后AFP增强子影响逐渐被消除, 而 AFP增强子是其在卵黄囊、胎肝和发生肝病时表达所必需的[10]。在肝癌发生时, AFP表达上升的同时AFM表达量下调, 表明AFP和AFM启动子可能对AFP增强子有竞争性作用, 但仍需进一步的研究[11]。
3 类白蛋白家族的生物学功能
3.1 白蛋白(ALB)
ALB又称清蛋白, 是哺乳动物血浆中主要的蛋白质成分, 由肝脏实质细胞合成, 占了血浆总蛋白的55%~60%。ALB在生物体中发挥着重要的功能, 目前已知具有维持胶体渗透压、结合和转运配体(如脂肪酸和荷尔蒙等)、参与内源性或外源性物质代谢、抗氧化和自由基清除、抗凋亡作用、抗凝血和抗血栓作用等一系列的生理生化功能[12], 对一些底物具有酯酶和烯醇酶活性[13]。
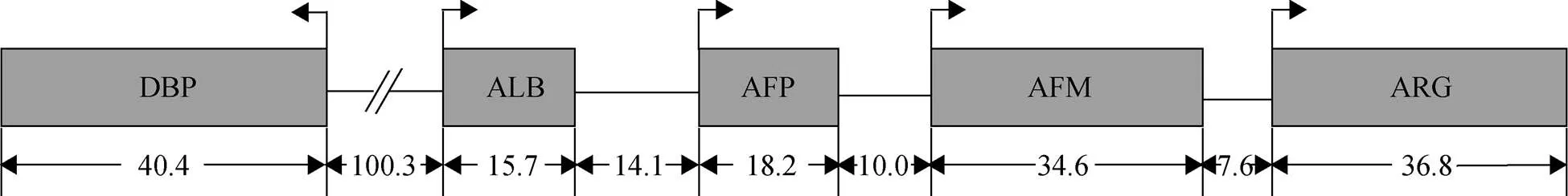
图2 小鼠类蛋白家族基因在5号染色体上的排列
数字代表基因以及基因间的间隔大小(kb), 箭头代表转录方向, 改自文献[7]
Numbers below indicate the size of the genes and intergenic regions(in kb). The arrows represent the direction of transcription, adapted from the literature[7]
人体内ALB浓度是最常被检测的健康指标之一, 在营养不良、肝脏合成受损、大面积烧伤或皮肤病造成的损失增加、组织分解代谢增加等情况下会引起血清ALB浓度降低, 如在新冠肺炎患者经常观察到ALB水平降低[14-15]产生低蛋白血症, 已经成为检测病症严重程度的一个非特异性指标, 低浓度的ALB预示患者的低康复率[16], 可以通过直接补充ALB进行治疗[12]。
由于ALB具有多种配体(脂肪酸、甲状腺素、细菌蛋白以及金属离子等)结合位点[17], 可以与一系列内源性和外源性分子结合, 使得ALB成为人体内新药设计中不可忽视的重要载体/转运蛋白。通过ALB与药物的结合使药物浓度超过其天然血浆溶解度, 降低其毒性, 降低清除率和增加循环半衰期, 已广泛应用到二型糖尿病、血友病和胃癌等疾病的治疗中去[18]。已有多种基于ALB的药物递送系统被开发出来, 根据药物附着方法可分为通过非共价/共价结合ALB产生的对蛋白质具有增强亲和力的药物衍生物, 与多肽类药物形成融合蛋白以及通过ALB与纳米粒子结合进行靶向治疗等, 以利用其药物转运特性[19], 如金纳米粒子与ALB结合用作姜黄素的药物载体, 使复合物具有更高的稳定性, 增加释放量和提高抗菌活性[20]。因此, ALB作为一种丰富、安全、非免疫原性和稳定的蛋白质, 具有超长的循环半衰期, 是未来药物载体研究的有效候选。
3.2 甲胎蛋白(AFP)
AFP于1956年在胎儿血清中发现, 其在胎儿早期发育的肝脏和卵黄囊中表达, 是胎儿血浆中的主要蛋白质, 其在胎儿出生后其表达水平迅速降低。后来的研究表明AFP在胎儿体内的部分功能与成人体内的ALB类似, 亦具有维持胎儿早期血浆渗透压的作用, 并作为运输载体能与脂肪酸、类固醇、重金属离子和各种药物结合, 在出生后其功能逐渐被白蛋白所取代。
高浓度的AFP还在肝癌患者体内被发现, 认为AFP是重要的肿瘤标志物, 对早期肝癌的诊断及治疗评估都具有非常重要的作用[21]。这促使人们把AFP与细胞的生长联系起来。现在认为, AFP可能通过多种机制调节正常细胞和肿瘤细胞的生长。已发现, AFP具有免疫抑制作用。在胎儿中高浓度的AFP不仅具有载体运输功能, 还可以保护胎儿免受母体的免疫攻击。在肝癌发生时, AFP与巨噬细胞相互作用, 降低其吞噬活性和表面Ia抗原的表达, 抑制自然杀伤细胞的活性, 减少T淋巴细胞的增殖, 促进T抑制细胞的活性。通过与AFP受体结合、PI3K/AKT信号通路激活、癌基因蛋白刺激及PTEN抑癌基因蛋白功能紊乱等起到对肿瘤细胞增殖的促进作用, AFP 既可以促进肝癌细胞增生, 又抑制了患者对肿瘤产生的免疫应答。AFP还保护癌细胞起到抗凋亡作用, 抑制caspase3介导的凋亡信号转导[22-24]。迄今, AFP已成为肝癌治疗的新靶点, 通过免疫治疗阻断AFP可抑制肝癌细胞增殖, 诱导癌细胞凋亡, 有望为肝癌治疗带来广阔的前景。
3.3 alpha-白蛋白(AFM)
AFM于1994年被确定为类白蛋白家族成员[6], 在此之前一直与类白蛋白家族的其他成员划分开来, 由于蛋白序列中没有色氨酸, 因此被描述为一种色氨酸缺乏的α球蛋白[5]。AFM只在哺乳动物中发现, 主要在肝脏合成, 不仅存在于血液中, 还存在于其他组织和体液中, 包括卵巢卵泡、精液以及脑脊液中, 很可能与繁殖和神经保护有关。研究表明AFP有维生素E结合功能, 对α-生育酚和γ-生育酚有极高的亲和力, 也被称作维生素E结合蛋白。在人血浆中, 维生素E通过脂蛋白转运系统进行非特异性转运。而在脂蛋白缺乏时, alpha-白蛋白负责结合维生素E参与转运[25-26]。此外, 血清中AFM与Wnt蛋白能紧密结合, 形成具有生物活性的复合物, 有助于各种Wnt配体运输及其信号转导[27]。
病理状态下, 血浆中AFM的浓度升高被认为与多种代谢综合征, 如肝癌、卵巢癌、妊娠并发症、多囊卵巢综合征、肥胖、II型糖尿病、高血压和血脂异常等有关[28]。
3.4 甲胎蛋白相关蛋白(ARG)
ARG是2010年在小鼠、大鼠()、狗()和马()的基因组中发现的, 由于其同源性与AFP更相近而得名。在灵长类()里面, 这一基因变成了没有功能的假基因。初步的研究表明, ARG表达模式类似于AFM, 亦在小鼠的胎肝, 肾脏等组织中表达, 且其表达量很低[7]。我们发现, 这个基因编码的蛋白不像家族其他成员一样含有信号肽, 因此它可能并不能分布在血浆中, 而是表达于细胞内, 具体功能还有待于进一步研究。
3.5 维生素D结合蛋白(DBP)
维生素D结合蛋白最早由HIRSCHFELD[2]在1959年发现, 基于其免疫学活性被命名为Gc(group- specific component)蛋白, 同时期, THOMAS[29]等发现一种血清蛋白被鉴定为具有运输维生素D及其代谢产物的功能, 被称为维生素D结合蛋白(DBP), 但直到1975年才发现Gc/DBP是相同的蛋白质[30]。DBP主要由肝脏细胞合成和分泌, 在肾脏、睾丸、胆囊、胰腺细胞和脂肪细胞中也有少量表达。
由于DBP对维生素D有极高的亲和力, 对维生素D及其代谢产物的结合和运输是DBP的主要功能。人体中维生素D的主要来源是皮肤在阳光下照射后产生的, 皮肤中的维生素D需要DBP来完成运输, 进入到血浆或其他组织中执行生理功能[31]。
然而, 在血浆中结合维生素D的DBP只占其中的一小部分, DBP还参与很多其他的生理功能: DBP能与肌动蛋白单体结合, 形成DPB肌动蛋白复合物, 避免组织损伤后血清中肌动蛋白聚合; 结合脂肪酸特别是不饱和脂肪酸; 转运内毒素; DBP结合 T细胞参与免疫反应; DBP可通过翻译后修饰和巨噬细胞活化因子形成DBP-MAF复合体, 影响骨代谢; DBP与白细胞结合参与补体C5系统活化等[32-33]。
DBP是一个具有高度多态性的血清蛋白, 除了3种主要的等位基因型(DBP1F、DBP1S和DBP2)外, 已经报导有超过120个独特的变异, 主要等位基因型的差异与种族地理位置的不同分布有关。DBP的多态性还与许多慢性疾病(如骨质疏松症、I型和II型糖尿病、甲状腺自身免疫性疾病、炎症性肠病和慢性阻塞性肺病等)的易感性或抵抗力有关。DBP的多态性还与新冠肺炎患者对COVID-19的抵抗性有关, DBP1等位基因频率高会降低COVID-19感染导致的患病率和死亡率, 猜测可能与DBP 1表型患者含有更高浓度的维生素D代谢物有关, 维生素D可能在抵抗COVID‐19感染过程中起作用[34]。DBP在肝病、肾病综合征、营养不良、严重急性创伤或疾病患者血清浓度降低[33, 35], 可用于临床检测; DBP还被发现是淋巴管肌瘤病病情严重程度的一种新的生物标志物[36]。然而, DBP在这些疾病中的确切作用尚未完全明了。
上述类蛋白家族成员功能总结见表1。
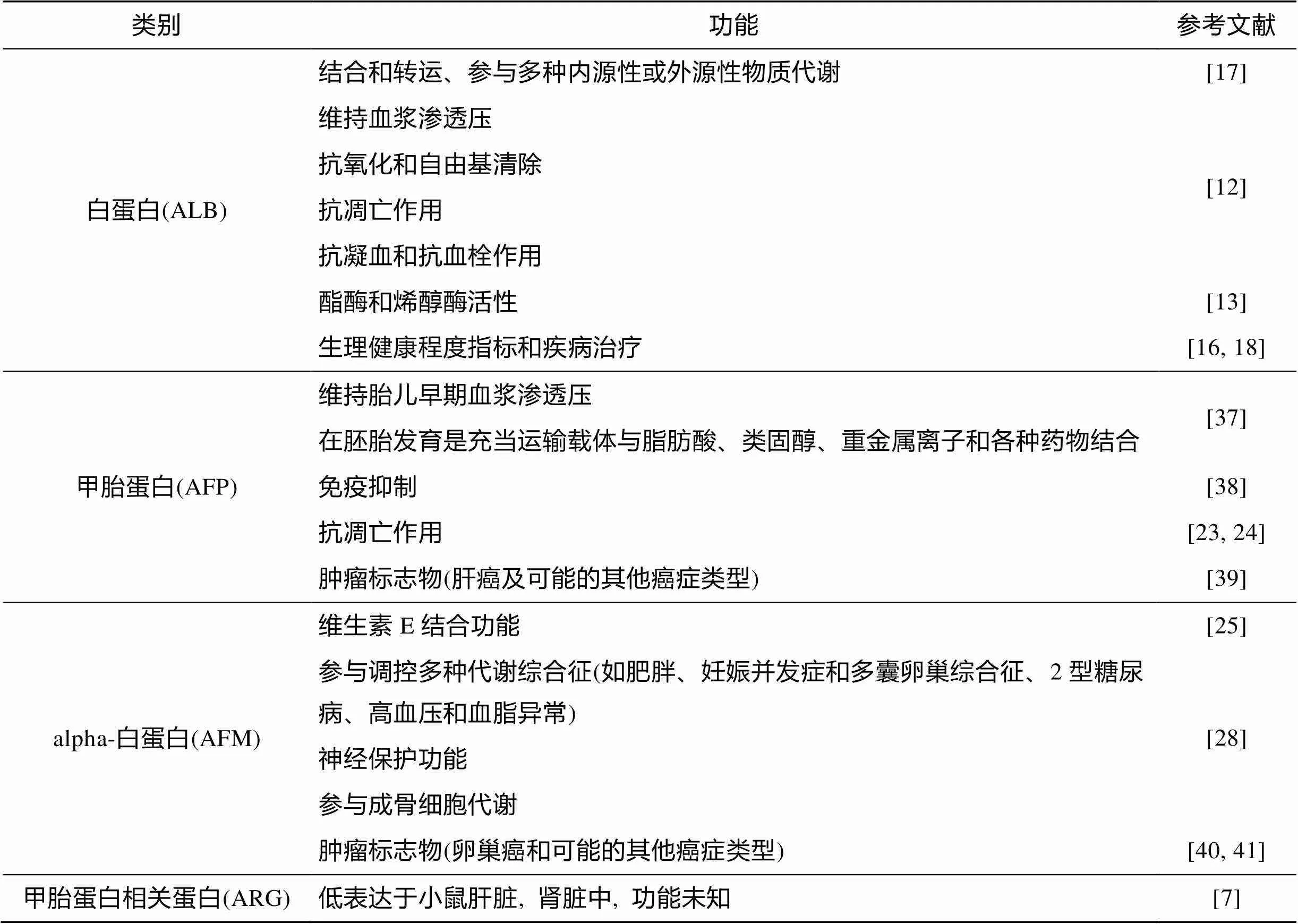
表1 类蛋白家族成员的功能简介

续表
4 类白蛋白家族进化分析
从20世纪70年代末到80年代, 人们根据部分哺乳动物的类蛋白家族成员序列信息的比对和进化分析结果, 提出了类白蛋白家族进化的假设, 认为它们是从同一个祖先基因进化而来的。类白蛋白家族祖先基因最初编码190个左右的氨基酸, 在漫长的进化过程中经过基因重组形成目前3个结构域的基因[42]。在距今约7亿年前分化为两个基因, 其一编码DBP, 另一个是ALB和 AFP的祖先基因, 它经过约3亿~5亿年的进化而又进一步分化为两个基因, 分别编码ALB和 AFP, AFP之后分化形成了AFM。
自从这个假说提出以后, 人们试图在现存的物种中寻找假说中所述的不同时期祖先基因存在的分子证据。自2010年来基因组测序技术的广泛应用, 许多物种的基因组和转录组已被测序, 为解析基因和基因组的进化提供了丰富的数据基础[43], 也为解答类蛋白家族的进化提供了契机。生信分析发现, 在灵长类出现之前, ARG出现在部分哺乳动物基因组中, 紧靠AFP基因的3′端, 而灵长类中, ARG发生了假基因化从而失去功能, 具体是由哪个基因复制分化而来尚不明确[7, 44]。我们用蛋白同源性搜索(Blastp)发现, 鸟类中存在3种类白蛋白(DBP, ALB和AFP); 爬行类中有的出现了DBP, ALB和AFP, 而有的只出现ALB和AFP, 其中ALB会出现2~3次的复制; 两栖类中有两种类白蛋白(DBP, ALB)出现; 在硬骨鱼类中, 许多物种中出现部分类白蛋白缺失, 甚至完全丢失的情况, 像斑马鱼()中只存在DBP, 鳟鱼()中存在ALB2和ALB2 like蛋白, 而在鳞头犬牙南极鱼()、鳗鱼()中未分离出具有白蛋白特征的蛋白质[45-47], 推测鱼体内的高密度脂蛋白可以代替白蛋白结合脂肪酸来降低血液黏度, 这种替代可能与环境引起的进化选择有关。
比硬骨鱼()更低等的鲨鱼()胎儿体内发现一种类似于AFP的蛋白质, 具有与哺乳动物中AFP非常相似的特征, 在胎儿发育的早期表达, 且在胎儿分娩后迅速消失, 合成部位与分子量与哺乳动物相似, 这些都说明鲨鱼胎儿甲胎蛋白是哺乳类和鸟类甲胎蛋白的同源物[48]。作者通过蛋白同源性搜索也发现了新近测序的点纹斑竹鲨()和白点竹鲨()基因组都存在AFP的同源片段, 尤其是后者基因组已经达到了染色体水平的组装[49], 类蛋白家族的成员中只有AFP基因在白点竹鲨基因组中找到同源片段, 说明鲨鱼体内可能只存在AFP。AFP的这种表达规律可能与鲨鱼卵胎生等的生殖方式有关, 胎儿在母体中需要AFP来维持血浆渗透压和运输营养物质, 作为生长调节因子确保生物体完成孕期。
在无颌类七鳃鳗()中也发现了类白蛋白家族成员的存在。与高等脊椎动物的血清白蛋白不同, 七鳃鳗的类白蛋白含有7个白蛋白结构域[50-52], 虽然与人们预想的无颌类中可能出现单一或者两个白蛋白结构域不同, 但仍没能否认前面的假说, 只是在无颌类中出现了物种特异的基因复制现象, 表明在更低等的无脊椎动物如文昌鱼()中, 比较原始的白蛋白不排除以多结构域的形式存在, 上述进化图式总结如图3所示。由于类白蛋白成员之间序列保守性比较低, 但半胱氨酸残基比较保守, 提示可以通过其排列模式在低等物种中进行序列搜索, 从而为类蛋白家族的进化提供新的例证。
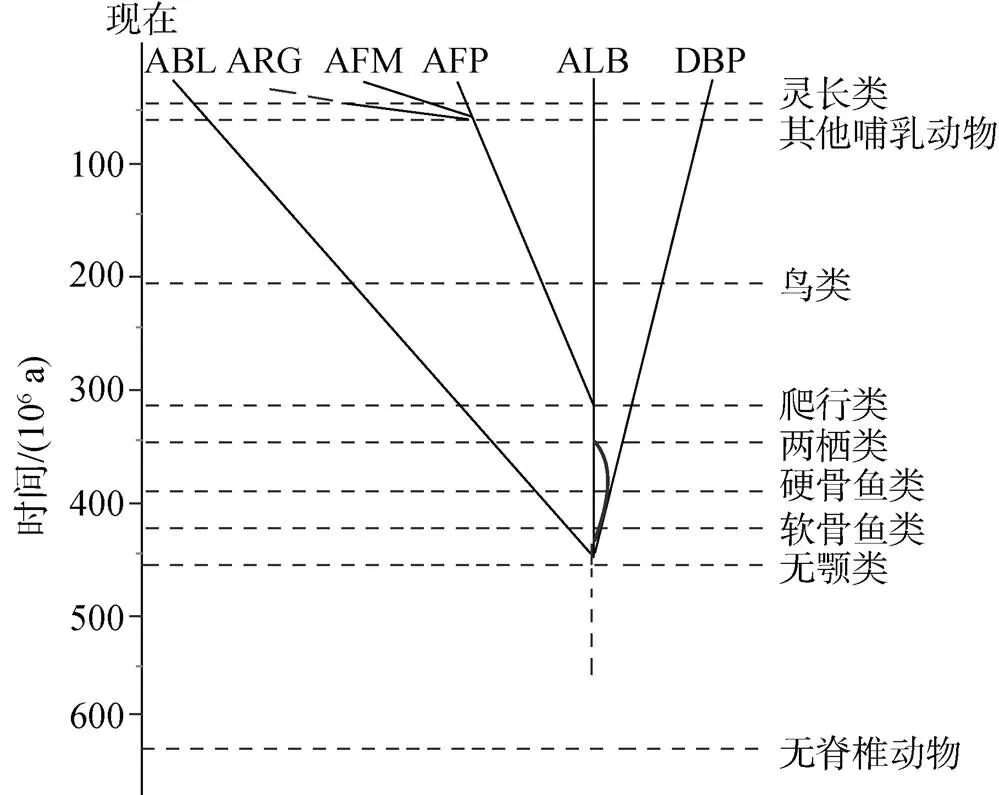
图3 类白蛋白家族进化树
ABL. 七鳃鳗白蛋白; ARG. 甲胎蛋白相关蛋白; AFM. alpha白蛋白; AFP. 甲胎蛋白; ALB. 白蛋白; DBP. 维生素D结合蛋白。弧线代表分歧时间不确定, 脊椎动物的分化时间选自http://timetree.org/,进化树改自文献[52]
ABL. Lamprey albumin; ARG. alpha fetoprotein; AFM. alpha albumin, AFP. alpha fetoprotein; Alb. albumin; DBP. vitamin D binding protein. The arcs represent the uncertain time of divergence. The time of vertebrate radiations were selected from http://timetree. org/. The phylogenetic tree was modified from the literature[52]
5 展望
类白蛋白家族的研究历史非常悠久, 基本上伴随了人们从蛋白到基因的认识过程, 尤其从20世纪50年代起, 新的类白蛋白家族成员被不断发现, 对这一基因家族的认识越来越深入。例如, 先天性ALB缺陷的人和大鼠是存活的[53-54], 小鼠被靶向AFP敲除后能存活但雌性不育[55], 但还没有见到对这一基因家族其他成员如AFM、DBP以及这一家族基因联合敲除的研究。另外, 由于这一家族基因(AFP、AFM、DBP)都和肿瘤等疾病相关, 因此利用模式动物进行转基因相关研究也很有必要。
在功能应用研究方面, 以ALB较为成熟。由于ALB是哺乳动物血浆的主要蛋白成分, 半衰期长达19 d左右, 含有多种配体结合位点, 可与许多体内外分子结合并延长这些分子在体内的半衰期, 是体内重要的转运载体候选。利用这些特点, 已经开发出了许多与ALB结合的药物递送平台并在临床取得了比较好的效果。最近发现, 人ALB能与Fc受体以pH依赖的方式结合, 以此人们可以研发通过调控pH值来影响与ALB结合的药物或者蛋白的半衰期的策略, 达到药物高效利用的目的。另外, 利用人ALB 结构域进行血液排毒, 以及血红蛋白-ALB作为红细胞替代等都在不断研究中[56]。因此, 结合基因工程技术以及分子和结构生物学知识, 充分开发ALB作为一种天然生物材料的潜能, 具有十分诱人的应用前景。
在进化上, 尽管前人提出了类蛋白家族进化的假说, 但是这一家族的进化历程并没有人们预期的那么简单。例如, 哺乳动物中ARG假基因化的原因是什么, 鱼类中是否广泛存在类蛋白家族基因的丢失?七鳃鳗中是否还存在其他的含有多个白蛋白结构域的蛋白, 其他低等无脊椎动物(文昌鱼)、海鞘()、海胆()等基因组已测序的物种)是否存在类白蛋白结构域的蛋白等都是进化上值得探索的问题。
[1] PETERS T J. All about albumin: biochemistry, genetics, and medical applications[M]. San Diego, Calif: Academic Press, 1996.
[2] HIRSCHFELD J, BECKMAN L. A new group-specific serum system (Gc-groups) in relation to blood and serum groups[J]. Acta genetica et Statistica Medica, 1960, 10: 48-53.
[3] BERGSTRAND C G, CZAR B. Demonstration of a new protein fraction in serum from the human fetus[J]. Scandinavian Journal of Clinical and Laboratory Investigation, 1956, 8(2): 174.
[4] BELANGER L, ROY S, ALLARD D. New albumin gene 3' adjacent to the alpha(1)-fetoprotein locus[J]. Journal of Biological Chemistry, 1994, 269(8): 5481-5484.
[5] HAUPT H, HEIDE K. Isolation of several tryptophan- poor alpha 1-glycoproteins occurring in traces from human serum[J]. Clinica Chimica Acta, 1964, 10: 555-558.
[6] LICHENSTEIN H S, LYONS D E, WURFEL M M, et al. Afamin is a new member of the albumin, alpha-fetoprotein, and vitamin D-binding protein gene family[J]. The Journal of Biological Chemistry, 1994, 269(27): 18149-18154.
[7] NAIDU S, PETERSON M L, SPEAR B T. Alpha-fetoprotein related gene (ARG): a new member of the albumin gene family that is no longer functional in primates[J]. Gene, 2010, 449(1-2): 95-102.
[8] DOCKAL M, CARTER D C, RUKER F. Conformational transitions of the three recombinant domains of human serum albumin depending on pH[J]. The Journal of Biological Chemistry, 2000, 275(5): 3042-3050.
[9] SONG Y H, NAUMOVA A K, LIEBHABER S A, et al. Physical and meiotic mapping of the region of human chromosome 4q11-q13 encompassing the vitamin D binding protein DBP/Gc-globulin and albumin multigene cluster[J]. Genome Research, 1999, 9(6): 581-587.
[10] JIN L, LONG L, GREEN M A, et al. The alpha-fetoprotein enhancer region activates the albumin and alpha-fetoprotein promoters during liver development[J]. Developmental Biology, 2009, 336(2): 294-300.
[11] WU G X, LIN Y M, ZHOU T H, et al. Significant down- regulation of alpha-albumin in human hepatoma and its implication[J]. Cancer Letters, 2000, 160(2): 229-236.
[12] ROZGA J, PIATEK T, MALKOWSKI P. Human albumin: old, new, and emerging applications[J]. Annals of Transplantation, 2013, 18: 205-217.
[13] RABBANI G, AHN S N. Structure, enzymatic activities, glycation and therapeutic potential of human serum albumin: A natural cargo[J]. International Journal of Biological Macromolecules, 2019, 123: 979-990.
[14] BASSOLI C, ORENI L, BALLONE E, et al. Role of serum albumin and proteinuria in patients with SARS-CoV-2 pneumonia[J]. International Journal of Clinical Practice, 2021, 75(4): 13946.
[15] RAHMANI-KUKIA N, ABBASI A, PAKRAVAN N, et al. Measurement of oxidized albumin: an opportunity for diagnoses or treatment of COVID-19[J]. Bioorganic Chemistry, 2020, 105: 104429.
[16] GATTA A, VERARDO A, BOLOGNESI M. Hypoalbuminemia[J]. Internal and Emergency Medicine, 2012, 7(S3): S193-S199.
[17] FANALI G, Di MASI A, TREZZA V, et al. Human serum albumin: from bench to bedside[J]. Molecular Aspects of Medicine, 2012, 33(3): 209-290.
[18] SLEEP D. Albumin and its application in drug delivery[J]. Expert Opinion on Drug Delivery, 2015, 12(5): 793-812.
[19] TAYYAB S, FEROZ S R. Serum albumin: clinical significance of drug binding and development as drug delivery vehicle[J]. Advances in Protein Chemistry and Structural Biology, 2021, 123: 193-218.
[20] KHODASHENAS B, ARDJMAND M, BAEI M S, et al. Bovine serum albumin/gold nanoparticles as a drug delivery system for Curcumin: Experimental and computational studies[J]. Journal of Biomolecular Structure & Dynamics, 2020, 38(15): 4644-4654
[21] IUS T. Detection of embryo-specific alpha-globulin in the blood serum of a patient with primary liver cancer[J]. Voprosy Meditsinskoi Khimii, 1964, 10: 90-91.
[22] CHEN T, DAI X, DAI J, et al. AFP promotes HCC progression by suppressing the HuR-mediated Fas/FADD apoptotic pathway[J]. Cell Death & Disease, 2020, 11(10): 822.
[23] WANG X, WANG Q. Alpha-fetoprotein and hepatocellular carcinoma immunity[J]. Canadian Journal of Gastroenterology and Hepatology, 2018, doi: 10.1155/ 2018/9049252.
[24] GALLE P R, FOERSTER F, KUDO M, et al. Biology and significance of alpha-fetoprotein in hepatocellular carcinoma[J]. Liver International, 2019, 39(12): 2214-2229.
[25] JERKOVIC L, VOEGELE A F, CHWATAL S, et al. Afamin is a novel human vitamin E-binding glycoprotein characterization and in vitro expression[J]. Journal of Proteome Research, 2005, 4(3): 889-899.
[26] VOEGELE A F, JERKOVIC L, WELLENZOHN B, et al. Characterization of the vitamin E-binding properties of human plasma afamin[J]. Biochemistry, 2002, 41(49): 14532-14538.
[27] MIHARA E, HIRAI H, YAMAMOTO H, et al. Active and water-soluble form of lipidated Wnt protein is maintained by a serum glycoprotein afamin/alpha-albumin[J]. Elife, 2016, 5: e11621.
[28] DIEPLINGER H, DIEPLINGER B. Afamin—A pleiotropic glycoprotein involved in various disease states[J]. Clinica Chimica Acta, 2015, 446: 105-110.
[29] THOMAS W J, MORGAN H G, CONNOR T B, et al. Studies of antiricketic activity in sera from patients with disorders of calcium metabolism and preliminary observations on the mode of transport of vitamin D in human serum[J]. The Journal of Clinical Investigation, 1959, 38(7): 1078-1085.
[30] DAIGER S P, SCHANFIELD M S, CAVALLI-SFORZA L L. Group-specific component (Gc) proteins bind vitamin D and 25-hydroxyvitamin D[J]. Proceedings of the National Academy of Sciences of the United States of America, 1975, 72(6): 2076-2080.
[31] DUCHOW E G, COOKE N E, SEEMAN J, et al. Vitamin D binding protein is required to utilize skin-generated vitamin D[J]. Proceedings of the National Academy of Sciences, 2019, 116(49): 24527-24532.
[32] VANBAELEN H, BOUILLON R. DEMOOR P. Vitamin D-binding protein (Gc-globulin) binds actin[J]. Journal of Biological Chemistry, 1980, 255(6): 2270-2272.
[33] BOUILLON R, SCHUIT F, ANTONIO L, et al. Vitamin D binding protein: a historic overview[J]. Frontiers in Endocrinology, 2019, 10: 910.
[34] SPEECKAERT M M, DE BUYZERE M L, DELANGHE J R. Vitamin D binding protein polymorphism and COVID- 19[J]. Journal of Medical Virology, 2021, 93(2): 705-707.
[35] DELANGHE J R, SPEECKAERT R, SPEECKAERT M M. Behind the scenes of vitamin D binding protein: more than vitamin D binding[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2015, 29(5): 773-786.
[36] LIU H J, HENSKE E P. Vitamin D binding protein: a new biomarker of disease severity in lymphangioleiomyomatosis[J]. The European Respiratory Journal, 2018, 52(5): 1801886.
[37] MIZEJEWSKI G J. Alpha-fetoprotein structure and function: relevance to isoforms, epitopes, and conformational variants[J]. Experimental Biology and Medicine (Maywood), 2001, 226(5): 377-408.
[38] MENG W, BAI B, BAI Z, et al. The immunosuppression role of alpha-fetoprotein in human hepatocellular carcinoma[J]. Discovery Medicine, 2016, 21(118): 489-494.
[39] ALSALLOOM A A. An update of biochemical markers of hepatocellular carcinoma[J]. International Journal of Health Sciences, 2016, 10(1): 121-136.
[40] HUMPHRIES J M, PENNO M A, WEILAND F, et al. Identification and validation of novel candidate protein biomarkers for the detection of human gastric cancer[J]. Biochimica et Biophysica acta, 2014, 1844(5): 1051-1058.
[41] JACKSON D, CRAVEN R A, HUTSON R C, et al. Proteomic profiling identifies afamin as a potential biomarker for ovarian cancer[J]. Clinical Cancer Research, 2007, 13(24): 7370-7379.
[42] BROWN J R. Structural origins of mammalian albumin[J]. Federation Proceedings, 1976, 35(10): 2141-2144.
[43] GREEN E D, RUBIN E M, OLSON M V. The future of DNA sequencing[J]. Nature, 2017, 550(7675): 179-181.
[44] NISHIO H, HEISKANEN M, PALOTIE A, et al. Tandem arrangement of the human serum albumin multigene family in the sub-centromeric region of 4q: evolution and chromosomal direction of transcription[J]. Journal of Molecular Biology, 1996, 259(1): 113-119.
[45] METCALF V J, BRENNAN S O, CHAMBERS G, et al. High density lipoprotein (HDL), and not albumin, is the major palmitate binding protein in New Zealand long- finned (Anguilla dieffenbachii) and short-finned eel (Anguilla australis schmidtii) plasma[J]. Biochimica et Biophysica Acta-Protein Structure and Molecular Enzymology, 1999, 1429(2): 467-475.
[46] METCALF V J, BRENNAN S O, GEORGE P M. The Antarctic toothfish (Dissostichus mawsoni) lacks plasma albumin and utilises high density lipoprotein as its major palmitate binding protein[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1999, 124(2): 147-155.
[47] NOEL E S, REIS M D, ARAIN Z, et al. Analysis of the albumin/alpha-fetoprotein/afamin/group specific component gene family in the context of zebrafish liver differentiation[J]. Gene Expression Patterns, 2010, 10(6): 237-243.
[48] GITLIN D, PERRICELLI A, GITLIN J D. The presence of serum α-fetoprotein in sharks and its synthesis by fetal gastrointestinanl tract and liver[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1973, 46(2): 207-215.
[49] ZHANG Y, GAO H, LI H, et al. The white-spotted bamboo shark genome reveals chromosome rearrangements and fast-evolving immune genes of cartilaginous fish[J]. Science, 2020, 23(11): 101754.
[50] FILOSA M F, SARGENT P A, FISHER M M, et al. An electrophoretic and immunoelectrophoretic characterization of the serum proteins of the adult lamprey, Petromyzon marinus L[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1982, 72(4): 521-530.
[51] FILOSA M F, SARGENT P A, YOUSON J H. An electrophoretic and immunoelectrophoretic study of serum proteins during the life cycle of the lamprey, Petromyzon marinus L[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1986, 83(1): 143-149.
[52] GRAY J E, DOOLITTLE R F. Characterization, primary structure, and evolution of lamprey plasma albumin[J]. Protein Science, 1992, 1(2): 289-302.
[53] NAGASE S, SHIMAMUNE K, SHUMIYA S. Albumin- deficient rat mutant[J]. Science, 1979, 205(4406): 590-591.
[54] RUFFNER D E, DUGAICZYK A. Splicing mutation in human hereditary analbuminemia[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(7): 2125-2129.
[55] GABANT P, FORRESTER L, NICHOLS J, et al. Alpha- fetoprotein, the major fetal serum protein, is not essential for embryonic development but is required for female fertility[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 12865- 12870.
[56] OTAGIRI M, CHUANG V T G. Albumin in Medicine: Pathological and Clinical Applications[M]. Singapore: Springer Singapore Pte. Limited, 2016.
The structure, function and evolution of mammalian albumin multigene family
YUAN Jian-rui, FENG Ying, ZHANG Xiao-hui, JI Guang-dong
(Ocean University of China, College of Marine Life Sciences, Institute of Evolution & Marine Biodiversity, Qingdao 266003, China)
albumin; structure; physiological function; evolution
Albumin multigene family in mammals consists of albumin (ALB), Vitamin D binding protein (DBP), alpha-Fetoprotein (AFP), alpha-albumin (AFM) and alpha-fetoprotein related protein (ARG), with the main characteristics of containing albumin domain. The former four proteins are present in the serum and are involved in transporting fatty acids or hormones, while ARG is probably localized in cell. This review will focus on the main structural characteristics, related functions and evolution of albumin family.
Mar. 17, 2021
The National Natural Science Foundation of China, No. 31970429; Shandong Provincial Natural Science Foundation, No. ZR2020MC050]
苑剑锐(1995—), 男, 山东东营人, 硕士研究生, 主要从事文昌鱼发育与进化研究, 电话: 15066870710, E-mail: yuanjianrui@ stu.ouc.edu.cn; 汲广东(1976—), 通信作者, 电话: 0532-82031665, E-mail: jamesdong@ouc.edu.cn
Q512+.1
A
1000-3096(2021)08-0089-09
10.11759/hykx20210317001
2021-03-17;
2021-04-10
国家自然科学基金项目(31970429); 山东省自然科学基金(ZR2020MC050)
(本文编辑: 谭雪静)

