硫酸羟氯喹药物不良反应文献分析
胡冬霞 姚 瑶 葛卫红 于 锋
1.中国药科大学基础医学与临床药学学院,江苏南京 210009;2.南京大学医学院附属鼓楼医院药学部,江苏南京210008
硫酸羟氯喹(hydroxychloroquine sulfate,HCQ) 是一种弱碱性的4-氨基喹啉化合物[1],于1944年首次合成[2],1955年经FDA批准用于临床[3],最初作为抗疟疾药物使用,随着科学研究的发展,人们发现HCQ还具有抑制免疫的作用[4],主要与干扰溶酶体活性、抑制抗原表达、减少Toll样受体信号传导、减少细胞因子产生以及降低自然杀伤细胞活性有关[3,5]。目前广泛应用于自身免疫病如类风湿性关节炎、系统性红斑狼疮等。HCQ与其同类药物氯喹相比,毒性更低[6],但不良反应也不容忽视,常见轻微不良反应主要涉及胃肠道、皮肤及皮下组织,严重不良反应主要涉及眼及心脏[4,6-7]。本研究通过检索HCQ不良反应相关文献,总结不良反应发生特点,为提高HCQ用药安全性提供参考。
1 资料与方法
1.1 资料来源
以关键词“硫酸羟氯喹”“不良反应”“hydroxychloroquine”“adverse reaction”和“case report”检索中国知网、维普、万方、Pubmed和Embase数据库,收集报道HCQ致不良反应的一次文献,检索时间自建库起至2020年3月18日。
1.2 纳入及排除标准
纳入标准:①患者相关信息完整(性别、年龄、原发疾病、HCQ累积剂量、用药疗程、不良反应发生时间、累及系统-器官及转归);②HCQ与不良反应因果关系明确;③不良反应发生时间明确;④患者转归明确;⑤中英文文献。排除标准:①重复文献;②因药物过量所致不良反应。
1.3 统计学方法
统计HCQ致不良反应文献中文献归属地、患者的性别、年龄、原发疾病、HCQ累积剂量、用药疗程、不良反应发生时间、累及系统-器官及转归等信息,其中不良反应采用《ICH国际医学用语词典》23.1版中的系统-器官分类术语进行分类[8]。符合正态分布的计量资料以()表示,不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示。
2 结果
通过检索得到文献374篇,根据纳入、排除标准筛选后可用文献为119篇(中文6篇,英文113篇),涉及不良反应126例,对文献归属地统计发现共涉及24个国家,其中例数较多的国家为美国(39例)、中国(12例)、英国(11例)、意大利(10例)。
2.1 人口学特点
126例患者中,男16例,女110例,女性所占比例超过男性。年龄7~92岁,平均(50.9±17.3)岁,47例(37.30%)患 者 集 中 在40~59岁,39例(30.95%)患者集中在60~79岁,30例(23.81%)患者集中在20~39岁,<20岁和>80岁的患者各有5例,由此可见,年龄段为40~59岁患者所占比例最大。
2.2 原发疾病分布
126例患者中,所患疾病以自身免疫性疾病(120例,95.24%)居多,有红斑狼疮52例(39.39%),类风湿性关节炎33例(25.00%),干燥综合征13例(9.85%),22例其他自身免疫病。
2.3 不良反应分类
将126例患者出现的不良反应按照累及系统-器官分类,其中皮肤及皮下组织毒性(42例)、眼毒性(29例)、心脏毒性(18例)较为常见。见表1。

表1 HCQ不良反应分类
2.4 不良反应与疗程的关系
126例患者的平均疗程为2(0.0625,8)年,最短疗程为8 h,最长疗程为31年。在<1个月出现不良反应的患者最多(36例),其中皮肤及皮下组织毒性患者最多(25例);5年以上的不良反应中眼(19例)、心脏(12例)、血液及淋巴系统毒性(4例)居多。见表2。

表2 HCQ不良反应与疗程
2.5 不良反应与累积剂量的关系
126例患者服用HCQ平均累积剂量为146(5.6,1022)g,最低0.2 g,最高3650 g。按剂量从低到高分组后发现,累积剂量<500 g的不良反应最多(81例),其中皮肤及皮下组织毒性最多(41例),见表3。
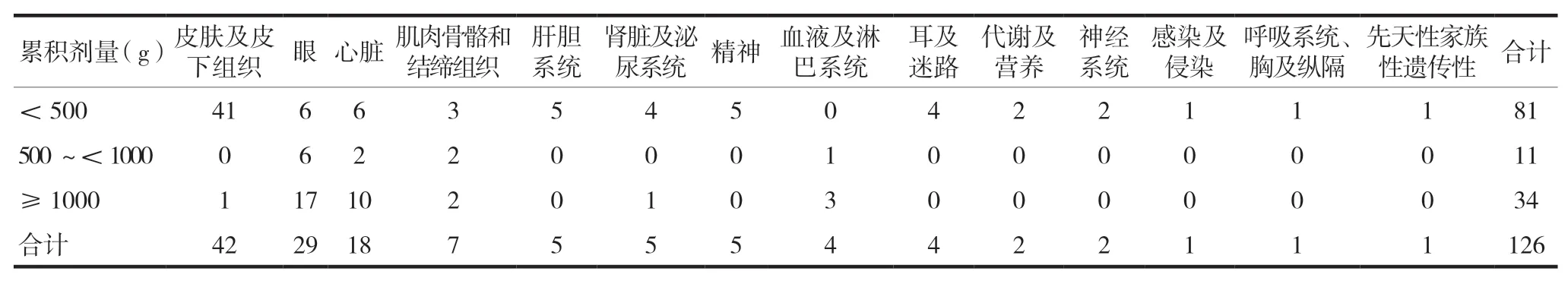
表3 HCQ不良反应与累积剂量
2.6 不良反应转归
126例患者出现不良反应后均接受相应治疗,其中皮肤及皮下组织、心脏、肌肉骨骼和结缔组织、肝胆系统、感染及侵染毒性致11例患者死亡;19例眼毒性、5例皮肤及皮下组织毒性、4例心脏毒性、4例血液及淋巴系统毒性、2例耳及迷路毒性、1例肾脏及泌尿系统毒性患者均未好转;其余80例患者经治疗后均好转。
3 讨论
3.1 HCQ的皮肤及皮下组织毒性
126例患者中HCQ致皮肤及皮下组织毒性最为常见,常见于短期治疗、累积剂量较低的患者,其中色素沉着、瘙痒症、皮疹、红皮病、银屑病等不良反应较轻,停药后可逐渐自愈;而AGEP、史蒂文斯-约翰逊综合征、中毒性表皮坏死症等不良反应较重,停药的同时往往需用糖皮质激素类药物治疗,大多数不良反应经治疗后好转,只有1例中毒性表皮坏死症患者治疗无效后死亡。有学者建议,如不良反应稳定,权衡利弊后可不必停药。
皮肤及皮下组织毒性发生机制较为复杂,本研究以AGEP与色素沉着为例介绍其发生机制及特点:AGEP是一种罕见皮疹,其特点是急性、广泛,大约90%的病例是药物过敏所致,其发病机制可能与HCQ促进T细胞释放大量IL-8细胞,从而吸引和激活多态核中性粒细胞有关[9];HCQ引起的色素沉着通常在治疗几个月或几年后开始,与治疗持续时间或累积剂量没有显著相关性[10],其机制可能与含铁血黄素与黑色素在皮肤表面沉积,同时大量含铁血黄素导致黑色素细胞激活有关[11]。研究指出对于已出现色素沉着的患者,应建议其进行眼部检查,及早发现病变[12]。
3.2 HCQ的眼毒性
眼部是HCQ第二大不良反应累及器官,本研究中有29例患者发生眼毒性,表现为视网膜病变,发生时间多在1年以上。眼毒性并不致命,但多不可逆(19例未好转)。美国眼科学会表明视网膜病变目前尚无治疗方法,建议在发现异常时立即停药,以减少视力损失。值得注意的是,HCQ从体内清除非常缓慢,甚至在停药后,视觉功能仍然可能继续恶化[13]。眼损害是限制HCQ临床使用的重要原因,机制可能与该药物对黑色素有极高的亲和性,容易沉积在富含黑色素的组织中(如视网膜、虹膜睫状体等)[14],并增加细胞溶酶体pH值,阻断自噬体与溶酶体结合,导致光感受器降解有关[15]。
HCQ眼毒性的危险因素包括:肥胖、高龄(>60岁)、高日剂量(>5 mg/kg实际体重)、高累积剂量(600~1000 g)、长期用药(10~25年)、肝肾功能不全、合用他莫昔芬(>6个月)、已有视网膜疾病、某些遗传多态性,其中高剂量和长期使用(>5年)是HCQ引起视网膜病变的最重要预测因子[3,16-17]。本研究中眼毒性发生时间多在1年以上,累积剂量>1000 g的例数较多(17例),说明眼毒性与累积剂量、疗程有一定相关性,与既往研究结果基本一致[14]。美国眼科学会建议,对于服用推荐剂量且没有其他主要危险因素的患者,应进行基线眼底检查以排除先前存在的黄斑病变,并在5年后每年筛查视网膜病变[16]。
3.3 HCQ的心脏毒性
无论短期或长期使用HCQ均有可能出现心脏毒性,短期毒性主要表现为传导异常,包括QT间期延长、QRS波增宽、房室传导阻滞,可能与HCQ阻滞钠、钾、钙离子通道有关[18];长期毒性主要表现为以向心性肥大、限制性及传导异常为特征的心肌病,其机制可能为:HCQ通过升高溶酶体pH值、抑制磷脂酶及降低溶酶体水解酶活性来减少囊泡融合和胞吐,从而引起溶酶体贮积症;溶酶体贮积症进一步引起代谢产物(如糖原和磷脂)的积累,导致细胞质空泡化和肌纤维去组织化,从而促进心肌细胞肥大和心肌纤维化的发展[19]。
与严重QT间期延长相关的危险因素包括高龄、机械通气、合并某些疾病(高血压、肾功能不全、冠心病、脑血管疾病)、基线QT间期延长及合用使QT间期延长药物;而心肌病的主要危险因素为高累积剂量[20]。本研究中心脏毒性发生时间最短为5 d,最长为31年,急性毒性多在2年以内发生,长期毒性多在2年以上发生,大多数心脏毒性可逆,但死亡例数较多(4例),因此无论使用时间长短,均建议定期监测患者心率,进行心电图、超声心动图、核磁共振检查[16],以便及早识别毒性、即时停药,尽可能逆转心脏毒性。
3.4 其他毒性
其他毒性虽然报道例数较少,但也不能忽视。其中肌肉骨骼和结缔组织、肝胆系统、肾脏及泌尿系统毒性等发生时间多在5年内,而血液及淋巴系统毒性多在5年以上;肌肉骨骼和结缔组织与肝胆系统毒性大多可逆,但也可致命。治疗时应注意监测肌力、三系细胞、肝功能等,必要时监测肌酸激酶、乳酸脱氢酶、醛缩酶及CT,如发现异常应即时停药[21]。
综上所述,无论男女,任何年龄的患者使用HCQ均有可能发生不良反应。不良反应中,皮肤及皮下组织毒性例数最多,常见于短期使用、累积剂量较低的患者,但死亡率低,停药后多可好转。随着疗程的延长、累积剂量的增加,眼、心脏、肌肉骨骼和结缔组织毒性等逐渐出现,其中心脏、肌肉骨骼和结缔组织毒性病死率高,眼毒性不可逆转,应定期监测心电图、肌力、眼底、视力。建议使用HCQ时,应先注意排除有既往病史的患者,并监测皮肤及皮下组织、心脏系统及眼毒性,以提高用药安全性。

