解钾菌与盐胁迫对枸杞幼苗根系特征和生理代谢的影响
朱娟娟,马海军,覃洪云,徐小云,张 琇,3
(1.北方民族大学生物科学与工程学院,宁夏 银川 750021;2.宁夏葡萄与葡萄酒技术创新中心,宁夏 银川 750021;3. 宁夏特殊生境微生物资源开发与利用重点实验室,宁夏 银川 750021)
土壤盐渍化是威胁全球农作物生长发育的主要非生物因素之一[1-2],过量的钠离子引起植物细胞脱水损伤,减少膨胀压力,破坏关键生化过程,降低植物叶片光合能力,严重抑制作物的生长和产量,并会造成品质的下降[3]。据统计,目前全球20%的耕地受盐碱化的影响,未来25 a将有超过25%的耕地遭受盐碱化和土壤退化[4-5]。因此,缓解盐分胁迫和寻求土壤盐渍化解决方案将对农业可持续健康发展至关重要。
枸杞(Lyciumbarbarum)为茄科(Solanaceae)药食同源的落叶灌木,具有耐土壤贫瘠、耐盐碱、抗旱、抗寒等特点,其果实药用价值高,可作为保健食品和药品提高人体免疫力,具有滋肝、补肾、明目等功效,是宁夏重要的经济果林树种,也是当地农民增收的主要来源。宁夏引黄灌区盐渍化耕地占总耕地面积的33.5%,在碱性土壤和盐渍化耕地上枸杞生产发展迅速,但其产量和品质受盐碱胁迫的影响是目前亟需解决的问题[6]。植物根际促生菌(PGPR)是植物根际土壤中一类可以促进植物生长的有益微生物,并且能够防治病害、增加作物产量以及减轻植物承受盐胁迫的压力,提高植物的抗性,故接种PGPR已经成为一种环境友好、经济有效的促进植物在盐渍化土壤中生长的发展策略[7-8]。解钾菌是植物根际促生菌的一种,能分解长石、云母等硅酸盐类原生态矿物,使土壤中难溶性钾、磷、硅等元素转变为可溶态的一类细菌,有的亦有固氮、溶磷、产生植物生长激素(生长素、细胞分裂素、乙烯、吲哚乙酸和赤霉素)和有机酸的作用[9],能够通过各种直接和间接作用促进植物的生长。研究表明,解钾菌能够通过产生铁载体、抗生素、硫化氢、抗真菌化合物、淀粉水解和纤维素降解等来促进作物生长、改善作物品质以及增强作物的抗逆性[10-12]。在逆境条件下,根系形态特征及活力状态是植物对土壤养分有效吸收和利用最直接的适应性特征之一,并且根系也是植物合成氨基酸和激素等物质的主要场所,其形态特征和活力状态与植株地上部各器官的生长发育、产量和品质的形成密切相关[13]。当植物处于盐胁迫环境中时,根系是植物第一个接触、感知和响应土壤盐分的器官[14],高盐离子浓度对根系结构和渗透作用、离子平衡及水分养分运输等多种生物过程均有负面影响[15]。前人研究已表明:解钾菌能够增加幼苗胚根长和根系干重,对植物根系生长有较好的促生效应[16]。然而,盐胁迫下解钾菌调控枸杞幼苗根系生长发育的研究报道甚少。因此,本研究以‘宁杞1号’为研究对象,通过苗期盆栽试验,探究两株解钾菌对盐胁迫下枸杞幼苗根系结构特征和根系生理指标及蔗糖代谢酶活性的影响,揭示解钾菌和盐胁迫对枸杞幼苗根系生长发育的调控机制,为合理利用微生物菌肥、提高宁夏枸杞产量和改善其品质奠定理论基础。
1 材料与方法
1.1 试验材料
以宁夏当家品种‘宁杞1号’实生苗为试材,解钾菌由宁夏特殊生境微生物资源开发与利用重点实验室提供,是从宁夏固原市原州区闫堡村盐碱地土壤中自行分离得到的KSBGY01和KSBGY02两株菌,其解钾效率分别为12.8%和21.1%,分泌吲哚乙酸的量分别为11.32 mg· L-1和17.53 mg· L-1。本试验于2019年5―10月在宁夏特殊生境微生物资源开发与利用重点实验室进行。
1.2 试验设计
本试验采用双因素裂区设计,主因素为盐胁迫,副因素为解钾菌,共8个处理,分别为:CK:不添加NaCl和菌剂;B1:不添加NaCl,添加KSBGY01解钾菌发酵液5 mL;B2:不添加NaCl,添加KSBGY02解钾菌发酵液5 mL;B3:不添加NaCl,添加KSBGY01菌∶KSBGY02菌=1∶1的发酵液5 mL;NaCl-CK:100 mmol·L-1NaCl,不添加菌剂;NaCl-B1:100 mmol·L-1NaCl,添加KSBGY01解钾菌发酵液5 mL;NaCl-B2:100 mmol·L-1NaCl,添加KSBGY02解钾菌发酵液5 mL;NaCl-B3:100 mmol·L-1NaCl,添加KSBGY01菌∶KSBGY02菌=1∶1的发酵液5 mL,每个处理重复5次。
将枸杞种子用质量分数为0.5%的KMnO4溶液浸泡消毒30 min后[17],用无菌水快速冲洗至无色,于室温下用无菌水浸泡10 h,再用无菌水冲洗3次。将表面消毒后的种子均匀铺在湿润的无菌纱布上,表面再盖上一层纱布,置于25℃培养箱中催芽。基质按照蛭石∶珍珠岩∶细沙=1∶1∶2(体积比)混合后清洗晾干[18],于250℃的烘箱中烘30 min,等恢复到室温后装于上口径100 mm、底径70 mm、高度88 mm的营养钵中,每盆装基质1.5 kg,用无菌镊子将出芽的种子移入营养钵,每盆5粒种子,并在表面覆盖一层蛭石,然后加入适量灭菌的Hoagland营养液培养60 d,选取长势优良、大小一致的苗木进行移栽。为了避免钾元素对试验的影响,用无菌水洗去幼苗根部的细沙,移入装有2.5 kg灭菌细沙和3 g钾长石粉的花盆(上口径16 cm、下口径13 cm、高度17.5 cm)中,随后用灭菌的无钾Hoagland营养液培养10 d后进行盐处理和添加不同解钾菌发酵菌液(108CFU·mL-1),无菌对照添加发酵培养基5 mL,每2 d用称重法添加营养液,培养15 d后结束试验并切下根系进行数据测定。
1.3 测定指标与方法
根系结构特征分析采用植物根系分析仪测定(LA-S型,杭州万深检测科技有限公司,中国);根系活力采用氯化三苯基四氮唑(TTC)法测定[19]:超氧阴离子产生速率采用羟胺氧化法测定[20];H2O2含量采用高锰酸钾滴定法测定;可溶性糖含量采用蒽酮法测定[21];超氧化物歧化酶活性(SOD)活性采用氮蓝四唑(NBT)光化学还原法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用过氧化氢紫外分光光度法测定;谷胱甘肽过氧化物酶(GSH-Px)、蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)及转化酶(INV)活性均采用南京建成生物有限公司酶联试剂盒测定。
1.4统计分析
本试验采用SPSS 24.0统计分析软件进行方差分析,不同处理间差异比较采用最小显著差别(Least Significant Difference,LSD)法进行多重比较,利用Microsoft Excel 2013软件作图。采用主成分分析法来综合评价解钾菌对盐胁迫下枸杞幼苗根系生理生化特性的影响。
2 结果与分析
2.1 盐胁迫和解钾菌对枸杞幼苗根系形态特征的影响
由表1可知,盐胁迫显著降低枸杞幼苗根系总长度,约减小32.9%;但提高根系平均直径,约增加17.4%;而对根系投影面积、表面积、体积和根尖数无显著性影响。解钾菌除对枸杞幼苗根尖数无显著影响外,对根系形态特征其他指标均有显著影响。与不添加解钾菌相比较,B1、B2、B3解钾菌使枸杞苗根系投影面积分别增加2.0%、24.0%、6.8%;根系表面积分别增加2.0%、24.0%和5.9%;根系平均直径分别减少20.4%、2.99%、34.7%;B1和B2解钾菌使枸杞幼苗根系总长度增加53.8%和1.17%,而B3解钾菌使其降低0.45%;B2解钾菌使枸杞幼苗根系体积增加43.7%,而B1和B3解钾菌使其降低5.3%和34.2%。同时,盐胁迫与解钾菌交互作用对根系总长度、投影面积、表面积、体积和根尖数均有显著影响。不同处理间相比较,B1处理中枸杞幼苗根系总长度显著高于其他处理,B2处理中枸杞根系的投影面积、表面积和体积均显著高于其他处理,NaCl-CK处理中枸杞幼苗根系平均直径最大,并显著高于B1、B3和NaCl-B3处理,NaCl-B1处理中枸杞幼苗根尖数最大。
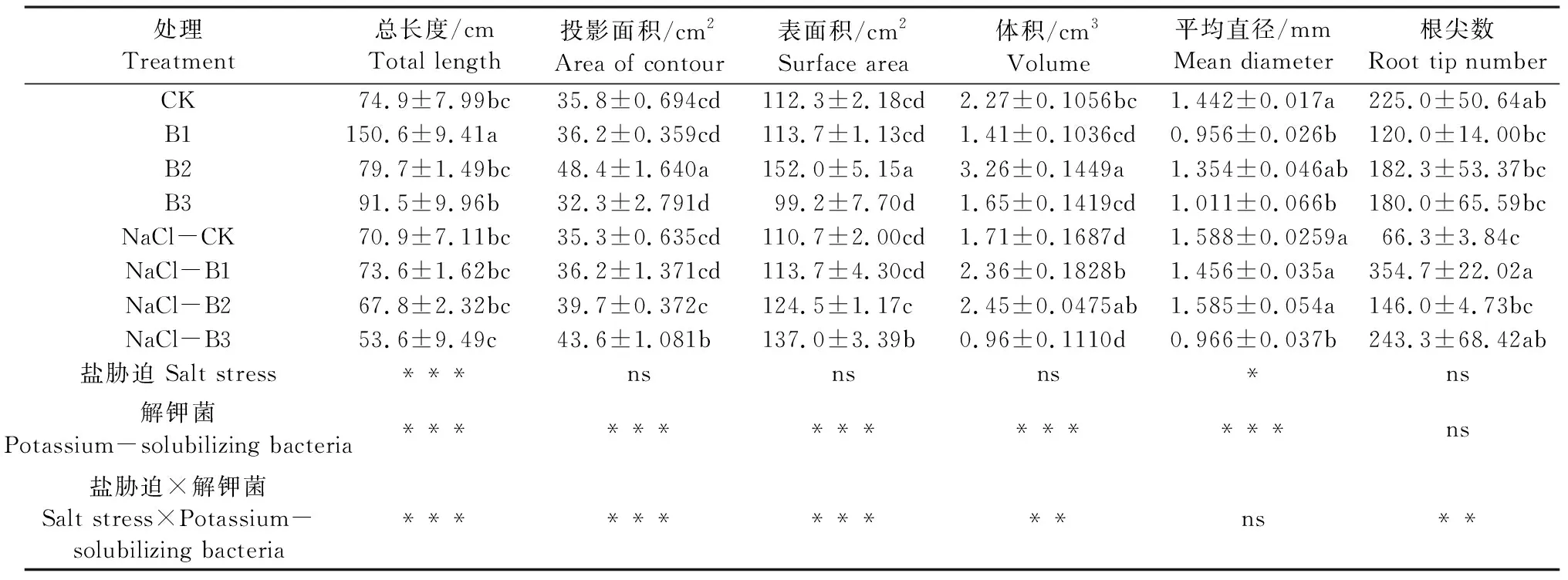
表1 盐胁迫与解钾菌对枸杞幼苗根系结构特征的影响Table 1 Effect of salt stress and potassium-solubilizing bacteria on root structure of Lycium barbarum seedlings
2.2 盐胁迫和解钾菌对枸杞幼苗根系活力的影响
由图1可知,盐胁迫对枸杞幼苗根系活力无显著影响(P>0.05),而解钾菌及其交互作用对根系活力有极显著影响(P<0.01)。非盐胁迫下,不同解钾菌处理中枸杞幼苗根系活力无显著差异;而盐胁迫下,添加B1解钾菌(NaCl-B1)能够显著提高根系活力,虽然NaCl-B2和NaCl-B3处理与NaCl-CK处理间无显著差异,但其根系活力均有所下降。
不同处理间相比较,NaCl-B1处理中根系活力最强,并显著高于其他处理,分别比CJ、NaCl-CK、B1、B2、NaCl-B2、B3、NaCl-B3处理中根系活力高31.9%、66.2%、33.0%、34.8%、126.4%、43.8%、88.4%;而CK、NaCl-CK、B1、B2和B3处理间无显著性差异;NaCl-B2处理中根系活力显著低于其他处理(除NaCl-B3处理)。
2.3 盐胁迫和解钾菌对枸杞幼苗根系中活性氧含量的影响
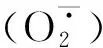
2.4 盐胁迫和解钾菌对枸杞幼苗根系抗氧化酶活性的影响
盐胁迫和解钾菌及其交互作用对根系SOD、CAT和POD酶活性无显著影响(P>0.05),而对GSH-Px酶活性有显著影响(P<0.05)。由图3可知,非盐胁迫下,B3解钾菌处理显著降低根系GSH-Px活性,而B1和B2与对照(CK)间均无显著差异;盐胁迫下,不同解钾菌处理与对照(NaCl-CK)间均无显著差异。不同处理相比较,NaCl-B1处理中枸杞幼苗根系GSH-Px活性最高,并且显著高于CK、B1、B2和B3处理,分别比CK、NaCl-CK、B1、B2、NaCl-B2、B3、NaCl-B3处理高84.6%、22.6%、62.6%、84.0%、22.2%、167.1%、31.4%。
2.5 盐胁迫和解钾菌对枸杞幼苗根系可溶性糖含量及其相关酶活性的影响
由图4可知,盐胁迫对枸杞幼苗根系可溶性糖含量无显著性影响(P>0.05),而解钾菌对其有显著性影响(P<0.05),其中B1、B2和B3解钾菌均能明显提高枸杞幼苗根系可溶性糖含量。不同处理间比较,NaCl-B2处理中幼苗根系可溶性糖含量最高,分别比CK、NaCl-CK、B1、NaCl-B1、B2、B3、NaCl-B3处理高38.5%、32.0%、0.7%、0.7%、1.4%、14.1%、4.8%。
非盐胁迫下,解钾菌显著降低根系SS活性,而对SPS和INV酶活性无显著影响;盐胁迫下,解钾菌能够显著提高根系SPS酶活性,但对SS酶活性的影响因解钾菌不同有所不同,其中B1和B2单菌能够提高SS酶活性,而混合菌(B3处理)显著降低根系SS酶活性。不同处理间相比较,NaCl-B2处理中根系SPS酶活性最高,分别比CK、NaCl-CK、B1、NaCl-B1、B2、NaCl-B3、B3处理高21.46%、56.06%、26.33%、5.88%、19.51%、21.86%、22.69%。NaCl-B1处理中枸杞根系SS酶活性最高,显著高于B1、B2、B3和NaCl-B3处理,分别比CK、NaCl-CK、B1、B2、NaCl-B2、NaCl-B3、B3处理高4.71%、9.83%、36.09%、29.33%、7.3%、60.48%、68.66%;B2处理中根系INV酶活性最高,分别比CK、NaCl-CK、B1、NaCl-B1、NaCl-B2、B3、NaCl-B3处理高4.05%、26.23%、22%、20.07%、74.57%、2.33%、55.16%。
2.6 相关性分析
2.7 主成分分析
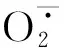
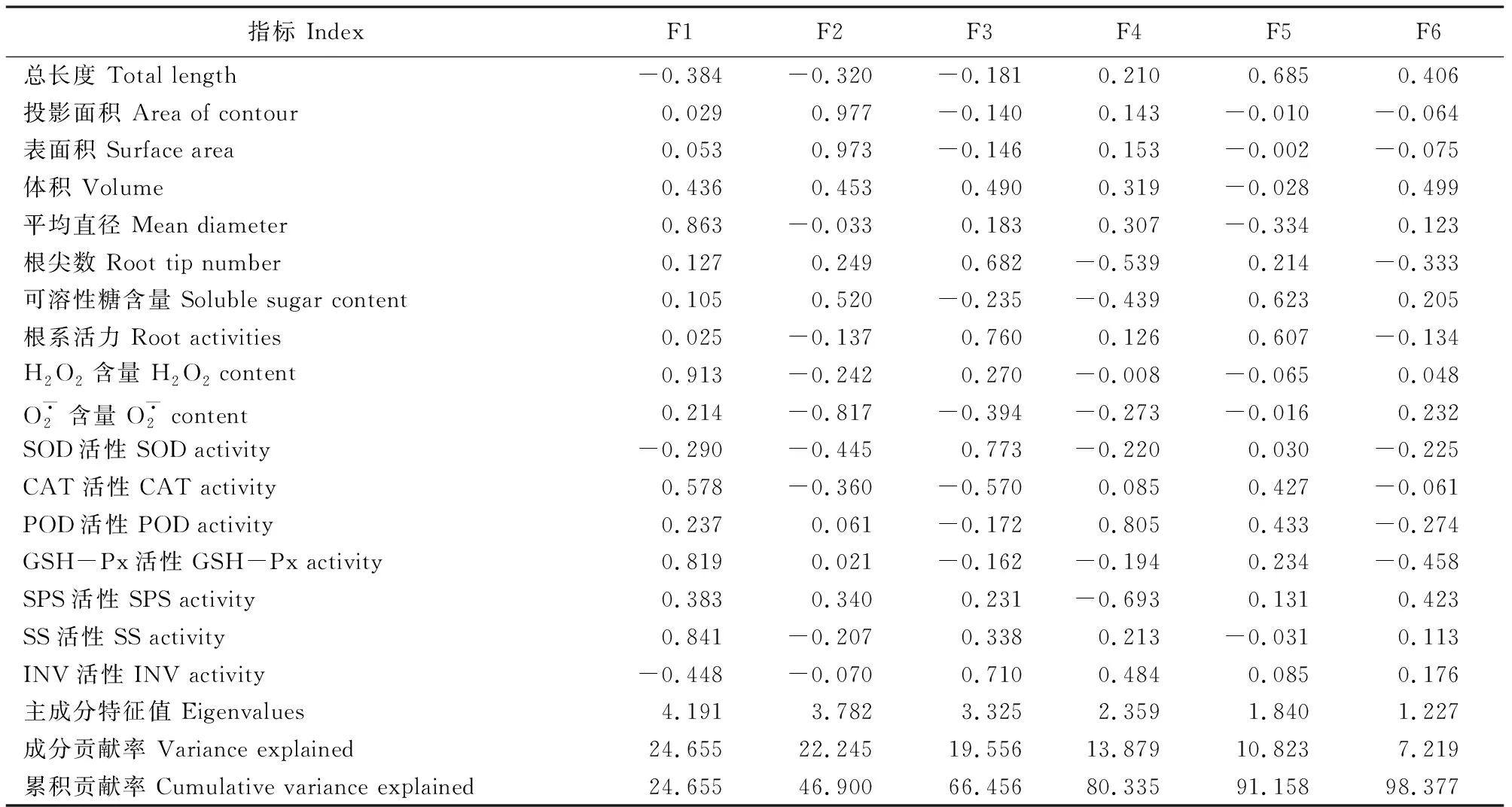
表3 主成分特征值、方差贡献率、累积贡献率和成分载荷矩阵Table 3 Eigenvalues, variance contribution rates, cumulative contribution rates and rotated component matrix
根据各指标因子得分系数的矩阵,构建6个主成分的函数表达式,随后根据每个主成分的贡献率计算得出不同处理中枸杞幼苗根系生长状况的综合得分,其值越大说明枸杞幼苗根系生长状况越好,综合评价得分结果见表4。排在前三名的为NaCl-B1、B2和NaCl-B2处理,排在最后两名的是NaCl-B3和B3处理。
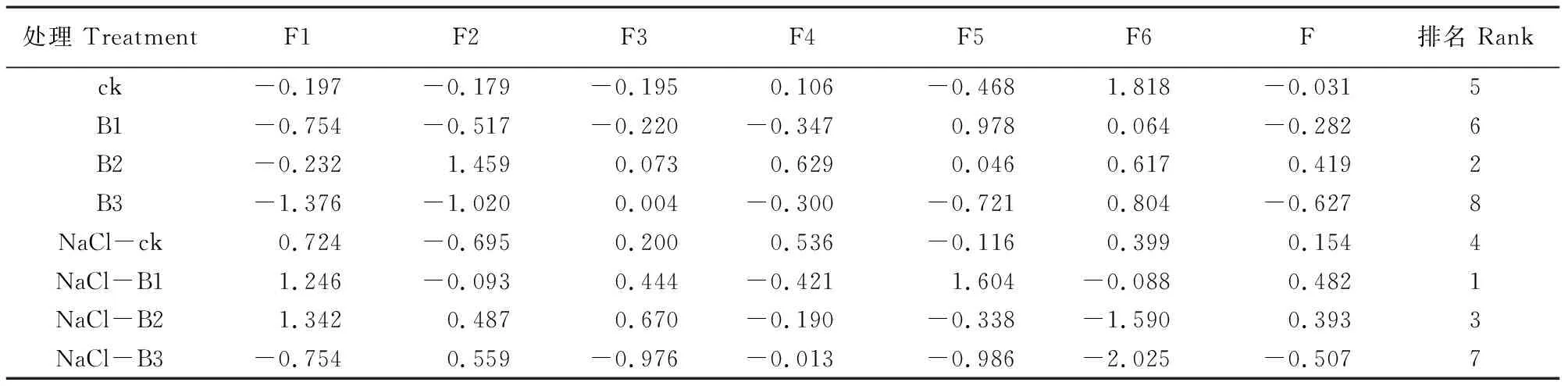
表4 不同处理下枸杞幼苗根系的各主成分得分、综合得分(F)及优良度排序Table 4 Principal component scores, comprehensive scores (F), and goodness ranking of roots of Lycium barbarum seedlings under different treatment
3 讨 论
根系形态是根系生长及分支的整体表现,除决定于遗传因素外还受环境因素影响[13]。逆境条件下,植物通过调节根系形态,包括根系数量、长度、表面积、总体积和直径以及在土壤中的空间构型等指标来适应胁迫环境,故这些指标在一定程度上能够反映根系的生长发育状况。根系活力也能够反应植物对土壤水分和营养物质的吸收能力,活力越强其吸收水分和营养物质的能力越强,运输至地上部的水分和营养物质越多,则植株生长发育就愈好。盐胁迫能够抑制初生根伸长、侧根形成及其重力生长,导致根系生长发育发生变化[23]。Fan等[24]研究发现,盐分胁迫显著降低草莓根的干重、表面积、体积和根尖数等指标;刘少华等[13]研究指出,低盐浓度使水稻幼苗根系的鲜质量、干质量、数量、长度、总体积和根系活力均有所增加;而高盐浓度使其明显降低。本研究表明,枸杞幼苗主要通过减小根系总长度和增加平均直径来适应盐胁迫环境。虽然根系总长度的降低可能引起根系对土壤中水分和营养物质的吸收能力减弱,但根系直径的增加弥补了根系对水分的吸收和养分的供应。同时,解钾菌对根系形态参数的影响随土壤环境不同而表现不同。非盐胁迫下,B1和B2单菌均能增加枸杞幼苗根系总长度、投影面积和表面积,但降低根系平均直径和根尖数;B2显著增加根系总体积,而B1却使根系体积有所下降。盐胁迫下,B1单菌使枸杞幼苗根系总长度增加了3.8%,B2单菌使枸杞幼苗根系投影面积、表面积和体积分别增加了12.5%、111.0%、43.3%,且B2单菌处理中枸杞幼苗的根系活力分别是NaCl-ck和ck处理的1.66倍和1.32倍;但B1与B2的混菌不仅无助于枸杞根系总长度、投影面积、表面积、体积和平均直径的增加,反而使各指标全部显著降低。然而,无论添加B1或B2的单菌还是其混合菌均能明显增加枸杞幼苗根系的根尖数,尤其NaCl-B1处理中根尖数是NaCl-ck对照的5.35倍。由此可见,盐胁迫下解钾菌能够通过增加枸杞幼苗根系的总长度、投影面积、表面积、体积、根尖数和根系活力缓解胁迫造成的伤害,最大限度为植株地上部器官提供水分和养分,减小因胁迫带来的损失。
盐分胁迫能够造成植物体内活性氧的产生与分解系统失衡,引起活性氧的大量积累,如果不能及时清除,则会引起植物细胞氧化损伤,导致细胞内的蛋白质、膜系统、光合作用均受到破坏[25]。当植物遭受逆境胁迫时,植物体内SOD、CAT和POD活性迅速升高,可有效清除活性氧自由基,保护细胞免受活性氧的伤害[26];同时,谷胱甘肽过氧化物酶(GSH-Px)也能催化还原型谷胱甘肽(GSH)为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜结构及功能,减少过氧化物的干扰及损害。本研究中盐胁迫主要引起枸杞幼苗根系H2O2含量增加,但根系中SOD、 POD和CAT酶活性无明显变化,而GSH-Px的活性有所提高,则表明枸杞根系中谷胱甘肽过氧化酶抗氧化系统对体内活性氧的变化感知更敏感。大量研究表明,植物促生菌能够显著提高植物幼苗叶片的抗氧化酶活性,即使在盐胁迫下,仍能提高水稻叶片的SOD、 POD和CAT酶活性[27-28]。本研究显示,B1菌主要通过提高根系GSH-Px活性,具有更强的活性氧清除能力,从而降低活性氧对膜脂的伤害,表现出较好的耐盐性;B1和B2的混合菌主要通过大幅度地降低H2O2含量,缓解活性氧对膜脂的伤害,表现出较好的耐盐性。
糖是植物体内重要的渗透调节物质,可以调控细胞的渗透平衡,参与胞内信号调节或转导过程,是植物生长发育和基因表达的重要调节因子[29]。顾秋香[30]指出盐分胁迫使葡萄砧木贝达的可溶性糖含量呈现先上升后下降的趋势;而3309C根系可溶性糖含量在胁迫初期未发生显著性变化,随着胁迫时间的推进出现显著下降趋势。本研究显示,盐胁迫对枸杞幼苗根系可溶性糖含量无明显差异,则说明盐胁迫环境中,枸杞幼苗能够通过保持体内的可溶性糖含量平衡来维持渗透平衡,使其具有较强的耐盐性;而不同解钾菌均能提高可溶性糖含量,有利于根系的生长发育。植物体内糖积累与其相关代谢酶密切相关,其获得同化产物的能力主要由库强决定,而蔗糖代谢相关酶活性对库强和糖卸载能力具有一定影响,进而影响植物体内糖分的积累[31]。蔗糖代谢属于碳代谢的分支,其关键酶主要有蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)和转化酶(INV),各种酶通过相互协调、相互作用为植物生命活动提供能量,但蔗糖代谢关键酶活性显著受外界环境的影响[29]。盐胁迫下,无论是添加B1或B2单菌还是其混菌均能提高枸杞幼苗根系SPS活性,促进根系中蔗糖的合成;然而,B1和B2单菌均能增强枸杞幼苗根系SS活性,但混合菌对其有负向作用,则表明添加B1和B2单菌更有助于根系体内糖类的积累,维持细胞的渗透平衡,为根系的生长发育提供更多能量,缓解盐胁迫的损伤。
4 结 论
本研究表明,添加解钾菌能够有效改善盐胁迫下枸杞幼苗根系的生长发育,且不同解钾菌的表现存在明显差异。通过对枸杞幼苗根系17项形态特征和生理生化指标进行主成分分析得出:无论是否盐胁迫,添加B1或B2单菌种效果优于其混合菌种,其中盐胁迫下,接种B1解钾菌更有利于枸杞根系的生长发育;非盐胁迫下,接种B2解钾菌更有利于枸杞幼苗根系的生长发育。

