苗药痛风停汤对高尿酸血症大鼠降尿酸机制研究
曹跃朋 马武开 刘正奇 安 阳1 张雄峰 张艺 曾商禹 钟琴
摘要 目的:通過探讨痛风停汤对高尿酸血症大鼠血尿酸水平、血清黄嘌呤氧化酶(XO)浓度、肾小管上皮细胞的尿酸盐转运体(UAT)mRNA和尿酸盐阴离子转运蛋白1(URAT1)mRNA的表达的影响,研究苗药痛风停汤的具体降尿酸作用机制。方法:将56只SD大鼠随机分为苗药痛风停高、中、低组、空白组和模型组、别嘌醇组、苯溴马隆组。除空白组每天给予普通饲料喂养外,其余各组均造成高尿酸血症大鼠模型。模型组和空白组均予等量生理盐水灌胃,其余各组分别予相对应药物灌胃,给药7 d后检测各组血清XO活性、尿酸及肾小管上皮细胞UATmRNA、URAT1mRNA的表达。结果:与模型组比较,1)降XO,除苯溴马隆组、苗药痛风停低剂量组,其余各组均可降低血清XO浓度(均P<0.01);别嘌醇组与苗药痛风停高、中剂量组疗效相当(P>0.05)。痛风停高、中剂量组比低剂量组降低XO效果更佳(P<0.05)。2)降尿酸,除苗药痛风停低剂量组,其余各观察组均有较好的降尿酸作用(均P<0.01);痛风停高、中剂量组与别嘌醇组、苯溴马隆组降尿酸效果相当(P>0.05)。3)调节UATmRNA表达,痛风停高剂量组可以上调UATmRNA表达(P<0.01),其余各组差异均无统计学意义(均P>0.05)。4)调节URATlmRNA表达,苗药痛风停高、中剂量组及苯溴马隆组均可以下调URATlmRNA表达(P<0.05),且效果相当(P>0.05)。其余各组差异均无统计学意义(均P>0.05)。结论:苗药痛风停汤可能通过抑制黄嘌呤氧化酶活性及上调UATmRNA、下调URAT1mRNA的表达达到降低高尿酸血症大鼠血尿酸浓度。
关键词 苗药痛风停汤;高尿酸血症;实验研究;黄嘌呤氧化酶;尿酸盐转运体
Study on the Mechanism of Miao Medicine Tongfengting Decoction on Decreasing Uric Acid in Hyperuricemia Rats
CAO Yuepeng1, MA Wukai1, LIU Zhengqi1, AN Yang1, ZHANG Xiongfeng1, ZHANG Yi2,3, ZENG Shangyu2,3, ZHONG Qin1
(1 The Second Affiliated Hospital, Guiyang University of Chinese Medicine, Guiyang 550003, China; 2 Research Center for
Academic Inheritance and Innovation of Ethnic Medicine of Chengdu University of Traditional Chinese Medicine, Chengdu
611137, China; 3 College of Ethnic Medicine in Chengdu University of Traditional Chinese, Chengdu 611137, China)
Abstract Objective:To explore the effects of Tongfengting Decoction on serum uric acid level, serum XO concentration, UAT mRNA and URAT1 mRNA expression of renal tubular epithelial cells of hyperuricemia rats, and study the specific mechanism of uric acid-lowering effect of Miao medicine Tongfengting Decoction. Methods:A total of 56 SD rats were randomly divided into a Tongfengting low dose group, a medium dose group and a high dose group, a blank group, a model group, an allopurinol group and a benzbromarone group. Except for the blank group, which was fed to the common diet daily, the other groups were prepared into hyperuricemia model. The model group and the blank group were given the same amount of normal saline, and the other groups were given the corresponding drugs. All rats were dosed for 7 days, and on the seventh day after dosing, the serum uric acid level, serum XO concentration, UAT mRNA and URAT1 mRNA expression of renal tubular epithelial cells of every group rats were detected. Results:Compared with the model group:1)on decreasing the XO:except for the benzbromarone group and the Miao medicine Tongfengting low dose group, and the other groups can reduce the serum XO concentration(P<0.01); the efficacy of the allopurinol group was similar to that of the Miao medicine Tongfengting high dose group and medium dose group(P>0.05). The efficacy of the high dose group and medium dose group of Tongfengting were better than that of the low dose group(P<0.05). 2)on reducing the uric acid level:except for the Miao medicine Tongfengting low dose group, the other treatment groups had better uric acid-lowering effect(P<0.01); the efficacy of reducing uric acid level of the Miao medicine Tongfengting high dose group, medium dose group and the allopurinol group, the benzbromarone group were similar(P>0.05). 3)on regulating the expression of UATmRNA:the UATmRNA expression was up-regulated in the Miao medicine Tongfengtin high dose group(P<0.01), and the other groups were not statistically significant(P>0.05). 4)on regulating the expression of URAT1mRNA:the URT1mRNA expressions were down-regulated in the Miao medicine Tongfengtin high dose group, medium dose group and the benzobromoma group(P<0.05), and the efficacy of these groups were similar(P>0.05). The other groups were not statistically significant(P>0.05). Conclusion:The Miao medicine Tongfengtin Decoction can reduce the serum uric acid concentration in hyperuricemia rats by inhibiting the activity of xanthine oxidase, up-regulating the expression of UATmRNA and down-regulating the expression of URAT1mRNA.
Keywords Miao medicine Tongfengtin; Hyperuricemia; Experimental study; Xanthine oxidase; Urate transporter
中图分类号:R29;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.15.005
痛风(Gout)是由于长期体内嘌呤代谢紊乱或者尿酸排泄障碍而引起血尿酸升高、单钠尿酸盐(Monosodium Urate,MSU)沉积于关节所致的一种疾病,属于代谢性风湿病[1]。以反复的局部关节突发疼痛、局部或全身痛风石形成及引起关节变形、肾脏功能损害及泌尿系结石甚至发生肾脏衰竭等为临床特征。本病属于中医学“痹证(热痹)”“历节”“痛风”等范畴。“湿热”是历代医家认为痛风发病的一个重要病因,有研究表明湿热蕴结证是急性痛风性关节炎中医证的髙发证型[2]。中医的“湿热蕴结”与苗医药中“火毒”理论在病机及对其治则上相一致。基于此,我们将中医理论与苗医相结合,提出痛风的发病是由于湿浊久蕴,化瘀化热,终成“瘀毒”所致,治疗当以“清浊、解毒、化瘀”为主,应用贵州苗族民间草药组成痛风停方。在前期实验研究及临床观察中我们发现苗药痛风停汤对痛风性关节炎疗效确切,且未出现明显的不良反应[3-5]。本研究通过构建高尿酸血症大鼠模型,加入苗药痛风停汤进行干预,探讨痛风停汤对高尿酸血症大鼠血尿酸水平、血清黄嘌呤氧化酶(Xanthine Oxidase,XO)浓度、肾小管上皮细胞的尿酸盐转运体(Urate Transporter,UAT)mRNA和尿酸盐阴离子转运蛋白1(Urate-anion Transporter1,URAT1)mRNA表达的影响,研究苗药痛风停汤的具体降尿酸的机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取4周龄清洁级SD雄性大鼠56只,平均体质量(200±20)g,购自于重庆滕鑫生物公司,许可证号:SCXK-(军)2012-0011。在贵阳中医学院实验动物中心同等条件下饲养。动物实验中心采用空调控温,室温18~25 ℃,湿度55%~65%,12 h光照/黑暗循环,室内有换气设备。分笼饲养,采取自由进食和饮水,每天更换木屑等垫料,大鼠适应1周后开始实验。给予大鼠以人道关怀。符合中华人民共和国卫生部动物实验伦理管理条例(No.55,2001)和贵阳中医学院实验动物管理条例规定。
1.1.2 药物 别嘌醇片[世贸天阶制药(江苏)有限责任公司,批号:20101047]。苯溴马隆(宜昌长江药业公司,批号:36384)。苗药痛风停方(大血藤、观音草、芭蕉根、络石藤、生石膏、川牛膝、川萆薢等)购买于贵阳中医学院第二附属医院制剂室。
1.1.3 试剂与仪器 大鼠黄嘌呤氧化酶ELISA试剂盒(Rat XO ELISA KIT)(贵州赛兰博有限科技公司,批号:20171012);5%羧甲基纤维素钠(天津市恒兴化学试剂制造有限公司,批号:20110728);氧嗪酸钾盐(Sigma公司,美国,批号:101310713);10%的酵母饲料(北京奥博星生物技术有限责任公司,批号:20130602)。ELISA酶标仪(Thermo Fisher Scientific Oy,美国,型号:Bio-TeKELx800V型);台式高速冷冻离心机(长沙迈佳森仪器设备有限公司,型号:TGL20M);实时定量PCR仪器(Bio-Rad Laboratories,Inc,美国,型号:CFX96;);电热恒温水浴锅(上海一恒科学仪器有限公司,型號:HWS12);-20 ℃冰箱(中科美菱,型号:DW-FL270)。
1.2 方法
1.2.1 分组与模型制备 将56只SD大鼠随机分为空白对照组、模型组、痛风停低剂量组、痛风停中剂量组、痛风停高剂量组、别嘌醇组、苯溴马隆组,共7组,每组8只。空白对照组每天给予蒸馏水10 mL/kg灌胃,普通饲料喂养。除空白组外,其余各组大鼠均予造模:将25 g氧嗪酸钾盐溶于0.5%羧甲基纤维素钠(CMC-Na)500 mL溶液中,250 mg/(kg·d)腹腔注射,同时给予质量分数10%的酵母饲料100 g/(kg·d)喂养,连续7 d。在造模第7天通过吸入异氟烷麻醉大鼠后,经大鼠眼球后静脉丛取血1~1.5 mL,检测血清尿酸含量,若血清尿酸值高于正常组均值20%,说明高尿酸血症模型大鼠造模成功。
1.2.2 给药方法与取材 痛风停总生药量为148 g,按照成人标准体质量60 kg根据人与大鼠体质量确定大鼠等效剂量为中剂量约为(3.7 g/kg),等效剂量的1/2倍为低剂量(1.85 g/kg),等效剂量的2倍为高剂量(7.4 g/kg)[6]。别嘌醇取等效剂量0.3 mg/kg,苯溴马隆取等效剂量为0.1 mg/kg。大鼠正常饲养1周后,参照上述造模,第7天目内眦取血测定用药前血尿酸浓度。造模成功后分别给药灌胃,其中模型对照组和空白对照组灌服等量生理盐水,各组连续给药7 d,1次/d。
1.2.3 检测指标与方法 于给药第7天给药后2 h开腹进行腹主动脉取血测定大鼠用药后血尿酸、肌酐、尿素等浓度,并分离血清,测定血清中黄嘌呤氧化酶浓度,留取肾脏标本,检测肾小管上皮细胞中的UATmRNA和URAT1mRNA的表达量。
1.2.3.1 尿酸酶-过氧化物酶偶联法检测血尿酸水平,碱性苦味酸终点比色法检测血肌酐水平。
1.2.3.2 酶联免疫吸附测定法检测血清黄嘌呤氧化酶活性 第14天给药后2 h开腹后进行腹主动脉取血,以3 000~3 500 r/min的速度,离心半径15 cm,离心10 min,将血清和红细胞迅速小心的分离,采用ELISA法检测大鼠血浆黄嘌呤氧化酶活性,按照ELISA试剂盒要求,吸取澄清上清液进行检测黄嘌呤氧化酶含量。
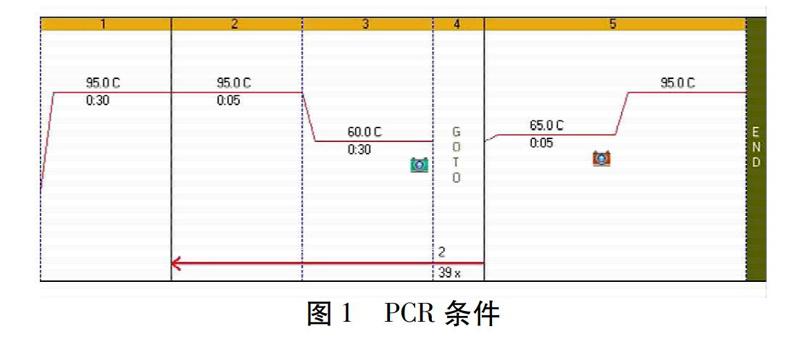
1.2.3.3 反转录-聚合酶链反应(RT-PCR)法检测肾小管上皮细胞中的UATmRNA和URAT1mRNA的表达量 RT-PCR法操作步骤根据说明书进行,等待反应结束后,读取并记录目的基因及内参基因的Ct值;将电脑中的数据拷出并计算目的基因的相对表达量(相对表达量用2-△△Ct表示);PCR条件如图1。引物设计见表1。
1.3 统计学方法 采用SPSS 19.0统计软件进行数据分析,所有计量资料以均数±标准差描述,多组间采用单因素方差分析,2组间比较用t检验,不同时间点数据采用重复测量的方差分析,方差齐时,各组间两两比较采用LSD检验,方差不齐时,则采用Tamhance′s T2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验过程中动物耗损情况 实验过程中所有动物均未脱落。
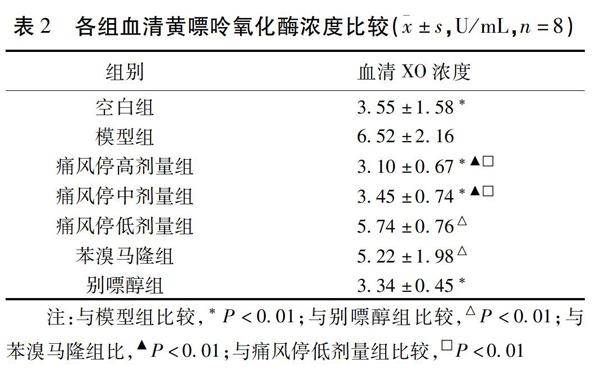
2.2 各组血清XO浓度比较 与空白组比较,模型组XO浓度差异有统计学意义(P=0.000<0.05);与模型组比较,苗药痛风停高、中组及别嘌醇组XO浓度均明显低于模型组,差异有统计学意义(P<0.05);与别嘌醇组比较,苗药痛风停低剂量组、苯溴马隆组差异有统计学意义(P<0.05),苗药痛风停高、中剂量组与别嘌醇组比较,差异无统计学意义(P>0.05)。见表2。
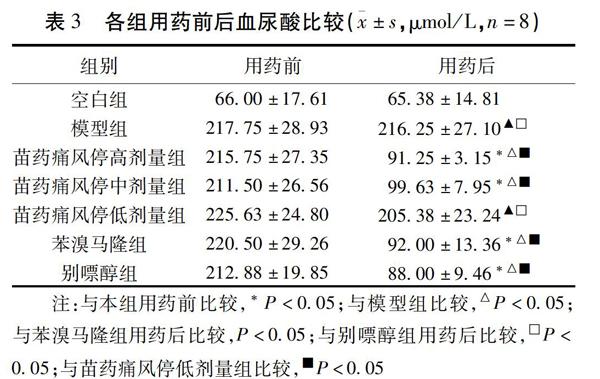
2.3 各组用药前后血尿酸比较 模型组与空白组比较,差异有统计学意义(P<0.05),提示造模成功;与本组用药前比较,除痛风停低剂量组以外,其余各观察组尿酸值均明显下降(P<0.05);与模型组比较,痛风停高、中剂量组、别嘌醇组、苯溴马隆组均有较明显的降尿酸作用(P<0.05);苗药痛风停高、中剂量组降尿酸作用与别嘌醇、苯溴马隆相当(P>0.05),但优于低剂量组(P<0.05)。见表3。
2.4 各组用药前后血肌酐比较 各组用药前后,测量血肌酐浓度,组内及组间比较差异均无统计学意义(均P>0.05)。见表4。
2.5 细胞总RNA的检测
2.5.1 内参基因β-actin的RT-PCR曲线图 见图2、3。
2.5.2 目的基因UAT的RT-PCR曲线图 见图4、5。
2.5.3 目的基因URATl的RT-PCR曲线图 见图6、7。
2.6 目的基因UAT、URATl定量结果
2.6.1 UATmRNA基因相对表达量比较 空白组与模型组比较,差异有统计学意义(P<0.01),提示造模成功。与模型组比较,痛风停高剂量组可以增加UATmRNA基因表达,差异有统计学意义(P<0.01),其余各组均无统计学意义(均P>0.05)。见表5。
2.6.2 UAT和URAT1mRNA基因相对表达量比较:空白组与模型组比较,差异有统计学意义(P<0.01),提示造模成功。与模型组比较,苗药痛风停高、中剂量组及苯溴马隆组URAT1mRNA基因表达均低于模型组,差异有统计学意义(P<0.05),且3组疗效相当(P>0.05)。余各组差异均无统计学意义(均P>0.05)。见表5。
3 讨论
痛风性关节炎的发病机制仍未明确,目前比较一致的观点是各种原因引起的高尿酸血症。有学者研究发现高尿酸血症患者有5%~12%的概率可进一步发展成为痛风[7-8],而80%~90%的痛风患者伴随着高尿酸血症[9]。XO是嘌呤分解代谢最后步骤中一种很重要的酶,主要参与核酸的代谢[10],次黄嘌呤在黃嘌呤氧化酶的作用下生成黄嘌呤,再进一步生成尿酸和自由基[11]。研究发现,XO活性增高可以导致原发性高尿酸血症和痛风[12]。对XO的研究是抗高尿酸血症和痛风药物研究的重点。
人体尿酸的以肾脏排泄途径为主,经尿道排出,约占总排泄量的2/3;其次为肠道排泄,或在肠道内被细菌尿酸氧化酶分解,约占总排泄量的1/3[13]。目前有4种尿酸盐转运蛋白参与人近曲肾小管转运[14]:生电型的尿酸盐转运子/通道(Human Urate Transporter,hUAT)、电中性的尿酸盐/阴离子交换子(Human Urate Anionex Changer,hURAT1)、有机阴离子家族成员(Human Organic Anion Transporter,hOAT1)hOAT1和(Human Organic Anion Transporter,hOAT3)hOAT3[15]。其中hURAT1是维持血尿酸水平的关键离子通道,位于近端肾小管上皮细胞刷状缘,主要参与近曲肾小管对尿酸盐的重吸收。膜表达蛋白hUAT作为贯穿细胞膜的高度选择性离子通道,是生电型尿酸盐/阴离子交换体,主要参与肾近曲小管对尿酸盐的分泌,为调节肾尿酸分泌的关键物质[16-17]。故hUAT蛋白或基因表达下降,hURAT1基因或蛋白表达提高为HUA发病的可能机制[18-19]。
本实验结果提示,在降低黄嘌呤氧化酶浓度方面:除苯溴马隆组、苗药痛风停低剂量组以外,其余各组均可降低黄嘌呤氧化酶浓度,差异有统计学意义,苗药痛风停高、中剂量组与别嘌醇组降尿酸作用相当,其疗效比低剂量组明显。在降尿酸方面:各观察组与模型组比较,苗药痛风停高、中剂量组及别嘌醇组、苯溴马隆组均有较明显的降尿酸作用。苗药痛风停高、中剂量组疗效明显,且与别嘌醇、苯溴马隆相当。对于UATmRNA基因相对表达量的影响,苗药痛风停高剂量组可以上调UATmRNA基因表达;对于URAT1mRNA基因相对表达量的影响,苗药痛风停高、中剂量组、苯溴马隆组可以下调URAT1mRNA基因表达,且作用相当;故苗药痛风停汤可降低高尿酸血症大鼠血尿酸含量,以苗药痛风停高、中剂量组疗效较好,呈剂量依赖性。其降尿酸作用可能是通过抑制URATl基因的表达、上调UAT基因的表达,抑制黄嘌呤氧化酶活性共同实现的。
综上所述,我们认为苗药痛风停汤能够通过抑制黄嘌呤氧化酶活性及上调UATmRNA、下调URAT1mRNA的表达实现降尿酸作用,且其不良反应小,值得在临床上进一步推广使用。
参考文献
[1]顾祖莲,黄惠珠,施琬,等.中药药对虎杖-桂枝对急性痛风性关节炎的影响[J].中药新药与临床药理,2015,26(3):315-319.
[2]杨瑞宇,李兆福,李具宝,等.342例急性痛风性关节炎病例回顾性分析[J].光明中医,2013,28(8):1569-1571.
[3]刘正奇,钟琴,杨良山,等.苗药痛风停对SD大鼠急性痛风性关节炎的影响[J].风湿病与关节炎,2015,4(8):9-14.
[4]曹跃朋,黄华,钟琴,等.苗药痛风停汤治疗痛风性关节炎60例[J].风湿病与关节炎,2013,2(5):5-6,10.
[5]郭英奇,钟琴.痛风停汤治疗湿热蕴结型痛风80例临床观察[J].内蒙古中医药,2013,32(2):1.
[6]姜德友,刘彤彤,常佳怡,等.补肾利湿法对痛风性关节炎大鼠关节腔滑膜组织URAT1的影响[J].上海中医药大学学报,2016,30(6):52-56.
[7]刘佳,李玲.高尿酸血症的发病机制与药物治疗研究进展[J].國际药学研究杂志,2012,37(1):24-28.
[8]赵同德,张强,杨甜甜,等.原发性高尿酸血症与痛风流行病学及危险因素研究进展[J].齐鲁医学杂志,2017,32(1):109-110,113.
[9]Smith EU,Díaz-Torné C,Perez-Ruiz F,et al.Epidemiology of gout:an update[J].Best Pract Res Clin Rheumatol,2010,24(6):811-27.
[10]马旭.抗痛风中药复方的优选及其对高尿酸血症小鼠XO、ADA的影响[D].石家庄:河北医科大学,2016.
[11]李英,陈君,李萍.金银花中酚酸类和黄酮类成分的黄嘌呤氧化酶抑制活性[J].中国药科大学学报,2011,42(5):407-411.
[12]李芮,马良会,王栋.9种通络祛风中药提取物对黄嘌呤氧化酶的体外抑制活性研究[J].中国药房,2020,31(6):677-682.
[13]李智娟,成志锋.新型促尿酸排泄药物的研究进展[J].医学综述,2018,24(15):3045-3049.
[14]黄胜华,连希艳.高尿酸血症及其肾损伤的研究进展[J].医学研究生学报,2010,23(11):1217-1221.
[15]杨会军,李兆福,万春平,等.尿酸盐转运蛋白在原发性痛风及高尿酸血症中的研究进展[J].中华中医药学刊,2013,31(9):1891-1894.
[16]Reginato AM,Mount DB,Yang I,et al.The genetics of hyperuricaemia and gout[J].Nat Rev Rheumatol,2012,8(10):610-621.
[17]Kolz M,Johnson T,Sanna S,et al.Meta-analysis of 28,141 individuals identifies common variants within five new loci that influence uric acid concentrations[J].PLoS Genet,2009,5(6):e1000504.
[18]Liu-Bryan R,Pritzker K,Firestein GS,et al.TLR2 signaling in chondrocytes drives calcium pyrophosphate dihydrate and monosodium urate crystal-induced nitric oxide generation[J].J Immunol,2005,174(8):5016-5023.
[19]Wortmann RL.Recent advances in the management of gout and hyperuricemia[J].Curr Opin Rheumatol,2005,17(3):319-324.
(2021-06-10收稿 责任编辑:王明)
基金项目:国家重点研发计划项目(2017YFC1703904);国家自然基金项目(81660811);贵州省科技计划项目(黔科合LH字[2016]7128号);贵阳市科技计划项目(筑科合同[2019]-9-4-27号);贵州省教育厅青年科技人才成长项目(黔教合KY字[2018]217)
作者简介:曹跃朋(1986.02—),男,硕士研究生,主治医师,研究方向:中西医结合风湿免疫病防治,E-mail:1037481658@qq.com
通信作者:钟琴(1963.04—),女,本科,主任医师,研究方向:中西医结合风湿免疫病防治,E-mail:gycyp2013@163.com

