皮肤修复生物3D打印的研究进展与挑战
连伟龙,连 芩*,焦 天,何晓宁,赵 明,胡大海,万 敏
皮肤修复生物3D打印的研究进展与挑战
连伟龙1,2,3,连 芩1,2,3*,焦 天1,2,3,何晓宁4,赵 明5,胡大海5,万 敏6
1西安交通大学,机械制造系统工程国家重点实验室,陕西 西安 710054;2季华实验室,广东 佛山 528200;3国家药品监督管理局医用增材制造器械研究与评价重点实验室,陕西 西安 710054;4西安电子科技大学,陕西 西安 710049;5空军军医大学,西京医院烧伤与皮肤外科,陕西 西安 710032;6山东省医疗器械产品质量检验中心,国家药品监督管理局医用卫生材料及生物防护器械质量评价重点实验室,山东 济南 250101
皮肤作为人体最大的器官,有着屏障功能、免疫应答、防止水分流失和排泄废物等重要作用。大面积的严重皮肤损伤患者会由于缺乏充足的可移植皮肤而死亡。生物3D打印技术的发展为可移植皮肤的制造提供了解决办法。生物3D打印技术可以定制化制造功能性的皮肤替代品,有望解决移植皮肤短缺的困难。本文简述了皮肤创伤修复原理,比较了用于皮肤修复的生物材料墨水、细胞和主要的生物3D打印技术,分析了光电技术在3D打印皮肤上的应用潜力,并总结了生物3D打印技术在皮肤修复应用中所面临的挑战和未来的发展方向,提出了光电技术在生物3D打印中的应用需求。
生物3D打印;皮肤;生物墨水;细胞;光电技术
1 引 言
皮肤是人体最大的器官, 具有屏障功能、免疫应答、防止水分流失和排泄废物等重要作用[1]。皮肤遭受大面积严重损伤后,由于体液的流失、渗透压的失衡和伤口的感染会造成患者的休克甚至死亡[2]。据世界卫生组织统计,全球约1100万皮肤损伤患者需要治疗,其中有三十万人因缺乏有效的治疗而死亡[3]。大面积皮肤损伤患者自体皮肤移植往往没有足够的皮肤供体位点,异体皮肤和异种皮肤又存在免疫排斥的问题,皮肤伤口辅料不具备生物活性。所以急需制造出可用于皮肤移植的人造皮肤。
生物3D打印技术的出现为皮肤的制造提供了解决思路。生物3D打印技术是通过逐层堆叠组织,同时使用计算机辅助转移工艺制造活细胞和生物材料(例如水凝胶,生物玻璃,生物陶瓷和胶原蛋白等)来进行生物工程构造[4]。作为一种增材制造技术,生物3D打印基于生物材料的沉积,以微米尺度封装细胞或随后装载细胞,形成与组织相似的微妙结构[5]。打印分辨率为10 μm~10000 μm,与其他方法(例如模制)相比,该分辨率显示了生物打印的灵活性。生物3D打印可以替换丢失的细胞群体,可以分泌有助于组织修复各种生长因子[6]。生物3D打印是一个正在发展的领域,将引领医学科学的全球革命,并且由于其在疾病治疗方面的巨大影响而受到了全世界的广泛关注,被认为在组织工程领域具有重大影响[7]。目前应用于皮肤制造的生物打印技术主要有喷墨、挤出、激光辅助和光固化,光电技术以其精确的测量、快速响应以及便于数字化和智能化等优势也逐渐应用于皮肤的3D打印。
本文介绍了皮肤的组织结构特征与创伤修复的基本原理,总结了用于皮肤创伤修复的材料、细胞、生物3D打印技术及其最新的研究进展,总结了光电打印技术在皮肤生物3D打印领域应用进展,展望了光电打印技术在皮肤制造应用的潜力和面临的挑战。
2 皮肤的创伤修复
2.1 皮肤的创伤修复原理与方法
皮肤的创伤修复过程包括一系列复杂的调节阶段,如止血、炎症、增殖和细胞外基质(ECM)重塑等[8]。这四个阶段涉及各种类型的细胞、生物活性因子和支持各部分之间相互作用的环境,该环境通常是由细胞分泌的天然ECM营造的[9]。伤口愈合开始于止血和炎症。这个阶段涉及血小板和免疫细胞的聚集以控制血液的流失和病原体的清除;增殖阶段包括许多过程,例如肉芽组织发育(临时ECM的形成),血管生成和再上皮化(表皮皮肤层的形成),从而导致伤口收缩;最终阶段是重塑过程,在此过程中,先前形成的基质缓慢变形,形成功能性皮肤或半/无功能性疤痕组织[10]。这四个阶段的任何一个阶段都会影响伤口的愈合,特别是对于大面积创伤而言,由于皮肤组织的大量损失或组织坏死而未能形成临时的ECM基质,自然愈合就会受到影响[11]。
目前,临床上最成功的愈合治疗措施就是伤口敷料或皮肤移植形成的人造基质[12],但是伤口敷料仅用于吸取伤口渗出液、保湿和抗菌方面,并不具备生物调控功能,因此对于大面积皮肤创伤而言,协助愈合效果十分有限;而皮肤移植的方法面临可移植皮肤数量有限的问题。Liu等人[13]使用Pelnac覆盖在切碎的破损中厚皮肤移植物上,以修复大鼠模型中的全厚皮肤缺损,研究表明该方法可以提高伤口的愈合速度和质量,但是目前的应用需要进行两次手术,极大地增加了患者的痛苦。厚皮移植是目前治疗外伤性皮肤损
失的金标准,但是对于有严重烧伤的患者,皮肤移植受供体皮肤可用性的限制,面临自体皮肤有限和异体移植的免疫排斥反应等问题[14]。近些年来生物3D打印的快速发展,在技术、时间和成本各方面有望定制化解决伤口愈合和皮肤再生的现存问题。
2.2 用于皮肤的生物材料
生物材料对于确保3D打印架构中细胞的活力和响应能力至关重要,它必须具有生物相容性、可生物降解性、可打印性、生物惰性、牢固、耐用且具有延展性。生物材料的可打印性是指可以容易地以良好的分辨率进行打印,并具有保持其结构以用于打印后皮肤成熟的能力。生物材料应足够稳定,使皮肤构造物具有结构稳定性。在评估生物材料的可打印性时,形状保真度和打印分辨率是重要的考虑因素[15]。还要考虑生物材料的其他重要特性,包括胶凝动力学、流变特性和材料特性。理想地,生物材料的粘度应使其不仅支持细胞生长和分化而且还适合打印,但实际上适合于生物打印的粘度可能不支持细胞生存力。因此,为了获得良好的可打印性并同时确保高的细胞活力,需要优化打印条件和生物墨水的一致性。皮肤的生物力学和结构特征也是选择生物墨水的重要考虑因素,应该考虑的另一个重要因素是材料在体内降解的速度,应能够以与细胞产生ECM的速率相匹配[16]。
最常用的材料类型是聚合物,因此也称为生物聚合物。根据其生产来源,它们可以大致分为两种,即天然聚合物和合成聚合物。天然生物聚合物是指天然存在的生物聚合物,包括蛋白质(例如胶原蛋白、明胶、纤维蛋白原等)和多糖(例如壳多糖、藻酸盐等)[17]。合成生物聚合物是人造聚合物,包括聚乳酸(PLA)、聚乙醇酸(PGA)、聚己内酯(PCL)等。合成的生物聚合物具有优异的机械性能,而且能够通过改变聚合物结构来调整机械性能和降解特性,以适应皮肤移植[18]。但是,天然聚合物所具有的生物相容性、生物降解性、亲水性、生物学特性、信号传导特性与天然ECM十分相似性,这也是在皮肤生物3D打印应用中首选天然聚合物的重要原因,天然聚合物类生物材料的特点及应用,如表1所示。
生物材料的研究应用是生物3D打印技术得以使用的第一步,天然聚合物类(胶原,dECM等)是最有前途的材料,但是此类生物材料虽然具有更利于细胞附着和铺展的着位点,但是其机械性能较差并不能满足皮肤的防御功能。生物材料还具有很大的发展空间,先进生物材料或天然聚合物,可以进行改性优化以满足生物材料的可打印性和三维结构的稳定性与形状保持度;为了减小皮肤替代物与天然皮肤微环境的差距,可以在生物材料中添加生长因子和信号蛋白等;随着4D打印技术的提出,生物4D打印技术也将应运而生,刺激响应性智能材料可以提供如形状记忆等特性,通过微电流等刺激可以改变皮肤替代物的形状、厚度和功能以满足不同人群、不同部位的皮肤创口完全覆盖。这些涉及到了材料、生物、医学、机械等科学领域的前沿研究,还有很长的路要走。
2.3 细胞的主要功能及其在3D打印中的应用
细胞是确保患者皮肤再生组织的持久性和功能的最终来源[39],表2是用于皮肤修复的生物3D打印最常用到的细胞类型及其应用。当前,在伤口愈合和皮肤再生的制造过程中,最常用到的细胞类型是角质形成细胞和成纤维细胞。但是仅使用这两种细胞并无法完全形成皮肤的各个功能,因此还需要其他细胞和附属物。例如,皮肤色素的沉淀可通过黑色素细胞分泌的黑色素来实现[40];还可通过内皮细胞来促进血管的生成,这在一定程度上可以促进血管网的形成[41];在皮肤3D打印制造过程中,仅使用上述细胞,并不能维持组织之间的平衡,所以为了使组织具有自我更新和细胞间的相互交流的能力,可以考虑干细胞的使用。干细胞是具有自我更新和分化能力的独特细胞群。干细胞的特性,如释放特定的生长因子和细胞因子,代谢产物富含白细胞介素(IL)-10、IL-4、表皮生长因子(EGF)、粒-巨噬细胞集落刺激因子(GM-CSF)和转化生长因子(TGF)-β等生长因子。这些生长因子诱导皮肤产生蛋白质和弹性纤维以及新的蛋白质,这些蛋白质将恢复皮肤的弹性,减少黑色色素,并诱导基底细胞增殖导致表皮角质形成细胞的生长[42],分裂和分化为功能组织,冶愈合过程。在大鼠烧伤模型中移植新生干细胞来源的皮肤替代物可显著改善皮肤结构、再上皮化率和伤口愈合[43]。因此,干细胞被视为未来皮肤再生和皮肤组织工程最有希望的来源[44]。

表1 天然聚合物类生物材料的特点及应用
尽管大多数的研究仅涉及到了角质形成细胞和成纤维细胞,但是包括黑色素细胞在内的研究也在日益增多,并且在打印与天然皮肤相似的功能性皮肤,如血管化和神经的构建时,目前的细胞利用程度还远远不够。干细胞是未来皮肤组织工程中最好的选择,在未来通过建立诱导多功能干细胞库解决供体不足和异体免疫排斥反应等问题。但是,目前培养分化技术等限制了干细胞的发展潜力;干细胞的分化培养及信号通路的建立,通过外部微电流等刺激加以实现,通过附加刺激作用的强度和时间的不同,诱导干细胞分化为不同细胞;目前皮肤打印大多数仅涉及真表皮层的制造,对于深入肌肉层的多层软组织的制造还有一定困难,不仅在于打印技术程度的有限性,还在于肌肉细胞的定向铺展是个难题,通过利用打印路径的定向打印和外部刺激以提高肌细胞沿着肌肉束方向定向铺展,从而提高皮肤替代物和周围天然组织的联系程度。

表2 用于皮肤修复的生物3D打印的主要细胞类型及应用
3 用于皮肤修复的主要生物3D打印技术
生物3D打印的过程涉及五个不同的步骤(图1):1) 执行目标组织的成像/扫描;2) 使用成像输入CAD-CAM(计算机辅助制造)软件开发模型;3) 根据要打印的组织,仔细选择生物材料支架和细胞,可以使用一种或多种细胞类型;4) 使用生物打印机打印组织;5) 使生物打印的组织成熟。生物打印可以在体外或原位进行,如果在组织成熟后在体外完成,则将生物打印的组织构建体用于植入或体外测试[61]。
广义上讲,生物打印过程分为三个不同的阶段:预生物打印、生物打印和生物打印后成熟。所以,皮肤打印主要通过对皮肤创伤伤口的扫描建模、生物材料和细胞的准备、3D打印成型、打印组织的成熟培养等。用于皮肤的打印目前主要有喷墨打印、光固化打印、激光辅助打印和挤出打印,其打印原理如图2所示,原位打印和无创体内打印则是在此基础上开发的。

图1 生物3D打印的不同步骤和阶段
3.1 喷墨打印
喷墨打印原理如图2(a),它利用热,压电或声学驱动机制以高通量的方式沉积细胞悬浮液的液滴[62],以高精度按点滴的形式喷射墨水。喷墨打印可以控制活细胞在液滴中的沉积[63],并且通过调节喷嘴孔尺寸确保能够喷射从30 μm的单细胞水平到80 μm的多细胞水平。通过对细胞的这种精细控制,即使在液体基质中,也可以创建高分辨率的图案化细胞[64]。喷墨打印还能够以快速、可靠的方式制造具有高形状保真度的大规模带有细胞的水凝胶3D结构[65]。
Xu等人[66]研究了不同3T3细胞浓度对海藻酸钠生物墨水液滴形成的影响,发现随着细胞浓度的增加,液滴的尺寸和打印速度降低,该研究仅对含有一种成分的海藻酸钠生物墨水进行了液滴成形分析;Negro等人[67]通过优化两种不同生物墨水配方的打印参数,对于多组分的生物墨水沉积和可变液滴的喷射特性进行研究,实现了包含活细胞的多组分生物墨水的喷墨打印的3D图案化,产生了高分辨率、多成分的结构体;喷墨打印在能够满足含有活细胞水凝胶的图案化打印的同时,为了能够制造类似皮肤微结构的皮肤模型,Park等人[68]通过使用喷墨打印技术在水凝胶中将成纤维细胞打印成图案,在胶原蛋白基质内,成纤维细胞重新排列并重组了周围的ECM微环境,最终形成了垂直累积的胶原蛋白微结构,制造了在真皮-表皮交界处具有乳头状结构的人类皮肤模型;喷墨打印不仅可以来制造皮肤层复杂的微结构,还可以提高细胞在皮肤模型中的均布程度,特别是对含有黑色素细胞的皮肤制造,Min等人[53]和Ng等人[52]研究了使用喷墨打印的含黑色素皮肤的色素沉着效果。
尽管喷墨打印可以实现生物墨水的高精度沉积,但是可能会使细胞和材料暴露于热和机械应力环境下。对于声波打印机,使用高频声波会影响细胞的生存能力。喷墨打印也受到所用生物墨水粘度的限制,粘度越大,从喷嘴喷出墨滴所需的力就越大。此外,由于喷嘴堵塞问题,可用于打印的细胞密度低于皮肤的实际细胞密度[19],因此可用于打印的生物墨水必须是液体且粘度较低。喷墨打印作为一种局限于低粘度生物墨水的打印技术,其自身的特点是可以打印出具有高分辨率的图案化水凝胶,因此目前喷墨打印通常与挤出打印配合使用,实现血管化的皮肤打印[69]。

图2 用于皮肤的生物3D打印技术。(a) 喷墨打印;(b) 光固化打印;(c) 激光辅助打印;(d) 挤出打印
3.2 光固化打印
光固化打印原理如图2(b)所示,使用数字微镜设备将紫外线(UV)/可见光图案化的掩模投射到聚合物溶液上,从而使聚合物发生光聚合[70]。该系统由三个主要组件组成:DLP系统、UV-LED光源和光学透镜。数字掩模作为虚拟掩模序列加载到DLP系统,从而能够动态操纵DMD芯片的反射镜阵列以调整入射光并生成光图案[71],由DMD芯片反射和调整的UV光变成2D光图案,通过透镜投射到光敏溶液上,交联形成预设的图形并逐层叠加制造形成三维结构。
Ma等人[72]使用了两步打印的方法,以两步顺序打印的方式应用数字掩模版,打印了包含人诱导多功能干细胞来源肝细胞的5%(wt/vol)GelMA水凝胶作为第一层,第二层打印了含有人脐静脉内皮细胞和脂肪来源干细胞的2.5%(wt/vol)GelMA和1%GMHA混合水凝胶,形成了微型六边形结构,该方法证明了光固化打印的多细胞沉积和复杂微结构制造的可行性;为了实现皮肤血管组织的打印,Zhu等人[73]提出了微型连续光学生物打印平台,将充满细胞的预聚物溶液在血管通道掩模下由UV固化,并冲洗掉未聚合部分,将不含有细胞的预聚物溶液在平面掩模下由UV固化以包围血管网络,为血管化的生成提供了新方法;上述研究实现了具有血管组织的多细胞皮肤光固化打印,但是皮肤作为人体的第一道防御系统还应具有一定的机械特性,Zhou等人[74]在上层打印含有成纤维细胞的GelMA/HA-NB/LAP预聚物,下层打印网状的含内皮细胞的预聚物,形成具有一定机械特性和防御功能的皮肤替代物。
无论掩模分层的复杂程度和面积大小如何,光固化打印均能实现快速的高分辨率制造。由于光固化打印不使用喷嘴,因此不存在喷嘴堵塞的弊端,可以进行高细胞密度打印[75]。在该生物3D打印技术中,可以通过调节光源的功率、打印速度以及所用光引发剂的类型和浓度来调节聚合动力学。光固化打印不受生物墨水粘度的限制,可以实现100mm分辨率结构的制造,但是在紫外光的照射和固化过程中,会不可避免地对生物墨水中的细胞造成伤害,并且生物墨水需要与光引发剂混合才能实现固化,而光引发剂的存在可能会使生物墨水具有一定的毒性。为了克服这样的困难,除了采用较低能量的紫外光快速固化,开发非紫外光作为固化光源和生物性光引发剂也很有必要。
3.3 激光辅助打印
激光辅助打印的原理如图2(c)所示,实验装置包括一个激光源,一个“供体玻片”(它具有吸收激光能量的层和充满细胞的生物墨水层),以及“收集器基板”。当激光束照射在供体玻片上时,能量吸收层吸收激光能量,从而导致局部蒸发,产生的高气压将充满细胞的生物墨水的微滴推到收集器基板上[76]。
Koch等人[77]利用激光正向诱导转移技术进行生物打印,评估了皮肤细胞系(成纤维细胞和角质形成细胞)的细胞活力、增殖、凋亡活性和DNA片段化,证明了该技术是一种可用计算机控制打印定位不同细胞类型的安全可靠技术;为了进一步获得皮肤的分层3D模型,Koch等人[78]使用金属薄层(60 nm)用作激光能量吸收层,将成纤维细胞和角质形成细胞悬浮在胶原蛋白中沉积在供体玻片上,在MatridermTM基板上累积打印了40层满载细胞的生物墨水(上面20层角质形成细胞和下面20层成纤维细胞),结果在角质形成细胞和成纤维细胞之间观察到了细胞间粘附现象,该研究是最早对分层皮肤组织进行生物打印的尝试之一。
激光辅助打印也是一种无喷嘴的打印技术,具有与光固化打印相似的优点,但是激光能量吸收层一般是金属材质,当吸收高能量激光束时,金属颗粒会污染细胞,而且局部蒸发产生的高气压会影响细胞的活性。因此,在这几种生物打印技术中,激光辅助打印对细胞的伤害最大,激光束的高分辨率也使其是具有最高分辨率的生物打印技术,有望成为微血管网打印的关键技术。但是喷墨打印、光固化打印和挤出打印在血管网制造方面已经有大量研究,而激光辅助打印的高成本和较低的细胞存活率,使得该技术的应用研究十分有限。
3.4 挤出打印
挤出打印的原理如图2(d)所示,通常由气压控制器,活塞辅助系统和温度控制系统或螺杆辅助机构组成,该系统通过喷嘴连续挤压生物材料从而形成逐层制造[79]。与其他生物打印机相比,它提供更高的细胞密度,具有能够打印高粘度材料(超过600 kPas)的能力[80]。在该打印机中使用的生物墨水主要是软水凝胶,例如海藻酸钠、纤维蛋白和甲基丙烯酰化明胶等。
Di Bella等人[81]开发出一款挤出和光固化结合的原位生物打印设备,利用光固化水凝胶成形工艺,挤出同轴微丝,外层是光固化透明质酸/明胶材料,内层是混有间充质干细胞不含有光引发剂的透明质酸/明胶材料,挤出和光固化打印的结合使用为生物打印提供了更广阔的空间;Li等人[82]设计开发的基于挤出打印的原位打印设备,其扫描原理是三角法数学原理,选用投影仪作为光源,在物体表面投射光刀,其反射的图像会在工业相机上成像,成像的位置会由于光刀在物体表面投射点高度的不同而发生偏移;Lee等人[83]搭建了多材料挤出打印系统,通过灵活转换喷头组件,可按需打印包含不同类型细胞的多种生物墨水,这种集成的多通道挤出打印系统为组织工程的一体化定制打印提供了支持。

表3 用于皮肤修复的主要生物3D打印技术及其用于皮肤修复的特点
挤出打印可打印多种类型的生物材料,控制技术简单可靠,设备廉价使其成为生物打印皮肤替代品最有前途的打印技术,主要缺点是速度和分辨率低(低于50 μm),而且剪切应力的存在会影响细胞的生存能力,与喷墨打印和光固化打印相比,细胞存活率较低[62]。目前适合用于皮肤修复的生物材料,例如胶原、明胶等是典型的温敏性材料,其粘度随温度的变化而变化,而挤出打印操作简单,控制方便,通过添加温控喷头和温控成型平台来进一步提高挤出打印的成型效果成为一种主流。
以上几种打印的优缺点总结如表3所示。
3.5 原位打印
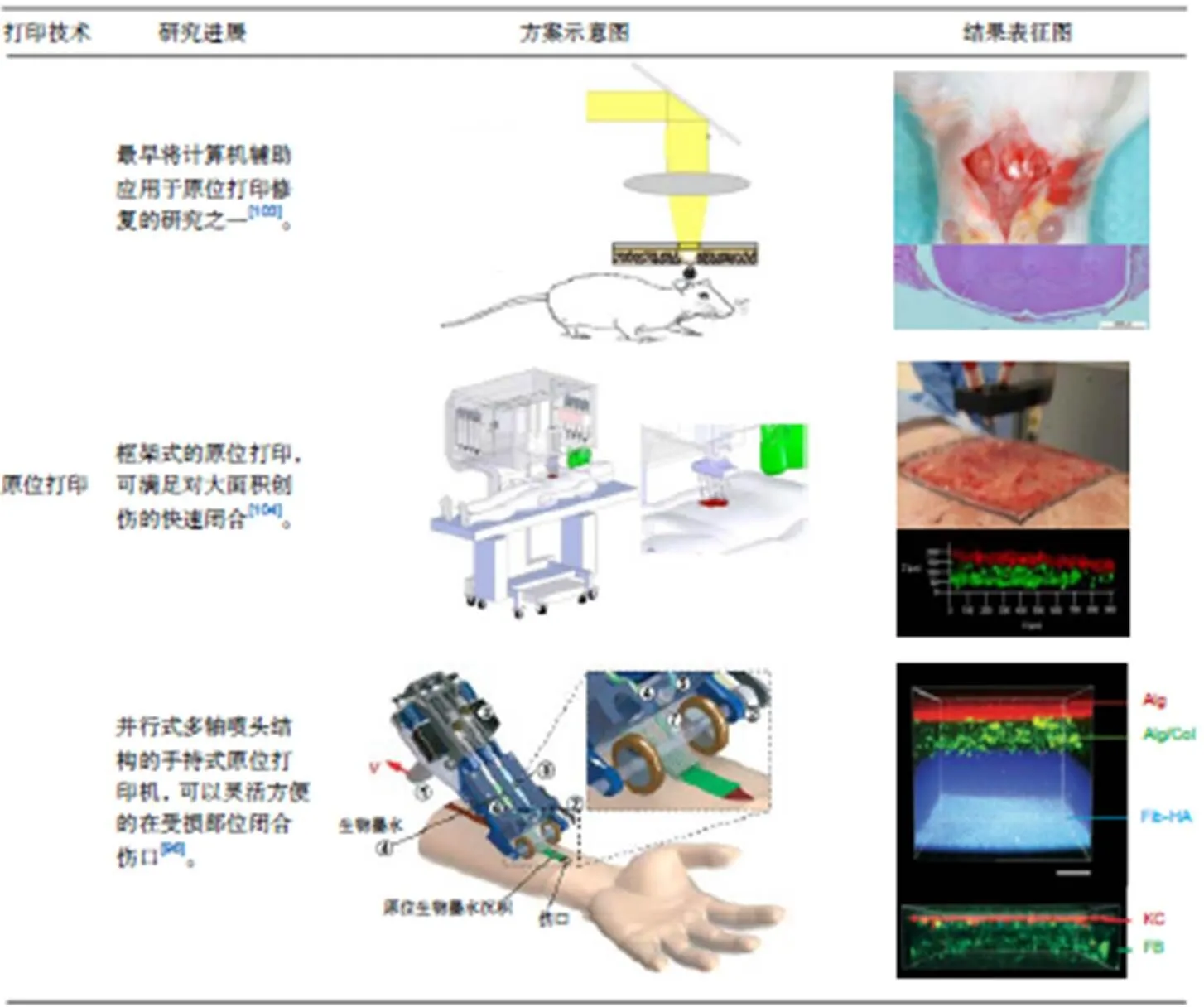
原位打印技术是生物3D打印的一个重要分支,是指根据组织或器官缺损部位的形状及特征,直接在缺损处打印生物材料来修复组织缺损的方法,如图3所示是Lian等人[94]提出并搭建了一整套包括扫描系统、打印系统和计算机控制系统的扫描打印复合原位打印系统。
Binder等人[95]开发出一台基于喷墨打印原理的微阀喷头原位打印设备,利用激光扫描设备对伤口进行建模,多个微阀喷头在伤口处1滴/mm打印混有成纤维细胞和角质细胞的纤维蛋白和胶原蛋白混合生物墨水,是最早进行原位打印的研究,为组织工程皮肤的快速定制化制造指明了方向。为了能够在战场等恶劣环境下对大面积创伤进行快速闭合,Hakimi等人[96]提出了一种手持式皮肤打印机,并采用并行式多轴喷头结构,可以直接在皮肤缺损创面,原位形成具有不同结构成分的皮肤组织薄片,模拟人体皮肤结构。Cheng等人[97]在之前的基础上开展了原位打印修复猪皮肤缺损的研究,直接在全层皮肤缺损的猪背部打印含有间充质干细胞的纤维蛋白凝胶,与对照组相对比,该方法改善了上皮再生效果、真皮细胞的再生和心血管的形成。

图3 扫描打印复合原位打印系统
作为一种新兴的外科修复重建方法,它与传统生物3D打印技术的区别在于:传统生物3D打印技术往往需要在体外进行打印或培养一段时间,然后再植入人体得以应用,而且使用传统生物3D打印技术在对组织或器官缺损进行修复时,由于缺损组织的形态具有不确定性,在术前很难对植入物进行精确的设计与制造。原位打印技术则是定制化、形态适配化的一种组织缺损修复方法。
3.6 无创体内打印
近红外荧光(NIR)具有极低的背景自荧光、减少光散射和低组织吸收,是一种安全、经济、高分辨率、高灵敏度的光学成像光源[98]。Park等人[99]提出了一种双通道近红外荧光成像技术,可同时监测脑组织向内生长和水凝胶降解。
基于近红外荧光的这些应用特点,Gou等人[100]提出了一种基于数字近红外光聚合(DNP)的3D打印技术,该技术可实现组织构建体的非侵入性体内生物3D打印,如图4所示是该生物3D打印技术的示意图。在这项技术中,NIR通过双色微镜装置调制成定制的图案,并动态投影引发单体溶液的聚合。通过用图案化的NIR进行照射,可以将皮下注射的生物墨水非侵入性地原位打印到特定的组织结构中,无需手术植入,就可以在体内获得充满细胞的支架。他们在小鼠体内切除了肌肉组织,然后通过该技术无创打印在有脂肪干细胞的支架,实验证明实验组的肌肉缺损愈合速度明显高于对照组。
在前面提到的生物3D打印技术中,都仅限于在暴露的创伤处进行外科手术植入,而这种无创体内生物3D打印将推动微创和无创医学的发展。
以上,对各类生物3D打印技术的原理及特点做了介绍和对比,表4对各类打印技术的最新研究进展和成果进行了总结。在皮肤修复生物3D打印过程中,除了关注生物材料的打印效果外,不仅要使打印的皮肤具有与天然皮肤相似的分层结构,还要构建例如乳头状等微结构,并着力于各种皮肤细胞在人造的ECM中的表达及信号通路的建立。这就要求在充分了解各打印技术的特点后,能方便灵活地结合运用各打印技术制造出更为相似的皮肤模型。

图4 基于DNP-无创3D生物打印示意图[100]
表4 用于皮肤修复的主要生物3D打印技术及其用于皮肤修复的特点
Table 4 The main 3D bioprinting technology for skin repair and its characteristics

续表4
续表4
目前的生物3D打印技术,虽然也涉及到了如乳头状等微观结构的制造,但是对于复杂的皮肤结构如毛囊等皮肤附着物的制造还十分困难,将先进的微纳制造技术应用于皮肤打印可以提高如色素和毛囊的精确均匀沉着和打印效率,自然重现精度更高的多层组织皮肤;原位打印和无创体内打印具有其他生物3D打印技术没有的特点,具有很大的发展潜力,但是原位打印需要更灵巧和方便的设备,以满足身体特殊部位创口的快速闭合。为了减小原位打印中呼吸幅度对扫描精度和打印的形状精度的影响,以及便于无创体内打印后,能够实时监测组织的愈合情况,可以通过更精密、更快速的实时反馈系统来获得更精确的扫描数据,并在打印过程中实时监测患者的生理情况,随时优化打印路径。
4 生物3D打印对光电技术的需求
在生物3D打印的过程中,不仅涉及了生物学、材料学、细胞学、机械工程、软件编程等领域的知识,而且也涉及光电工程领域的相关技术。利用先进的光电工程技术作为生物3D打印的辅助技术,可以提高打印的皮肤精度,与创口的适配程度和皮肤愈合与组织再生的效果。接下来本文将结合生物3D打印所面临的困难,提出对光电技术的需求。
在生物3D打印过程中,通过主动三角法等光学测量技术,高分辨率3D扫描创口的形状、深度等信息,迅速重建创口的STL文件,缩短打印准备时间;压电和激光脉冲技术可以用在喷嘴中获得细胞分布更均匀的微滴和更适合喷墨打印的微滴直径,在避免喷嘴堵塞的同时,打印更加细微和更加完善的复杂皮肤组织结构;数字掩模投影技术利用数字微镜控制掩模打印光敏材料,获得高分辨率的定制化图案;激光诱导正向转移技术通过调整脉冲激光束的能量、光斑大小和持续时间使激光能量吸收层上覆盖上含有细胞的生物墨水;近红外荧光技术被用来实时监测打印过程,以便实时同步调整规划打印路径,可获得与缺损皮肤适配度更高的皮肤。
4.1 光电测量技术
为了实现损伤的快速修复,简化手术过程,减少病人痛苦,提高损伤恢复速度,原位3D打印被提了出来,因此,对缺损部位的形状和特征进行扫描重建,是原位打印皮肤创伤修复的第一步。
目前的扫描测量技术主要有接触式和非接触式两种,非接触式的扫描测量技术包括被动式(如立体视觉)和主动式。主动式通常将可见光、红外线等投射到待测创口,创口会对接收到的信息进行调制并反射,接收到的反射光经过解调后即可得到创口三维信息[105]。Li等人[82]采用三角法数学原理获得创口三维信息,采用形状拟合和颜色识别相结合的方法提取缺损的皮肤形状;为了简化生物3D打印制造的复杂系统,Li等人[106]选取手持式高分辨率3D扫描而不是CT扫描和MRI来创建用于路径规划的最终STL文件,此扫描方式具有便携性、方便快捷的操作等优点。
皮肤生物3D打印制造过程中,为减轻病人痛苦并降低治疗伤害,需要对缺损皮肤形状、深度和结构进行快速扫描,以提取伤口形状用于打印方式和路径的规划,因此利用先进的光电工程技术,对皮肤缺陷进行快速且准确的提取是生物3D打印中重要的一个环节。目前,大多数的皮肤修复,仅限于对皮肤层结构的真表皮层组织修复,但是对于深入肌肉层损伤的大面积修复研究很少,其原因是对于较深层的创伤(特别是大量出血的损伤),并不能精确采集到完整的创口信息。所以,高精度的测量技术必将激发原位打印技术的更深层应用。
4.2 压电和激光驱动技术
人皮肤在真皮和表皮的交界处就具有乳头状微结构,该解剖特征提供了更大的表面积,有助于充足的营养供应以及真皮和表皮之间的固定[68]。所以在3D打印结构中增加复杂的微米尺度结构也是皮肤生物3D打印的挑战之一[107]。而压电和激光等光电技术被用在高精度喷嘴的设计中,可以获得高分辨率微滴、微丝等,为精细复杂结构的打印提供了可能。
利用压电和激光脉冲技术的喷墨打印可以沉积更高通量的细胞悬液,并产生适合打印的微滴。浙江大学[85]通过使用具有80 μm孔的压电打印头产生微滴,将Na-Alg溶液保存安装在升降台上的300 mL的料筒中,然后通过压力控制系统将溶液转移到喷嘴。该打印机通过压力调节器粗调储层的负压,并使用升降平台精确调节适当液位,改变微滴的速度获得合适的微滴直径用于打印。Delrot等人[108]研究了喷墨打印和微滴大小对激光脉冲能量和墨水物理性能的依赖性,得到了通过激光诱导的冲击波来打印粘性微滴的喷射方法,在室温下使用10倍显微镜在充液玻璃微柱上聚焦5 ns激光脉冲形成微滴,在激光驱动下能够按需产生粘性微滴,提高打印精度。
目前的喷墨打印技术中,喷嘴堵塞是最常见的问题,它限制了均匀结构的形成,使微薄的打印层存在较大缺陷。所以,如何通过光电技术解决当前的问题,控制打印出不同结构图案的微观结构,是生物打印的需求。
4.3 数字掩模投影技术
在生物3D打印技术中,喷嘴堵塞是喷墨打印和挤出打印的挑战之一,而无喷嘴打印正是解决这个问题的一个方法,基于投影的数字光处理技术被用生物3D打印中,可以实现高速度和高分辨率打印。
在基于数字掩模投影技术中,数字微镜设备(DMD)芯片通过数百万个可单独控制的反射微镜阵列显示掩模,从而可以以像素为单位对在像素上的整个2D平面的光进行构图。将此投影与光敏生物材料结合使用,可以轻松地对复杂的3D结构进行光聚合打印。打印速度和分辨率主要取决于DMD芯片中的光敏材料特性和投影像素大小,可以通过光引发剂和光学系统进行修改。Xue等人[109]实现了使用生物相容性的聚乙二醇二丙烯酸酯,通过数字掩模和单个曝光步骤打印,来快速且高分辨率地制造具有复杂通道且可用于多细胞图案化的各种结构水凝胶支架。
理想的光固化打印可以有效地控制调节材料的力学性能和降解度,生物相容性更好,并可按需增强打印结构的弹性和延长储存时间;而目前采用的光固化打印,低粘度的材料不容易成型,光的强度和光照时间不容易精确控制,这使得打印结构的机械性能难以控制,难以形成精细的复杂结构。所以,通过对数字掩模投影的精确控制将会进一步提高光固化打印的实际应用。
4.4 激光正向诱导转移技术
激光正向诱导转移技术是激光辅助生物3D打印最常应用的技术之一,它的应用同样实现了将含有细胞的生物墨水的无接触无喷嘴打印。
Kattamis等人[110]提出了一种基于聚酰亚胺吸收层的激光正向转移方法,用厚度大于激光吸收长度的薄膜,可以识别出两种聚合物对激光辐照的响应方式,分别对应于薄膜的塑性变形和破裂;Guillotin等人[111]研究了生物墨水的粘度、激光能量和激光打印速度对细胞打印分辨率的影响,发现可通过调节激光功率或光圈孔径来调制激光能量以微米级的分辨率沉积细胞。
目前我国对激光辅助生物打印的研究还正处于起步阶段,在这个领域的研究十分有限。其原因除了在设备的搭建和使用过程中的高成本因素,还在于现有的高稳定性能的激光器并不能为生物3D打印提供稳定的射流和较小的能量波动,不仅会降低打印分辨率,更会大幅度降低细胞的存活率。
4.5 实时监测技术
实际上,在打印皮肤的过程是一个动态变化的过程,即由于呼吸或抽动动作引起的表面移动,使得之前扫描、定位的理论打印位置与形状和实际的打印数据有误差。
为了解决这个问题,Zhu等人[112]首先通过结构化光扫描仪以密集点云的形式获取创口的信息,然后将采样的信息与创口表面的刚体运动实时监控结合起来,并总体上反馈给运动控制器进行自适应3D打印。在打印过程中,首先将诸如表面安装的LED之类的分立电子组件自动拾取并放置在目标表面上。功能性油墨(例如导电性油墨和绝缘体油墨)被直接打印到目标表面上,以产生电子电路,可以实时校正由动态打印表面引起的打印误差。Suh等人使用近红外成像对3D打印植入物中的近红外荧光共轭支架进行准确的体内评估,可以根据预期的降解率无创地监测支架可降解的行为,而且还可以在同一3D打印植入物下实现了对支架和移植干细胞的同步监控[113]。
随着5G技术的发展和应用,更高精度和更快速反馈的实时监测技术必将会有所提高。在实际的动物实验过程中,对动物的较大范围的呼吸频率和抽动引起的扫描、定位精度较低等问题也会迎刃而解。
5 总 结
本文列举了用于皮肤生物3D打印的生物材料墨水和细胞,总结了6种生物3D打印技术的应用和优缺点,并结合了目前生物3D打印所面临的困难,提出了光电技术在生物3D打印技术中的应用需求,得出了以下结论:
1) 用于皮肤修复的生物3D打印技术主要有喷墨打印、光固化打印、激光辅助打印、挤出打印、原位打印和无创体内打印,而目前应用单一的打印技术难以解决皮肤创伤修复所面临的问题,所以发展多工艺、多材料和多细胞的复合打印是未来的发展趋势;
2) 光电技术对生物3D打印技术在医疗卫生领域的落地和发展具有重要且深远的意义:研究并应用三角法等光电技术可以实现快速精确的扫描测量技术,缩短打印的准备时间,减轻病人痛苦;压电和激光等光电技术的研究应用可以获得高分辨率的微滴和微丝应用于喷墨打印和挤出打印的高精细复杂结构制造,也可以实现无喷嘴无接触的光固化打印和激光辅助打印,减少对细胞的伤害;红外荧光等技术的应用能在获得更精确的数据的同时,也能与打印过程实时结合,以便能够根据临床实际打印定制程度更高的皮肤。
尽管生物3D打印仍然面临许多的困难和挑战,但是随着制造技术和光电技术的更新,以及医学和生物学的发展,生物3D打印必将为皮肤修复和再生带来巨大潜力。
[1] Groeber F, Holeiter M, Hampel M,. Skin tissue engineering—andapplications[J]., 2011, 63(4–5): 352–366.
[2] Vijayavenkataraman S, Lu W F, Fuh J Y H. 3D bioprinting of skin: a state-of-the-art review on modelling, materials, and processes[J]., 2016, 8(3): 032001.
[3] Peck M D. Epidemiology of burns throughout the World. Part II: intentional burns in adults[J]., 2012, 38(5): 630–637.
[4] Beheshtizadeh N, Lotfibakhshaiesh N, Pazhouhnia Z,. A review of 3D bio-printing for bone and skin tissue engineering: a commercial approach[J]., 2019, 55(9): 3729–3749.
[5] Derakhshanfar S, Mbeleck R, Xu K G,. 3D bioprinting for biomedical devices and tissue engineering: a review of recent trends and advances[J]., 2018, 3(2): 144–156.
[6] Tan S H, Ngo Z H, Leavesley D,. Recent advances in the design of three-dimensional and bioprinted scaffolds for full-thickness wound healing[J].:, 2021, doi: 10.1089/ten.TEB.2020.0339.
[7] Ozbolat I T. Bioprinting scale-up tissue and organ constructs for transplantation[J]., 2015, 33(7): 395–400.
[8] Chouhan D, Dey N, Bhardwaj N,. Emerging and innovative approaches for wound healing and skin regeneration: current status and advances[J]., 2019, 216: 119267.
[9] Clark R A F, Ghosh K, Tonnesen M G. Tissue engineering for cutaneous wounds[J]., 2007, 127(5): 1018–1029.
[10] Rodrigues M, Kosaric N, Bonham C A,. Wound healing: a cellular perspective[J]., 2019, 99(1): 665–706.
[11] Yannas I V, Tzeranis D, So P T. Surface biology of collagen scaffold explains blocking of wound contraction and regeneration of skin and peripheral nerves[J]., 2015, 11(1): 014106.
[12] Bhardwaj N, Chouhan D, Mandal B B. Tissue engineered skin and wound healing: current strategies and future directions[J]., 2017, 23(24): 3455–3482.
[13] Liu T, Qiu C, Ben C,. One-step approach for full-thickness skin defect reconstruction in rats using minced split-thickness skin grafts with Pelnac overlay[J]., 2019, 7: 19.
[14] Haflah N H M, Ng M H, Yunus M H M,. Massive traumatic skin defect successfully treated with autologous, bilayered, tissue-engineered MyDerm skin substitute: a case report[J]., 2018, 8(2): e38.
[15] Kirchmajer D M, Gorkin III R, in het Panhuis M. An overview of the suitability of hydrogel-forming polymers for extrusion-based 3D-printing[J]., 2015, 3(20): 4105–4117.
[16] Parak A, Pradeep P, du Toit L C,. Functionalizing bioinks for 3D bioprinting applications[J]., 2019, 24(1): 198–205.
[17] Agrawal P, Soni S, Mittal G,. Role of polymeric biomaterials as wound healing agents[J]., 2014, 13(3): 180–190.
[18] Gunatillake P A, Adhikari R. Biodegradable synthetic polymers for tissue engineering[J]., 2003, 5: 1–16.
[19] Gugerell A, Pasteiner W, Nürnberger S,. Thrombin as important factor for cutaneous wound healing: comparison of fibrin biomatrices in vitro and in a rat excisional wound healing model[J]., 2014, 22(6): 740–748.
[20] Currie L J, Martin R, Sharpe J R,. A comparison of keratinocyte cell sprays with and without fibrin glue[J]., 2003, 29(7): 677–685.
[21] Cubo N, Garcia M, del Cañizo J F,. 3D bioprinting of functional human skin: production andanalysis[J]., 2017, 9(1): 015006.
[22] Donderwinkel I, van Hest J C M, Cameron N R. Bio-inks for 3D bioprinting: recent advances and future prospects[J]., 2017, 8(31): 4451–4471.
[23] Thiele J, Ma Y J, Bruekers S M C,. 25th anniversary article: designer hydrogels for cell cultures: a materials selection guide[J]., 2014, 26(1): 125–148.
[24] Kim Y B, Lee H, Kim G H. Strategy to achieve highly porous/biocompatible macroscale cell blocks, using a collagen/genipin-bioink and an optimal 3D printing process[J]., 2016, 8(47): 32230–32240.
[25] Lee J W, Choi Y J, Yong W J,. Development of a 3D cell printed construct considering angiogenesis for liver tissue engineering[J]., 2016, 8(1): 015007.
[26] Norouzi M, Boroujeni S M, Omidvarkordshouli N,. Advances in skin regeneration: application of electrospun scaffolds[J]., 2015, 4(8): 1114–1133.
[27] Liu P C, Shen H Z, Zhi Y,. 3D bioprinting and in vitro study of bilayered membranous construct with human cells-laden alginate/gelatin composite hydrogels[J].:, 2019, 181: 1026–1034.
[28] Del Amo C, Perez-Valle A, Perez-Zabala E,. Wound dressing selection is critical to enhance platelet-rich fibrin activities in wound care[J]., 2020, 21(2): 624.
[29] Bociaga D, Bartniak M, Grabarczyk J,. Sodium alginate/gelatine hydrogels for direct bioprinting-the effect of composition selection and applied solvents on the bioink properties[J]., 2019, 12(17): 2669.
[30] Wang J, Shang P J, Shi W B,. Dissimilarity measure based on ordinal pattern for physiological signals[J]., 2016, 37: 115–124.
[31] Pisani S, Dorati R, Scocozza F,. Preliminary investigation on a new natural based poly(gamma-glutamic acid)/Chitosan bioink[J].:, 2020, 108(7): 2718–2732.
[32] Li Y, Jiang X L, Li L,. 3D printing human induced pluripotent stem cells with novel hydroxypropyl chitin bioink: scalable expansion and uniform aggregation[J]., 2018, 10(4): 044101.
[33] Dzobo K, Motaung K S C M, Adesida A. Recent trends in decellularized extracellular matrix bioinks for 3D printing: an updated review[J]., 2019, 20(18): 4628.
[34] Kim B S, Kwon Y W, Kong J S,. 3D cell printing ofstabilized skin model andpre-vascularized skin patch using tissue-specific extracellular matrix bioink: a step towards advanced skin tissue engineering[J]., 2018, 168: 38–53.
[35] Lee S J, Lee J H, Park J,. Fabrication of 3D printing scaffold with porcine skin decellularized bio-ink for soft tissue engineering[J]., 2020, 13(16): 3522.
[36] Wu X, Liu Z X, Lin H H,. Properties of gelatin methacryloyl and its application in the skin tissue engineering[J]., 2018, 22(2): 323–328. 吴兴, 刘肇兴, 林欢欢, 等. 甲基丙烯酸酐明胶材料学特性及在皮肤组织工程应用与进展[J]. 中国组织工程研究, 2018, 22(2): 323–328.
[37] Zhao X, Lang Q, Yildirimer L,. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering[J]., 2016, 5(1): 108–118.
[38] Klotz B J, Gawlitta D, Rosenberg A J W P,. Gelatin-methacryloyl hydrogels: towards biofabrication-based tissue repair[J]., 2016, 34(5): 394–407.
[39] Bianco P, Robey P G. Stem cells in tissue engineering[J]., 2001, 414(6859): 118–121.
[40] Boyce S T, Medrano E E, Abdel-Malek Z,. Pigmentation and inhibition of wound contraction by cultured skin substitutes with adult melanocytes after transplantation to athymic mice[J]., 1993, 100(4): 360–365.
[41] Duncan C O, Shelton R M, Navsaria H,.transfer of keratinocytes: comparison of transfer from fibrin membrane and delivery by aerosol spray[J].:, 2005, 73B(2): 221–228.
[42] Sumorejo P, Listiawan M Y, Putri A I,. The role of stem cell metabolites derived from placenta for skin regeneration: an in vitro study[J]., 2019, 8(1): 354–359.
[43] Mahmood R, Mehmood A, Choudhery M S,. Human neonatal stem cell-derived skin substitute improves healing of severe burn wounds in a rat model[J]., 2019, 43(2): 147–157.
[44] Metcalfe A D, Ferguson M W J. Skin stem and progenitor cells: using regeneration as a tissue-engineering strategy[J]., 2008, 65(1): 24–32.
[45] Lee W, Debasitis J C, Lee V K,. Multi-layered culture of human skin fibroblasts and keratinocytes through three-dimensional freeform fabrication[J]., 2009, 30(8): 1587–1595.
[46] Kim B S, Lee J S, Gao G,. Direct 3D cell-printing of human skin with functional transwell system[J]., 2017, 9(2): 025034.
[47] Nolte S V, Xu W, Rennekampff H O,. Diversity of fibroblasts-a review on implications for skin tissue engineering[J]., 2008, 187(3): 165–176.
[48] Won J Y, Lee M H, Kim M J,. A potential dermal substitute using decellularized dermis extracellular matrix derived bio-ink[J].,,, 2019, 47(1): 644–649.
[49] Shi L, Xiong L M, Hu Y Q,. Three-dimensional printing alginate/gelatin scaffolds as dermal substitutes for skin tissue engineering[J]., 2018, 58(10): 1782–1790.
[50] Baltazar T, Merola J, Catarino C,. Three dimensional bioprinting of a vascularized and perfusable skin graft using human keratinocytes, fibroblasts, pericytes, and endothelial cells[J]., 2020, 26(5–6): 227-238.
[51] Huyan Y G, Lian Q, Zhao T Z,. Pilot study of the biological properties and vascularization of 3D printed bilayer skin grafts[J]., 2020, 6(1): 246.
[52] Ng W L, Qi J T Z, Yeong W Y,. Proof-of-concept: 3D bioprinting of pigmented human skin constructs[J]., 2018, 10(2): 025005.
[53] Min D, Lee W, Bae I H,. Bioprinting of biomimetic skin containing melanocytes[J]., 2018, 27(5): 453–459.
[54] Dominici M, Le Blanc K, Mueller I,. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]., 2006, 8(4): 315–317.
[55] Kim H J, Park J S. Usage of human mesenchymal stem cells in cell-based therapy: advantages and disadvantages[J]., 2017, 21(1): 1–10.
[56] Kokubun K, Pankajakshan D, Kim M J,. Differentiation of porcine mesenchymal stem cells into epithelial cells as a potential therapeutic application to facilitate epithelial regeneration[J]., 2016, 10(2): E73–E83.
[57] Strong A L, Neumeister M W, Levi B. Stem cells and tissue engineering: regeneration of the skin and its contents[J]., 2017, 44(3): 635–650.
[58] Sasaki M, Abe R, Fujita Y,. Mesenchymal stem cells are recruited into wounded skin and contribute to wound repair by transdifferentiation into multiple skin cell type[J]., 2008, 180(4): 2581–2587.
[59] Wu Y J, Chen L W, Scott P G,. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J]., 2007, 25(10): 2648–2659.
[60] Xiong J C, Ji B Y, Wang L J,. Human adipose-derived stem cells promote seawater-immersed wound healing by activating skin stem cells via the EGFR/MEK/ERK pathway[J]., 2019, 2019: 7135974.
[61] Visscher D O, Farré-Guasch E, Helder M N,. Advances in bioprinting technologies for craniofacial reconstruction[J]., 2016, 34(9): 700–710.
[62] Murphy S V, Atala A. 3D bioprinting of tissues and organs[J]., 2014, 32(8): 773–785.
[63] Xu T, Jin J, Gregory C,. Inkjet printing of viable mammalian cells[J]., 2005, 26(1): 93–99.
[64] Park J A, Yoon S, Kwon J,. Freeform micropatterning of living cells into cell culture medium using direct inkjet printing[J]., 2017, 7(1): 14610.
[65] Yoon S, Park J A, Lee H R,. Inkjet-spray hybrid printing for 3D freeform fabrication of multilayered hydrogel structures[J]., 2018, 7(14): 1800050.
[66] Xu C X, Zhang M, Huang Y,. Study of droplet formation process during drop-on-demand inkjetting of living cell-laden bioink[J]., 2014, 30(30): 9130–9138.
[67] Negro A, Cherbuin T, Lutolf M P. 3D inkjet printing of complex, cell-laden hydrogel structures[J]., 2018, 8(1): 17099.
[68] Park J A, Lee H R, Park S Y,. Self-organization of fibroblast-laden 3D collagen microstructures from inkjet-printed cell patterns[J]., 2020, 4(5): 1900280.
[69] Kim B S, Gao G, Kim J Y,. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin[J]., 2019, 8(7): 1801019.
[70] Lim K S, Levato R, Costa P F,. Bio-resin for high resolution lithography-based biofabrication of complex cell-laden constructs[J]., 2018, 10(3): 034101.
[71] Zhang A P, Qu X, Soman P,. Rapid fabrication of complex 3D extracellular microenvironments by dynamic optical projection stereolithography[J]., 2012, 24(31): 4266–4270.
[72] Ma X Y, Qu X, Zhu W,. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting[J]., 2016, 113(8): 2206–2211.
[73] Zhu W, Qu X, Zhu J,. Direct 3D bioprinting of prevascularized tissue constructs with complex microarchitecture[J]., 2017, 124: 106–115.
[74] Zhou F F, Hong Y, Liang R J,. Rapid printing of bio-inspired 3D tissue constructs for skin regeneration[J]., 2020, 258: 120287.
[75] Hribar K C, Soman P, Warner J,. Light-assisted direct-write of 3D functional biomaterials[J]., 2014, 14(2): 268–275.
[76] Yan W C, Davoodi P, Vijayavenkataraman S,. 3D bioprinting of skin tissue: from pre-processing to final product evaluation[J]., 2018, 132: 270–295.
[77] Koch L, Kuhn S, Sorg H,. Laser printing of skin cells and human stem cells[J].:, 2010, 16(5): 847–854.
[78] Koch L, Deiwick A, Schlie S,. Skin tissue generation by laser cell printing[J]., 2012, 109(7): 1855–1863.
[79] Wang R, Wang Y H, Yao B,. Beyond 2D: 3D bioprinting for skin regeneration[J]., 2019, 16(1): 134–138.
[80] Mandrycky C, Wang Z J, Kim K,. 3D bioprinting for engineering complex tissues[J]., 2016, 34(4): 422–434.
[81] Di Bella C, Duchi S, O'connell C D,.handheld three-dimensional bioprinting for cartilage regeneration[J]., 2018, 12(3): 611–621.
[82] Li X, Lian Q, Li D C,. Development of a robotic arm based hydrogel additive manufacturing system for in-situ printing[J]., 2017, 7(1): 73.
[83] Lee J, Kim K E, Bang S,. A desktop multi-material 3D bio-printing system with open-source hardware and software[J]., 2017, 18(4): 605–612.
[84] Masaeli E, Forster V, Picaud S,. Tissue engineering of retina through high resolution 3-dimentional inkjet bioprinting[J]., 2020, 12(2): 025006.
[85] Gao Q, He Y, Fu J Z,. Fabrication of shape controllable alginate microparticles based on drop-on-demand jetting[J]., 2016, 77(3): 610–619.
[86] Kumar H, Kim K.Stereolithography 3D Bioprinting[J].,2020, 2140: 93–108.
[87] Warner J, Soman P, Zhu W,. Design and 3D printing of hydrogel scaffolds with fractal geometries[J]., 2016, 2(10): 1763–1770.
[88] Michael S, Sorg H, Peck C T,. Tissue engineered skin substitutes created by laser-assisted bioprinting form skin-like structures in the dorsal skin fold chamber in mice[J]., 2013, 8(3): e57741.
[89] Gauvin R, Chen Y C, Lee J W,. Microfabrication of complex porous tissue engineering scaffolds using 3D projection stereolithography[J]., 2012, 33(15): 3824–3834.
[90] Gou M L, Qu X, Zhu W,. Bio-inspired detoxification using 3D-printed hydrogel nanocomposites[J]., 2014, 5: 3774.
[91] Li J B, Han Y, Zhu J H. Influence equilibrium problem research based on common interests in mobile social network[C]//, 2016: 271–278.
[92] Schiele N R, Corr D T, Huang Y,. Laser-based direct-write techniques for cell printing[J]., 2010, 2(3): 032001.
[93] Liu X, Michael S, Bharti K,. A biofabricated vascularized skin model of atopic dermatitis for preclinical studies[J]., 2020, 12(3): 035002.
[94] Lian Q, Li X, Li D C,. Path planning method based on discontinuous grid partition algorithm of point cloud forprinting[J]., 2019, 25(3): 602–613.
[95] Binder K W. In situ bioprintingi of the skin[D]. Winston-Salem: Wake Forest School, 2011: 1–443.
[96] Hakimi N, Cheng R, Leng L,. Handheld skin printer:formation of planar biomaterials and tissues[J]., 2018, 18(10): 1440–1451.
[97] Cheng R Y, Eylert G, Gariepy J M,. Handheld instrument for wound-conformal delivery of skin precursor sheets improves healing in full-thickness burns[J]., 2020, 12(2): 025002.
[98] Choi H S, Gibbs S L, Lee J H,. Targeted zwitterionic near-infrared fluorophores for improved optical imaging[J]., 2013, 31(2): 148–153.
[99] Park G K, Kim S H, Kim K,. Dual-channel fluorescence imaging of hydrogel degradation and tissue regeneration in the brain[J]., 2019, 9(15): 4255–4264.
[100] Chen Y W, Zhang J M, Liu X,. Noninvasive in vivo 3D bioprinting[J]., 2020, 6(23): eaba7406.
[101] Liu W J, Zhang Y S, Heinrich M A,. Rapid continuous multimaterial extrusion bioprinting[J]., 2017, 29(3): 1604630.
[102] Pi Q M, Maharjan S, Yan X,. Digitally tunable microfluidic bioprinting of multilayered cannular tissues[J]., 2018, 30(43): 1706913.
[103] Keriquel V, Guillemot F, Arnault I,.bioprinting for computer- and robotic-assisted medical intervention: preliminary study in mice[J]., 2010, 2(1): 014101.
[104] Albanna M, Binder K W, Murphy S V,.bioprinting of autologous skin cells accelerates wound healing of extensive excisional full-thickness wounds[J]., 2019, 9(1): 1856.
[105] Chen K Y, Xie X Q, Ye P Q. Design on on-line laser measurement system for vane of aero-engine compressor[J]., 2004(8): 53–56. 陈凯云, 谢晓芹, 叶佩青. 航空压气机叶片型面在线激光测量系统设计[J]. 制造技术与机床, 2004(8): 53–56.
[106] Li L, Yu F, Shi J P,.repair of bone and cartilage defects using 3D scanning and 3D printing[J]., 2017, 7(1): 9416.
[107] Atala A, Kasper F K, Mikos A G. Engineering complex tissues[J]., 2012, 4(160): 160rv12.
[108] Delrot P, Modestino M A, Gallaire F,. Inkjet printing of viscous monodisperse microdroplets by laser-induced flow focusing[J]., 2016, 6(2): 024003.
[109] Xue D, Wang Y C, Zhang J X,. Projection-based 3D printing of cell patterning scaffolds with multiscale channels[J]., 2018, 10(23): 19428–19435.
[110] Kattamis N T, Purnick P E, Weiss R,. Thick film laser induced forward transfer for deposition of thermally and mechanically sensitive materials[J]., 2007, 91(17): 171120.
[111] Guillotin B, Souquet A, Catros S,. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization[J]., 2010, 31(28): 7250–7256.
[112] Zhu Z J, Guo S Z, Hirdler T,. 3D printed functional and biological materials on moving freeform surfaces[J]., 2018, 30(23): 1707495.
[113] Suh Y J, Lim T H, Choi H S,. 3D printing and NIR fluorescence imaging techniques for the fabrication of implants[J]., 2020, 13(21): 4819.
The research progress and challenge of 3D bioprinting for skin repairing
Lian Weilong1,2,3, Lian Qin1,2,3*, Jiao Tian1,2,3, He Xiaoning4,Zhao Ming5, Hu Dahai5, Wan Min6
1State Key Laboratory for Manufacturing System Engineering, School of Mechanical Engineering, Xi’an Jiaotong University, Xi’an, Shaanxi 710054, China;2Jihua Laboratory, Foshan, Guangdong 528200, China;3NMPA Key Laboratory for Research and Evaluation of Additive Manufacturing Medical Devices, Xi’an, Shaanxi 710054, China;4Xidian University, Xi’an, Shaanxi 710049, China;5Department of Burns and Cutaneous Surgery, Xijing Hospital, Air Force Medical University, Xi’an, Shaanxi 710032, China;6Shandong Quality Inspection Center for Medical Devices, NMPA Key Laboratory for Quality Evaluation of Medical and Health Materials and Biological Protective Devices, Jinan, Shandong 250101, China

Main process methods of 3D bioprinting for skin application. (a) Inkjet; (b) Stereolithography; (c) Laser assisted; (d) Extrusion
Overview:The skin is the first line of defense against external stimuli. Therefore, the skin is most vulnerable to injury, and serious skin injury may be life-threatening, so repairing damaged skin is of great significance. Because 3D bioprinting is able to accurately place a variety of different types of cells, even stem cells and appendages, and can repeatably create skin substitutes to replace the injured or damaged parts of the skin, making it similar to the skin appearance and function, 3D bioprinting makes up for the shortcomings of conventional skin wound repairing treatment, and is currently one of the most likely manufacturing methods to develop skin substitutes.
In order to improve the accuracy of printed skin, the degree of adaptation to the wound, and the effect of skin wound repairing, more and more opto-electronic technologies have been applied in 3D bioprinting. Piezoelectric and laser pulse technology can be used in the nozzle to obtain droplets with more uniform cell distribution and droplet diameters that are more suitable for inkjet printing. Digital mask projection technology uses digital micromirror to control the mask to print photosensitive materials to obtain high-resolution customized patterns. Laser-induced forward transfer technology adjusts the energy, spot size, and duration of the pulsed laser beam to cover the laser energy absorbing layer with bioink containing cells. Near-infrared fluorescence technology is used to monitor the printing process in real time, so as to adjust and plan the printing path in real time and obtain the skin with higher degree of compatibility with the defective skin.
In this article, firstly, the skin tissue structures and the principles of skin wound repairing are described. Secondly, the bioinks, cells and main 3D bioprinting technologies used in skin wound repairing are compared. Then, the opto-electronic technologies involved are analyzed. Finally, the application requirements of opto-electronic technology in 3D bioprinting are proposed.
Lian W L, Lian Q, Jiao T,The research progress and challenge of 3D bioprinting for skin repairing[J]., 2021, 48(8): 210105; DOI:10.12086/oee.2021.210105
The research progress and challenge of 3D bioprinting for skin repairing
Lian Weilong1,2,3, Lian Qin1,2,3*, Jiao Tian1,2,3, He Xiaoning4, Zhao Ming5,Hu Dahai5, Wan Min6
1State Key Laboratory for Manufacturing System Engineering, School of Mechanical Engineering, Xi’an Jiaotong University, Xi’an, Shaanxi 710054, China;2Jihua Laboratory, Foshan, Guangdong 528200, China;3NMPA Key Laboratory for Research and Evaluation of Additive Manufacturing Medical Devices, Xi’an, Shaanxi 710054, China;4Xidian University, Xi’an, Shaanxi 710049, China;5Department of Burns and Cutaneous Surgery, Xijing Hospital, Air Force Medical University, Xi’an, Shaanxi 710032, China;6Shandong Quality Inspection Center for Medical Devices, NMPA Key Laboratory for Quality Evaluation of Medical and Health Materials and Biological Protective Devices, Jinan, Shandong 250101, China
The skin is the largest organ of the human body, which plays an important role in barrier function, immune response, preventing water loss and excreting waste. Patients with large-scale severe skin injuries will die due to lack of adequate skin grafts. The development of 3D bioprinting technology provides a solution for the manufacture of transplantable skin. Firstly, the principles of skin wound repairing are described. Secondly, the bioinks, cells and main 3D bioprinting technologies used in skin wound repairing are compared. Then, the opto-electronic technologies involved are analyzed, and the challenges and future development of 3D bioprinting in the application of skin repair are summarized. Finally, the application requirements of opto-electronic technology in 3D bioprinting are proposed.
3D bioprinting; skin; bioink; cell; opto-electronic technology
Additive Manufacturing Special Project of Ministry of Industry and Information Technology (2018YFE0207900), Science and Technology Projects of PLA (BWS17J036), Key Project of Ji Hua Laboratory (X200031TM200), and National Natural Science Found of China (51835010, 51375371)
TP391.7;R318.08
A
* E-mail: lqiamt@mail.xjtu.edu.cn
连伟龙,连芩,焦天,等. 皮肤修复生物3D打印的研究进展与挑战[J]. 光电工程,2021,48(8): 210105
Lian W L, Lian Q, Jiao T,The research progress and challenge of 3D bioprinting for skin repairing[J]., 2021, 48(8): 210105
10.12086/oee.2021.210105
2021-04-07;
2021-06-13基金项目:工信部增材制造专项(2018YFE0207900);中国人民解放军科技计划(BWS17J036);季华实验室建设项目(X200031TM200);国家自然科学基金项目(51835010,51375371)
连伟龙(1996-),男,硕士研究生,主要从事生物3D打印方面的研究。E-mail:773274210@qq.com
连芩(1972-),女,教授,博士生导师,主要从事增材制造和生物制造的研究。E-mail:lqiamt@mail.xjtu.edu.cn
版权所有©2021中国科学院光电技术研究所

