纺织品中白假丝酵母菌快速鉴定方法的研究
李 轲 禹建鹰 李传民 傅科杰 郭会清
(1.郑州海关,河南郑州,450003;2.河南捷信检测认证有限公司,河南郑州,450003;3.宁波检验检疫科学技术研究院,浙江宁波,315000)
白假丝酵母菌是最常见的致病性假丝酵母菌,是一类致病性、侵袭性强的深部感染真菌[1]。临床研究中,白假丝酵母菌感染会引起人体皮肤、黏膜及内脏的急、慢性炎症等[2⁃3],且病死率高[4⁃7]。笔者团队通过对纺织品生物安全的多年跟踪研究,认为白假丝酵母菌是纺织品污染重点关注对象[8]。前期研究中,根据白假丝酵母菌菌落特征已建立相应定性、定量传统方法[9],在传统方法基础上,利用基质辅助激光解吸电离飞行时间质谱(以下简称MALDI⁃TOF MS)技术代替传统生化,构建了白假丝酵母菌快速定量检测方法[10]。研究发现,假丝酵母菌为单细胞酵母型真菌,菌落形态与一般细菌相似,通常假丝酵母菌为具有酵母相和菌丝相双相菌[11⁃12],因此传统的分离培养和涂片镜检鉴别白假丝酵母菌容易造成假阴性结果。在前期研究的基础上,本研究选取假丝酵母菌属高度保守基因5.8S核糖体RNA基因(以下简称5.8SrDNA)设计假丝酵母菌通用引物,构建出假丝酵母菌实时荧光PCR初筛模型,初筛提示阳性时,采用MALDI⁃TOF MS技术鉴定确认,从亚种水平上对假丝酵母菌进行分类,达到简单、快捷和有效的鉴定白假丝酵母菌的目的。该研究可作为我国应对纺织品白假丝酵母菌污染突发公共卫生事件技术储备,预计在公共卫生和疫情防控中发挥重要作用。
1 材料与方法
1.1 试验菌株
白假丝酵母菌ATCC 10231、近平滑假丝酵母菌ATCC 22019、光滑假丝酵母菌ATCC 15126、热带假丝酵母菌ATCC 1369、沙门氏菌CICC 21493、金黄色葡萄球菌ATCC 29213、绿脓杆菌ATCC 10145、单增李斯特菌CMCC 54002、阪崎肠杆菌IQCC 10403、副溶血性弧菌ATCC 10782、大肠杆菌CMCC 44102、大肠杆菌O157 ATCC 700728。
1.2 主要试剂、仪器
WORT肉汤、BIGGY琼脂、BHI肉汤,青岛海博生物科技有限公司;标准溶剂(乙腈50%+水47.5%+三氟乙酸2.5%),Sigma⁃Aldrich公司;质谱样品处理基质,布鲁克公司;真菌基因组DNA提取试剂盒,宝生物工程(大连)有限公司;FastFire快速定量PCR试剂(探针法),天根生化科技(北京)有限公司。BioSpec⁃nano超微量分光光度计,日本岛津公司;CFX96荧光PCR仪,美国伯乐公司;MALDI Biotyper微生物快速鉴定系统,德国布鲁克公司。
1.3 分子方法
1.3.1 增菌培养
将白假丝酵母菌ATCC 10231、近平滑假丝酵母菌ATCC 22019、光滑假丝酵母菌ATCC 15126、热带假丝酵母菌ATCC 1369接种WORT肉汤,25℃需氧培养;其他菌株接种BHI肉汤37℃需氧培养。观察各培养物浑浊即可。
1.3.2 DNA提取
取1.3.1肉汤培养物1 mL~2 mL,4℃下12 000 r/min、15 min离心收集,前处理用玻璃珠,再用硅质膜吸附,即可得到高纯度的基因组,具体操作按真菌基因组DNA提取试剂盒操作说明书进行。提取的DNA片段用超微量分光光度计检测浓度与纯度后密闭存放于-20℃保存备用。
1.3.3 引物、探针设计及优化
从EMBL核酸序列数据库中提取带注释的假丝酵母菌5.8SrDNA序列,利用Clustal Omega进行多重比较、分析。筛选出保守区域设计假丝酵母菌的通用引物和探针。primer blast检验引物特异性。正向引物5.8S⁃QF1:5′⁃AACGCAGC⁃GAAATGCGATAC⁃3′。反向引物5.8S⁃QR1:5′⁃GACATCACGCTCAAACAGGC⁃3′。探针5.8S⁃P1:FAM⁃5′CATTGCGCCTTGGGG⁃TATTC3′⁃TAMRA。引物和探针由宝生物工程(大连)有限公司合成。
1.3.4 荧光PCR体系建立
反 应 总 体 系25μL,2×Fastfire qPCR Pre⁃Mix 12.5μL,正、反 向 引 物(10μmol/L)各0.75μL,探针(10μmol/L)0.5μL,模板DNA(20 ng/μL~200 ng/μL)2μL,其 余 用RNase⁃Free dd H2O补足。反应条件:98℃、1 min预变性,95℃、5 s变性,60℃、15 s退火/延伸,共40个循环。
取1.3.2提取的假丝酵母菌DNA,采用1.3.3设计的引物和探针,设定模板上样量为0.5μL、1.0μL、2.0μL、3.0μL、4.0μL,对模板上样量进行优化,选取最适模板上样量;退火温度一般在55℃~70℃之间,先根据设计引物的GC量估算引物溶解温度(T m),估算后两条引物的T m值差异不大,以最低T m低于5℃为PCR反应退火温度起始,以2℃为梯度,设定56℃、58℃、60℃、62℃、64℃进行优化,确定最适退火温度。每次试验重复3个平行试验。
1.4 M ALDI⁃TOF MS鉴定
1.4.1 菌株分纯
取1.3.1肉汤培养物划线接种BIGGY琼脂,25℃需氧培养48 h。
1.4.2 菌落蛋白提取
用无菌棉签挑取约5 mg菌落放入装有300μL去离子水的1.5 mL EP管中,混匀;再取900μL无水乙醇加入,振荡混匀;12 000 r/min离心2 min,吸弃上清,室温下放置2 min;再向管中加入50μL 70%甲酸水溶液,混匀;再加入50μL纯乙腈混匀,12 000 r/min离心2 min;吸取上清液转移到新EP管中备用。
1.4.3 点靶
吸取1μL 1.4.2提取好的菌落蛋白,按试验布控顺序滴加到MALDI靶板测试点位(每个靶板有96个测试点位)上,室温下晾干;取出质谱样品处理基质,恢复室温后加入250μL标准溶剂,涡旋振荡器混匀至完全溶解,离心,每个点位加1μL基质溶液,室温下自然蒸发溶剂。
1.4.4 MALDI⁃TOF MS数据采集分析
采用MALDI Biotyper微生物快速鉴定系统采集数据,正线性模式,采集蛋白图谱质量范围2 000 D~20 000 D,激光轰击点数100,加速电压20 k V,提取时间150 ns。每次试验前均用校准肽蛋白(质量范围2 000 D~20 000 D)进行质量校正。
将1.4.3靶板放入仪器,开启Flex Con⁃trol3.4软件采集细菌质谱数据,自动分析得到蛋白峰信息。打开MALDI Biotyper3.1软件,选择数据库,调入上述细菌质谱数据,分析样品谱图与库中标准特征谱图匹配程度。
1.5 特异性验证
1.5.1 荧光PCR特异性验证
取1.3.2提取的DNA,按照1.3.4优化好的PCR体系及扩增条件进行特异性验证,每个模板重复3次平行试验。
1.5.2 MALDI⁃TOF MS特异性验证
取1.4.1分纯好的菌落,按照1.4.2提取蛋白后,进行MALDI⁃TOF MS鉴定,每个试验重复3次平行试验。
1.6 灵敏度验证
取1.3.1增菌后的假丝酵母菌菌液各1 mL制成混合菌液,取混合菌液1 mL稀释至108级,各取106级、107级、108级稀释度1 mL菌液涂布接种BIGGY琼脂平板,25℃需氧培养48 h后计数平板上菌落数,计算出每个稀释度的细菌浓度。取104级、105级、106级、107级、108级稀释度菌液提取基因组DNA进行扩增验证荧光PCR方法灵敏度,每个稀释度重复3次平行试验。
1.7 重复性验证
1.7.1 样品制作
收集130份不同来源、不同材质的纺织品样品(医院护士服、病房床上用品各10份,酒店浴巾、床上用品各10份,火车卧铺床上用品10份,飞机公用毛毯5份,照相馆衣服、毛绒玩具各10份,捐赠衣物25份,试验用防护服、隔离衣、一次性口罩各10份),依据标准SN/T 4656.1—2016《进出口纺织品生物安全检验方法第1部分:白假丝酵母菌》检测白假丝酵母菌,21份样品检测出白假丝酵母菌。109份白假丝酵母菌阴性的样品,按SN/T 4656.1—2016 6.1制样,取1.6中105级稀释度假丝酵母菌菌液,分别加入制作好的样品中,每个样品1 mL,混匀隔夜放置。
1.7.2 样品验证
对109份人工污染样品按上述方法进行PCR扩增和MALDI⁃TOF MS鉴定,同时用SN/T 4656.1—2016第7节平行检测。
对21份自然污染样品按上述方法进行PCR扩增和MALDI⁃TOF MS鉴定。
2 结果分析
2.1 DNA纯度结果
提取的DNA最后会残留有蛋白质、盐和小分子物质,DNA链上碱基的苯环结构在260 nm处吸收峰最大,蛋白质在280 nm吸收峰最大,盐和小分子在230 nm吸收峰最大。因此,本试验用紫外分光光度计同时检测DNA的OD260、OD280和OD230值,利用其比值来衡量DNA的纯度,见图1。OD260/OD280为1.87,适中;OD260/OD230为1.29,偏低,可能是洗脱时用去离子水代替了洗脱缓冲液造成比值偏低,但并不表明DNA纯度不高。

图1 DNA浓度和纯度结果
2.2 荧光PCR反应体系优化
2.2.1 模板上样量优化
模板上样量优化结果见图2。从图2不同上样量的扩增结果中可以看出,当上样量在0.5μL~2.0μL时,特异性和敏感性几乎不受影响,扩增效率保持稳定,S型扩增曲线比较明显,但当模板量较高时,敏感性和扩增效率相应降低。因此,最佳上样量应选择为0.5μL~2.0μL。
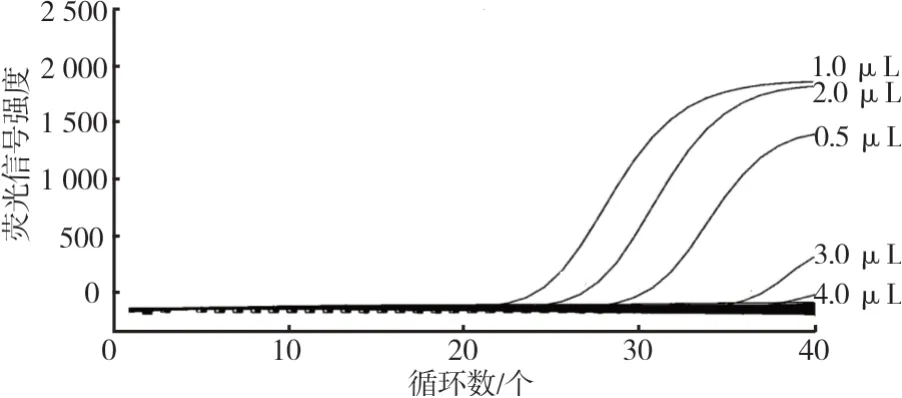
图2 模板上样量优化结果
2.2.2 退火温度优化
退火温度优化结果见图3。退火温度较低(56℃)时,理论上能够保证引物和目的序列有效退火,但同样会产生非特异性结合影响扩增效率;退火温度过高(64℃)同样影响引物和模板间的结合效率。因此在Tm值合适范围内,退火温度选择PCR反应特异性强、扩增效率最高的温度点(60℃)。
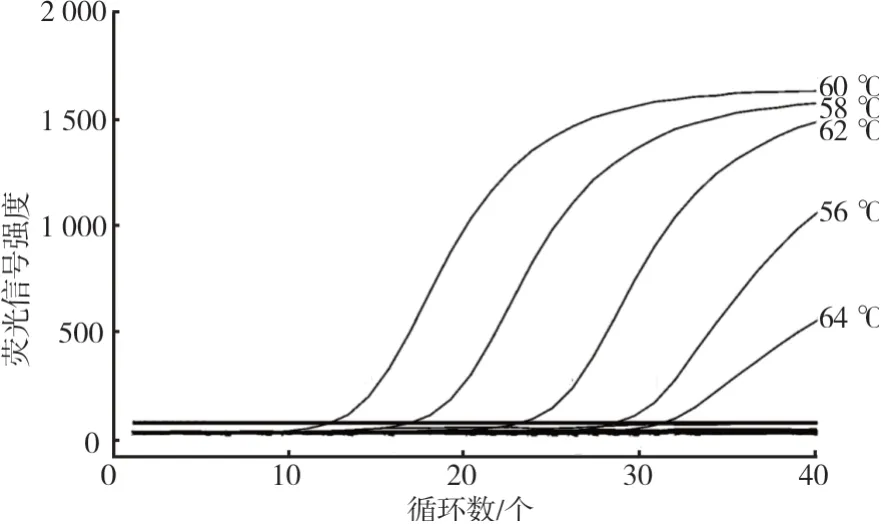
图3 退火温度优化结果
2.3 特异性结果分析
2.3.1 荧光PCR特异性验证
荧光PCR特异性验证结果见图4。只有假丝酵母菌出现S形典型阳性扩增曲线,其他非假丝酵母菌未收集到荧光信号,说明该试验引物特异性高,符合试验要求。

图4 荧光PCR特异性验证结果
2.3.2 MALDI⁃TOF MS特异性验证
取BIGGY琼脂平板上具有假丝酵母菌特征菌落进行MALDI⁃TOF MS特异性验证。典型及可疑假丝酵母菌用MALDI⁃TOF MS鉴定,分析出不同质谱谱峰,成功得出白假丝酵母菌特征谱图,见图5。

图5 假丝酵母菌质谱鉴定图谱
2.4 灵敏度结果分析
混合菌液各浓度接种BIGGY琼脂平板培养后计数,107级平板计数结果为40 CFU,依次推断104级、105级、106级、107级、108级浓度计数结果理论值分别为4×104CFU/mL、4×103CFU/mL、400 CFU/mL、40 CFU/mL、4 CFU/mL,荧 光PCR扩增后结果见图6。当菌液浓度理论值为4 CFU/mL时,荧光信号很弱,扩增曲线不明显,因此本试验灵敏度约为40 CFU/mL。
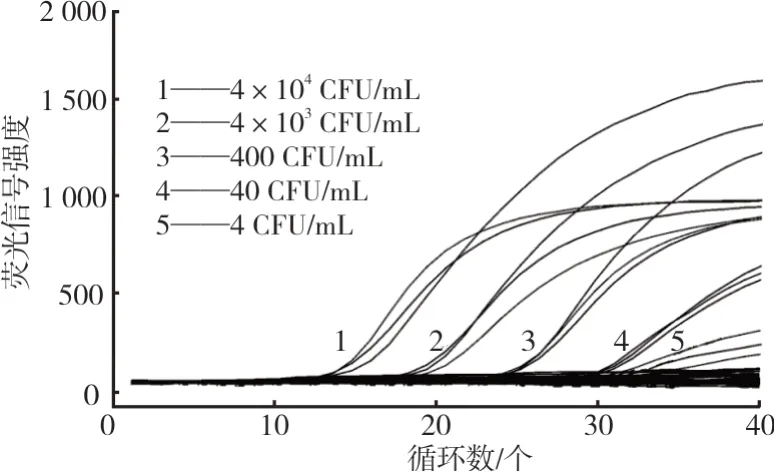
图6 荧光PCR灵敏度结果
2.5 重复性结果分析
2.5.1 人工污染样品结果
109份不同来源、不同材质的纺织品样品,人工污染后进行PCR扩增和MALDI⁃TOF MS鉴定,同时用SN/T 4656.1—2016第7节平行检测,结果荧光PCR扩增全部阳性,见图7,质谱鉴定也全部阳性,结果和SN/T 4656.1—2016第7节检测100%相符。

图7 人工污染样品荧光PCR结果
2.5.2 自然污染样品结果
对21份检测白假丝酵母菌为阳性的自然污染样品增菌后提取DNA,荧光PCR扩增结果全部阳性,见图8,分离后MALDI⁃TOF MS鉴定结果均为阳性,与SN/T 4656.1—2016第7节检测完全一致。而SN/T 4656.1—2016测出阳性需要9天~10天,本方法3天即可出结果,检测效率提高了3倍。
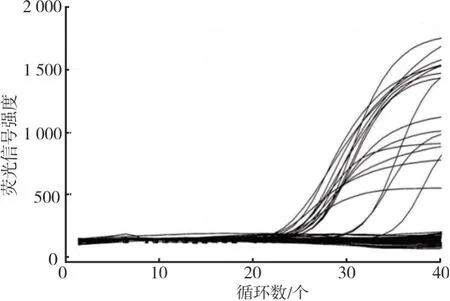
图8 自然污染样品荧光PCR结果
3 讨论分析
本研究针对纺织品中白假丝酵母菌,采用实时荧光PCR技术结合MALDI⁃TOF MS技术,构建出初筛模型并指引了最终鉴定方法。白假丝酵母菌是一种双相态菌,受不同生存环境影响,酵母相和菌丝相可以互相转变,随着形态的转变,其毒力基因很容易发生突变或基因交流[13],因此,以毒力基因为靶基因设计引物,特异性和灵敏度很难得到理想效果。目前,常用的假丝酵母菌分类基 因 有5.8SrDNA、beta⁃tubulin、28SrRNA、5SrRNA、18SrRNA等[14]。而5.8SrDNA在假丝酵母菌种内不同菌株之间高度保守[15],更适合假丝酵母菌种属鉴定。本研究从GeneBank数据库中提取假丝酵母菌5.8SrDNA基因序列,利用Clustal Omega软件设计出针对纺织品假丝酵母菌的实时荧光PCR通用引物,经验证4种常见假丝酵母菌均能特异性扩增,而其他几种非假丝酵母菌属均未见特异扩增,适合假丝酵母菌初筛鉴定。初筛后采用MALDI⁃TOF MS技术鉴定,结果和传统方法完全一致,而检测效率提高了3倍。MALDI⁃TOF MS技术是一种基于强大数据库的软电离生物质谱技术,广泛用于病原菌分型鉴定,具有高自动化、高通量、高灵敏度等特点。另外本研究选用了针对假丝酵母菌选择性较强的WORT肉汤增菌、BIGGY琼脂分离纯化菌落,对以上结果有一定的贡献。
4 结论
本研究应用实时荧光PCR技术结合MALDI⁃TOF MS技术,创新建立了一种快速、高效鉴定纺织品中白假丝酵母的方法,经验证灵敏度可达40 CFU/mL,通过对人工污染样品和自然污染样品检测,结果和传统方法100%符合。该方法将两种成熟应用的技术相结合,可操作性强,便于推广应用,为快速、准确鉴定白假丝酵母菌打开了新思路。
虽然PCR技术和MALDI⁃TOF MS技术在各领域应用相对成熟,但两者标准化程度并未同步,而且相差甚远,PCR技术标准化程度相对较高,MALDI⁃TOF MS技术目前只能搜索到标准GB/T 33682—2017《基质辅助激光解析电离飞行时间质谱鉴别微生物方法通则》。MALDI⁃TOF MS技术依赖其强大的已知菌株谱图库,而其大部分数据库没有我国自主知识产权,这也是该技术难以完全标准化的主要原因,而白假丝酵母菌基因易变异、重组,未知太多,鉴定准确率必须要有大数据支撑,后续可深入研究,通过自建假丝酵母菌谱图库补充、完善现有数据库。相信随着对MALDI⁃TOF MS技术深入研究,越来越多的相关成果会实现资源共享、数据共享,实现MALDI⁃TOF MS技术完全标准化。

