依帕司他联合生物电刺激对糖尿病周围神经病变患者SOD、MDA、8-OHdG水平的影响
刘思贤
【摘要】目的:研究糖尿病周围神经病变(DPN)患者应用依帕司他和生物电刺激联合治疗的效果,分析对患者血清超氧化物歧化酶(SOD)、丙二醛(MDA)和8-羟基脱氧鸟苷酸(8-OHdG)的影响。方法:收集本院2019年1月至2021年1月治的84例DPN患者资料,应用红白双色球法随机分组。对照组口服依帕司他治疗,治疗组在对照组依帕司他口服治疗的基础上,联合经皮神经电刺激(TENS)治疗。对比两组疗效、治疗前后周围神经功能状况、生化指标。结果:相比于治疗前,两组治疗后TCSS评分和TSS评分下降,治疗组均明显低于对照组;两组治疗后的SOD均上升,治疗组高于对照组;MDA和8-OHdG均下降,治疗组均低于对照组,组内治疗前后对比差异显著(P<0.05)。治疗组疗效(90.48%)明显高于对照组(73.81%),比较差异显著(P<0.05)。结论:依帕司他联合TENS治疗的DPN患者疗效提升,血清SOD、MDA和8-OHdG等生化指标改善,神经细胞修复和周围神经传导速度提升,临床应用价值高。
【关键词】糖尿病周围神经病变;依帕司他;生物电刺激;生化指标;周围神经功能
【中图分类号】R587.2.【文献标识码】A.【文章编号】2096-5249(2021)14-0200-02
糖尿病(DM)是临床常见慢性全身性内分泌代谢性疾病。周围神经病变(DPN)是DM导致的微血管并发症,是DM晚期慢性并发症之一,患者以远端肢体异常、自发性疼痛为特征临床表现,严重时可致患者足部坏疽、截肢等[1]。DPN发病率高,隐匿性强,病情一旦发展至晚期,无完全治愈手段,严重影响患者生存质量。病理研究称[2],糖代谢异常在DPN发病机制中发挥重要作用,临床治疗围绕控制血糖、抗氧化应激、营养神经等展开。依帕司他是具有可逆性的醛糖还原酶抑制剂,主要通过减少羧甲基赖氨酸产物获得治疗DPN的目的,但其对受损神经组织的修复效果有限,联合其他药物或物理手段是临床应用热点。经皮神经电刺激(TENS)在神经损伤中的应用日益增多,疗效也被证实[3]。为研究依帕司他和TENS联合治疗DPN的效果,分析对血清超氧化物歧化酶(SOD)、丙二醛(MDA)和8-羟基脱氧鸟苷酸(8-OHdG),本文收集了诊治的84例患者资料。
1?对象与方法
1.1.研究对象
收集本院2019年1月至2021年1月诊治的84例DPN患者资料,应用红白双色球法随机分组。对照组中,男女比例24/18;年齡(51.03±3.46)岁;空腹血糖(GLU)(6.23±0.68)mmol/L;DM病程(10.13±1.23)年;DPN病程(5.12±0.34)年。治疗组中,男女比例21/21;年龄(50.76±3.61)岁;GLU(6.19±0.71)mmol/L;DM病程(10.20±1.16)年;DPN病程(5.15±0.31)年。两组一般资料对比无显著差异(P>0.05)。本项研究符合《世界医学协会赫尔辛基宣言》相关要求,且患者知情本研究并签署意向书者。
纳入标准:符合DM和DPN诊断标准[4-5];入组时TCSS评分6~11分;疼痛持续半年以上者;肌电图提示感觉、运动神经传导速度异常者;认知无障碍者。
排除标准:同时合并其他DM严重并发症者;肝肾功能不全者;恶性肿瘤者;合并血液系统疾病者;对研究药物过敏者。
1.2.治疗方法
所有患者均接受口服降糖药物/注射胰岛素、控糖、戒烟、DM饮食及运动疗法等基础治疗。对照组口服依帕司他(规格为50 mg,国药准字H20040012,扬州江药业集团南京海陵药业有限公司),饭前口服,50 mg/次,3次/d。
治疗组在对照组上述依帕司他口服治疗的基础上,联合TENS治疗,设置经皮电神经刺激仪(型号:TENS,日本株式会社)脉冲宽度(0.2 ms)和频率(100 Hz)。在受损神经走行的皮肤表面远端和近端分别放置体表电极,给予连续3 s的低强度电流刺激,中间间隔3 s,8 min/次,2次/d。两组连续治疗时间均为4周。
1.3.观察指标
(1)周围神经功能[6]。采用多伦多临床评分系统(TCSS)和神经病变自觉症状问卷(TSS)评价患者周围神经功能状况。TCSS评分系统由神经反射、神经症状和感觉功能组成,总分值19分,分值越高代表神经功能受损越严重。
TSS评分系统包括麻木、感觉异常、灼热感、疼痛四种症状,根据症状发生次数和严重程度评分,每项分值0~3.66分,总分值14.64分,分值与症状严重程度呈正相关。
(2)生物学指标。采集患者治疗前后清晨空腹肘静脉血各5 mL,取离心处理后的上层血清,采用生化分析仪(型号:7180,日立)分别以黄嘌呤氧化酶法、硫代巴比妥分光光度法和酶联免疫吸附法测定SOD、MDA、8-OHdG水平。
(3)疗效。根据自觉症状变化,正中神经和腓总神经的感觉神经传导速度(SCV)和运动神经传导速度(MCV)改善幅度及腱反射情况,将患者疗效分为显效(自觉症状消失,SCV、MCV增加5 m/s以上,腱反射基本恢复正常)、有效(自觉症状明显减轻,SCV、MCV增加不足5 m/s,腱反射未完全恢复正常)和无效(自觉症状无好转,SCV、MCV无变化,腱反射无改善)。
1.4.统计学分析
研究数据应用SPSS 21.0软件分析,以(x±s)形式表示计量数据,t检验法比较;以率(%)表示计数数据,χ2检验法比较,P<0.05表明差异明显。
2?结果
2.1.周围神经功能
相比于治疗前,两组治疗后TCSS评分和TSS评分下降,治疗组均明显低于对照组,比较差异具有统计学意义(P<0.05)。见表1。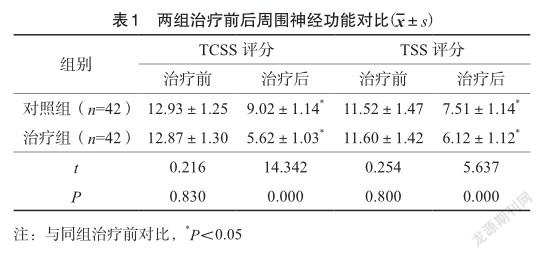
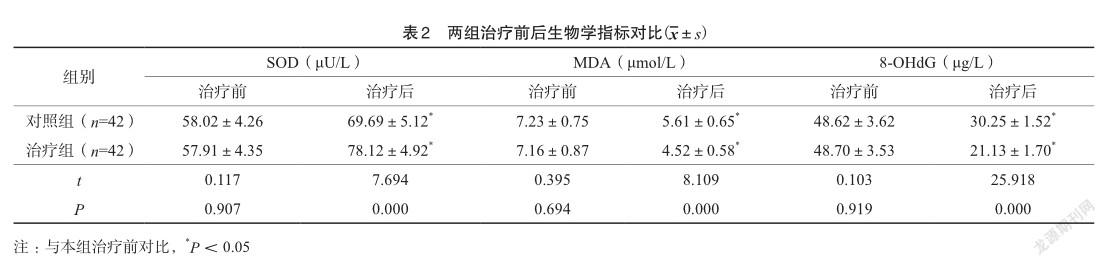
2.2.生物学指标
相比于治疗前,两组治疗后的SOD均上升,治疗组高于对照组;MDA和8-OHdG均下降,治疗组均低于对照组,比较差异显著(P<0.05)。见表2。
2.3.疗效
治疗组疗效(90.48%)明显高于对照组(73.81%),比较差异显著(P<0.05)。见表3。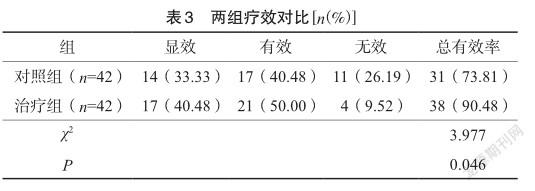
3?讨论
目前临床对DPN发病机制尚不清楚,多元醇通路激活学说认为[7],持续性高血糖经醛糖还原酶催化生成山梨醇,后在山梨醇脱氢酶催化作用下生成果糖,但神经组织中不含果糖激酶,无法利用果糖,导致果糖和山梨醇大量堆积,引起细胞内渗透压升高,从而引发神经细胞肿胀、变性,甚至坏死。依帕司他是DPN发病机制中醛糖还原酶抑制剂,可抑制上述催化过程,从而减少神经组织张山梨醇和果糖含量,降低渗透压,改善神经传导。但DPN的药物治疗仅是对症,往往缺乏特异性,疗效有限,不利于改善病情。TENS镇痛作用良好,改善微循环作用明显,在国外被广泛应用于神经损伤疾病的临床治疗中。动物学临床研究显示[8],正常肌组织在电刺激下的动脉血流增加80%以上。TENS通过皮肤向人体输入低频脉冲电流,局部皮肤痛阈在刺激作用下提升,局部微循环障碍改善,其作用机制在于,在脊髓背角内的胶质细胞中有类似闸门的神经机制,具有调节外周至中枢的神经冲动。使TENS能兴奋粗纤维,抑制来自同节段细纤维的伤害感受信号和脊髓背角投射神经细胞的兴奋。在控制血糖的基础上,药物和物理手段联合治療方案成为DPN临床治疗首选。研究结果显示,联合治疗的患者疗效总有效率(90.48%)较高。
DPN患者机体长期处于高血糖状态,打破了氧化和抗氧化系统平衡,活性氧含量大增。在生化指标中,MDA能间接反映机体过氧化程度,SOD反映抗氧化能力,8-OHdG是DNA氧化损伤特意标志物,在机体内水平稳定,是新型的氧化应激状态评价指标,对机体氧化损伤和修复程度具有客观评价作用。本文中,联合治疗的患者SOD水平增加,MDA和8-OHdG水平均下降,此结果提示,相比依帕司他药物治疗,联合TENS治疗的患者氧化应激状态改善更为明显。究其原因,依帕司他和TENS二者发挥系统效应,依帕司他发挥药效的同时,减少炎性因子的释放,周围神经在TENS电刺激下,有助于微循环的改善。
综上所述,依帕司他联合TENS治疗的DPN患者疗效提升,血清SOD、MDA和8-OHdG等生化指标改善,神经细胞修复和周围神经传导速度提升,临床应用价值高。
参考文献
[1] 景磊,雷静,尤浩军.糖尿病性周围神经病理性疼痛表现、机制及治疗进展[J].中国疼痛医学杂志,2020,26(9):649-652.
[2] 周海平,周君,杨涛,等.糖尿病周围神经病变的发病机制及相关生物学标志物研究进展[J].中华糖尿病杂志,2021,13(2):187-190.
[3] 杨明花,冯艳桦,乔冠晓.硫辛酸联合低频脉冲穴位刺激治疗糖尿病周围神经病变的疗效观察[J].现代诊断与治疗,2018,29(20):3205-3206.
[4] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版).中华糖尿病杂志,2018,10(1):4-67.
[5] 李全民,吴海娅.糖尿病周围神经病变诊断标准与检查方法评价[J].中华糖尿病杂志,2018,10(11):705-708.
[6] 张颖,简娇敏,娄晓丽,等.糖尿病周围神经病变患者多伦多神经症状评分与炎症状态的相关性研究[J].中国糖尿病杂志,2019,27(5):352-356.
[7] 冷玉琳,杜联,刘晓可,等.从神经微环境探讨调和营卫法治疗糖尿病周围神经病变的作用机制[J].中国实验方剂学杂志,2020,26(21):220-225.
[8] 杨慧芳,魏碧玉,马丽娟,等.糖尿病周围神经病变常见危险因素研究进展[J].武警医学,2020,31(9):89-92.

