机油降解菌降解机油的响应面法优化及其动力学研究
刁志龙,辛 毅,刘 坤,吴燕红,高焕方
(1.重庆理工大学 化学化工学院, 重庆 400054; 2.重庆渝泓土地开发有限公司, 重庆 401120;3.重庆市生态环境科学研究院, 重庆 401147)
机油属于众多石油产品中的一种,其广泛用作机械润滑剂、金属防锈剂和乳化剂[1]。由于其用途广泛且每年使用量巨大,废机油也随之产生。在废机油的运输、储存和处理过程中存在管理的不规范,不可避免的导致土壤和水体被废机油污染,对环境造成重大的影响,对人类健康构成巨大威胁[2]。
生物修复是一种高效、适应性强和低成本的技术[3]。目前,许多研究表明土壤原著微生物对石油烃有较好的降解效果[4-7]。但石油烃的生物降解是一个复杂的过程,其过程容易受微生物种类、营养物质和环境因素等条件的影响[8]。并且各因素之间存在相互作用,传统的单因素试验无法准确表达各因素的交互作用,往往不能达到预期的优化效果;因此目前主要采用的是正交实验法和响应面法,但正交实验是线性模拟,不能直接给出图形观察其最优条件以及自变量之间的交互作用[9-10]。响应面法(RSM)是一种面向实验设计及数学建模的优化方法[11]。该方法可以根据少量具有代表性的局部点实验建立各因素与结果的数学模型,利用多元二次回归方程来拟合各因素与结果之间的函数关系,最终通过回归方程预测其最佳条件,揭示各因素的内在联系[12-13]。
本研究从石油烃污染土壤中筛选出一株能够降解机油的菌株并对其进行了鉴定;以机油为降解对象,考察了菌液投加量、温度、pH值、机油浓度对机油降解率的影响,利用响应面法中Box-Behnken设计优化降解条件,得到最佳的降解条件,并分析了温度、pH值、机油浓度3个因素之间的交互作用对机油生物降解的影响;同时在优化后条件下拟合一级动力学方程;为石油烃污染土壤和水体的生物修复提供依据。
1 材料与方法
1.1 土壤来源
取自重庆某石油烃污染场地,采用多点取样,采取表层10~20 cm处的石油烃污染土壤,装于自封袋里密封冷藏保存作为筛选石油烃降解菌株的样品。
1.2 培养基
无机盐培养基:NaNO32 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01 g,蒸馏水1 000 mL。
牛肉膏蛋白胨培养基:NaCl 5 g,蛋白胨10 g,牛肉膏5 g,琼脂20 g(固体培养基用),蒸馏水1 000 mL。
无机盐含油培养基:无机盐培养基+机油。
培养基均于高压灭菌锅121 ℃灭菌20 min。
1.3 实验方法
1.3.1机油标准曲线的测定
称取0.1 g机油,用石油醚溶于100 mL容量瓶中,得到浓度为1 000 mg/L的机油标准溶液。然后分别移取0.2、0.25、0.3、0.35、0.4 mL的机油标准溶液于25 mL容量瓶中,定容并摇匀,得到浓度为8、10、12、14、16 mg/L的机油标准溶液,使用紫外可见分光光度计在230 nm处,用1 cm的石英比色皿以石油醚为空白对照测定每个浓度的吸光度,然后以机油浓度为横坐标,吸光度为纵坐标绘制机油标准曲线。
1.3.2石油烃降解菌的分离筛选
1) 称取30 g石油烃污染土壤然后按固液比1∶5加入150 g去离子水,放入摇床160 r/min振荡30 min,随后取出抽滤,然后加入2%的琼脂放入灭菌锅里灭菌。待灭菌结束,倒入平板中冷却备用。
2) 取10 g石油烃污染土壤放入已灭菌的装有100 mL无菌水的250 mL的三角瓶中,放入摇床160 rpm振荡10 min,静置分层,得到菌悬液,吸取1 mL菌悬液加入9 mL无菌水中,依次稀释至10-7,采用稀释平板法进行分离,取100 μL稀释液涂布于平板上,置于30 ℃培养箱中,观察并记录,待菌落长好后,选择形态特征不同的菌落,在平板上进行多次划线进行分离纯化,得到纯种菌株。
3) 将分离得到的纯种菌株转至含油的无机盐固体培养基中,置于30 ℃培养箱中,观察其是否能以机油为唯一碳源生长。将能以机油为唯一碳源生长且生长速度较快的石油降解菌株用牛肉膏蛋白胨培养基斜面培养,然后放入冰箱在4 ℃低温保存。
1.3.3ITS测序及系统发育树的构建
将筛选出的菌株送往科学指南针(长沙)进行分类学鉴定,采用omega HP真菌DNA提取试剂盒提取真菌基因组的样品;利用ITS1/ITS4引物对样品DNA进行PCR扩增;采用Sanger法对PCR产物进行测序,PCR产物条带大小约为500~750 bp,采用双向引物测序,测序结果采用DNAMAN 6.0软件进行拼接处理,将测序结果中的序列信息,输入美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据中的Blast比对系统中,搜索数据库中相似的序列,得到序列比对结果。采用MEGA 5.1软件进行进一步的多重序列比对和系统发育树分析。
1.3.4单因素实验
在机油初始浓度为5 000 mg/L的无机盐含油培养中,在不同菌液接种量(1%、3%、5%、7%、9%,体积分数,下同)、不同pH值(利用1 mol/L的NaOH及HCl调节为3、4、5、6、7、8、9)、温度(20、25、30、35、40 ℃)和机油初始浓度(1 000、3 000、5 000、7 000、9 000 mg/L)的条件下160 r/min培养4 d,培养结束后取出测定机油的残留浓度,每组实验设置3个平行样。
1.3.5响应面优化实验
选取pH值(A)、温度(B)、机油初始浓度(C)作为自变量,以-1、0、1代表因素的3个水平,以机油降解率为响应值为Y;利用响应面法中Box-Behnken设计来对ML-1降解机油的过程进行研究和优化。响应面实验因素及水平设计如表1所示。

表1 实验因素与水平
1.3.6ML-1降解动力学实验
根据响应面法筛选出来的最佳降解条件,接入5%的菌液,每隔12 h测定残留机油的浓度,分析机油的降解速率,模拟ML-1菌株降解机油的动力学方程。
1.4 分析方法
机油降解率的测定采用紫外分光光度法,以石油醚为参比,在波长230 nm处测其吸光度,利用标准曲线计算机油的浓度,进而计算机油的降解率,机油降解率的计算公式如下:

(1)
式中:w为初始机油浓度(mg/L);w1为残留机油浓度(mg/L)。
利用Design Expert v8.0.6软件对实验结果进行分析,利用方差分析确定拟合方程中每项的显著性,并评估每种情况下的拟合度。
2 结果与讨论
2.1 石油烃降解菌株的分离筛选及鉴定
2.1.1机油标准曲线的测定
机油标准曲线如图1,标准曲线方程为:y=0.036 85x-0.055 6,R2=0.999。

图1 机油标准曲线
2.1.2石油烃降解菌株的分离筛选
通过富集培养、分离纯化以及含油培养基的验证,筛选出一株能以机油为唯一碳源生长且生长得较快较好的菌株;其颜色为白色,菌落很大、疏松、干燥、不透明、呈绒毛状,菌体可沿培养基表面蔓延生长,如图2所示。将其作为后续的研究对象,命名为ML-1。
图2 ML-1的菌落形态图
2.1.3分子生物学鉴定
利用ITS1/ITS4引物对PCR产物进行测序,ML-1菌株与Rigidoporus sp.strain FBV40相似度达到99%,属于硬孔菌属(Rigidoporus)真菌。通过ITS区域测序,最终确定菌株ML-1为Rigidoporus vinctus。采用MEGA5.1软件进行进一步的多重序列比对和系统发育树分析,系统发育树如图3所示。

图3 ML-1系统发育树示意图
2.2 单因素实验结果分析
2.2.1菌液投加量对机油降解的影响
由图4可以看出:机油的降解率随着菌液投加量的增加而增大,但当菌液接种量大于5%时,机油的降解率增幅不大。这可能是因为菌液投加量过多时,菌株的大量繁殖导致培养基中的菌密度过大,从而造成营养物质的短缺,不利于新生菌株的生长,进而影响机油的降解率[9]。因此菌液投加量并不是越多越好,在满足处理要求的前提下,选择适宜的投加量达到最佳的经济效应。因此,菌液投加量选择5%。

图4 菌液投加量对机油降解率的影响曲线
2.2.2pH值对机油降解的影响
当温度为30 ℃,机油初始浓度为5 000 mg/L时,pH值对ML-1降解机油的影响如图5所示。
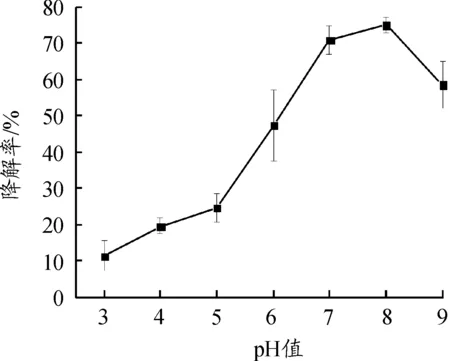
图5 pH值对机油降解率的影响
机油的降解率随着pH值的增加,呈先升高后下降的趋势;pH值在7~8时,ML-1能够较好的降解机油,其降解率达到了70%以上。在强酸强碱的情况下机油的降解率都不太理想,这可能是因为生物体内的降解酶受到了抑制,降解酶无法与污染物分子结合,从而影响菌株对机油的降解效果[14]。
2.2.3温度对机油降解的影响
当pH值为8,机油初始浓度为5 000 mg/L时,温度对机油降解率的影响如图6所示。机油的降解率呈抛物线型,先升高后下降。当温度为30 ℃时降解率最高,达到了75.1%;可以看出菌株降解机油的适宜温度在25~30 ℃。温度过高或过低,菌株对机油的降解能力都显著降低,都低于20%。这可能是因为温度可以影响生物体内酶的活性,在适宜的温度下可以加快降解酶与污染物分子的反应速率;温度过高可能会导致酶失活,甚至杀死菌株;温度过低会使菌株的活动变慢,从而影响机油的降解效率[15]。

图6 温度对机油降解率的影响曲线
2.2.4初始浓度对机油降解的影响
当温度为30 ℃,pH值为8时,机油初始浓度对机油降解的影响如图7所示。当机油的初始浓度为3 000 mg/L时机油的降解率达到最大值(83.76%);机油的初始浓度过高或者过低都不利于机油的降解,初始浓度过低由于碳源太少,无法满足菌株大量繁殖的条件,不利于菌株的大量生长;初始浓度过高可能对菌株产生毒害的作用,抑制菌株的生长甚至导致菌株死亡,从而影响菌株对机油的降解效率。
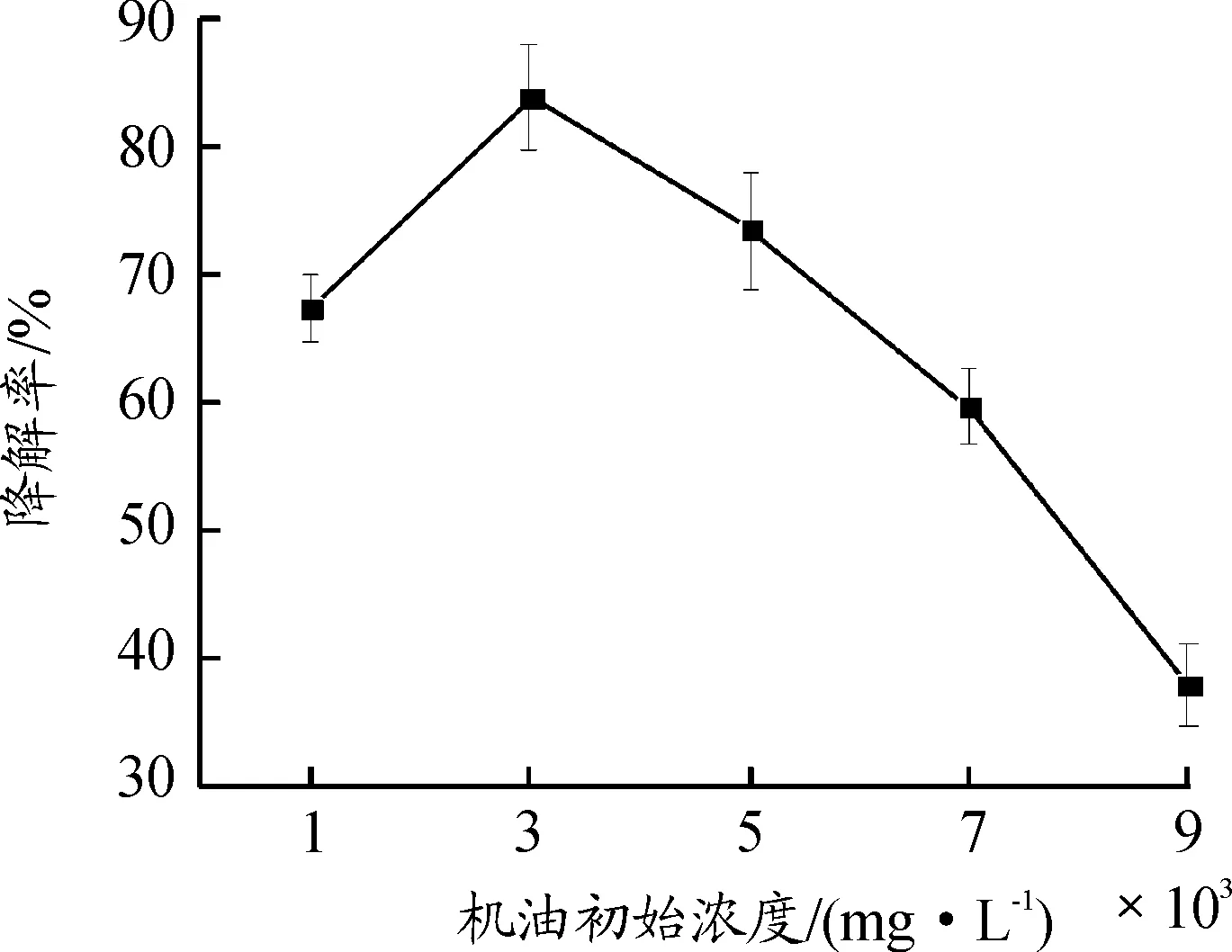
图7 机油初始浓度对机油降解率的影响曲线
2.3 响应面法优化ML-1降解机油的条件
2.3.1响应面法优化实验结果
根据Box-Behnken设计试验,以pH值、温度和机油初始浓度作为影响菌株ML-1降解机油的3个因素,设计了3因素3水平的响应面分析实验,其实验结果如表2所示。实际与预测降解率值的对应关系图如图8所示。
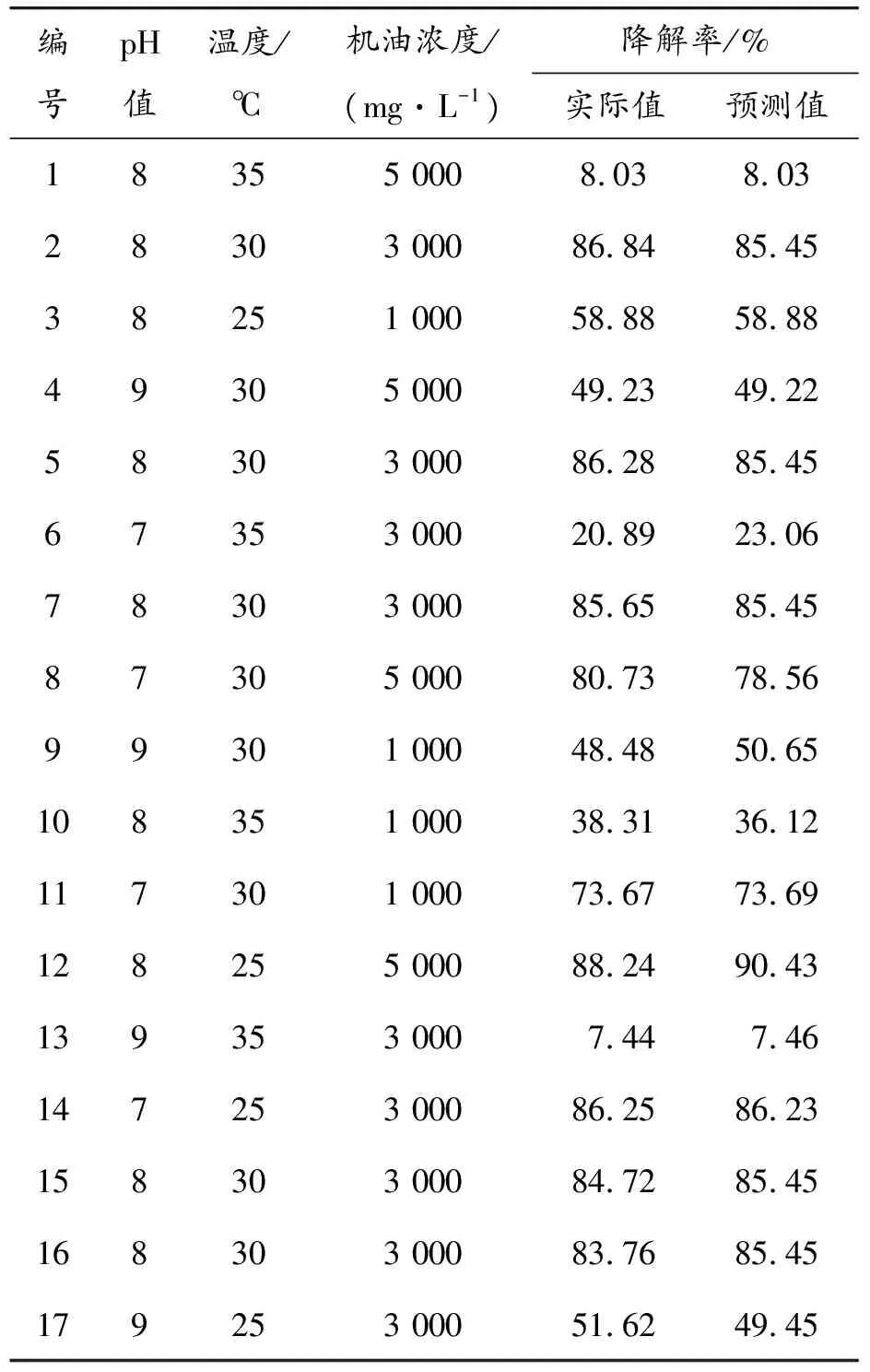
表2 实验结果

图8 实际与预测机油降解率曲线
从表2和图8可以看出实际值与预测值拟合较好,通过软件对表2数据的进行拟合,最终得到编码方程模型见式(2):
Y=85.45-13.1A-26.29B+0.86C+
5.29AB-1.58AC-14.91BC-
14.62A2-29.28B2-7.80C2
(2)
式中:Y为机油降解率(%);A为pH值;B为温度(℃);C为机油浓度(mg/L)。
2.3.2方差分析
响应面二次回归方程的方差分析结果如表3所示。
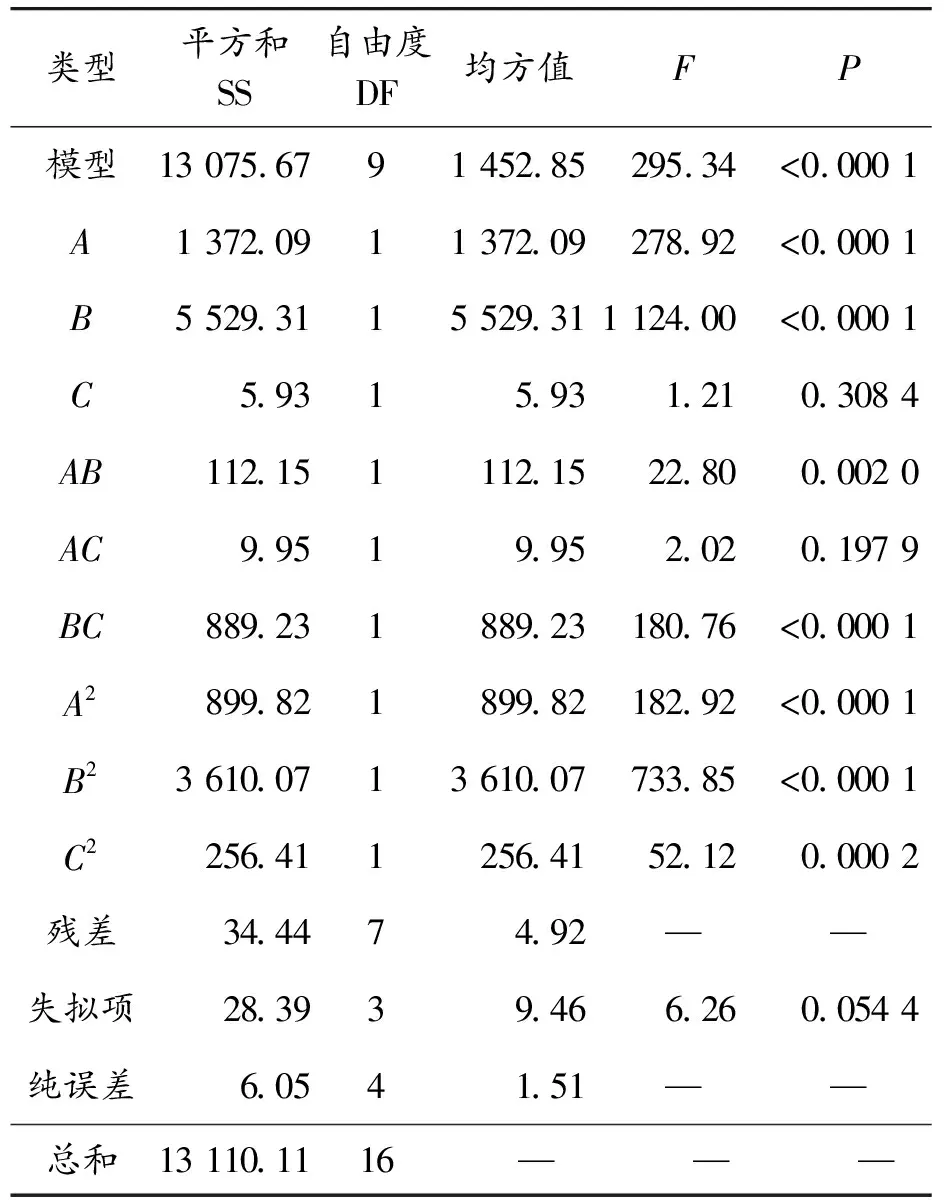
表3 方差分析结果
从表3可以看出:模型F值为295.34,P<0.000 1,表示该模型是显著的;失拟项的F值为6.26,P>0.05,表明模型拟合的缺失相对于纯误差不显著,从而说明模型的拟合度很好,接近真实的响应面曲面情况,模型建立合理。从表3可以看出:A、B、BC、A2、B2的影响非常显著(P<0.000 1),AB、C2为显著变量(P<0.05),C、AC的影响不显著(P>0.05)。分析可得:影响ML-1降解机油的3个因素排序为温度>pH值>机油初始浓度。
表4为响应面二次模型的可信度分析结果,确定系数R2为0.997 4,调整系数R2为0.994 0,偏差系数CV=3.63%<10%和精密度为48.773表明该模型的可靠性和准确性,实验值和预测值之间存在良好的相关性,回归模型能够很好的解释自变量与响应之间的关系。
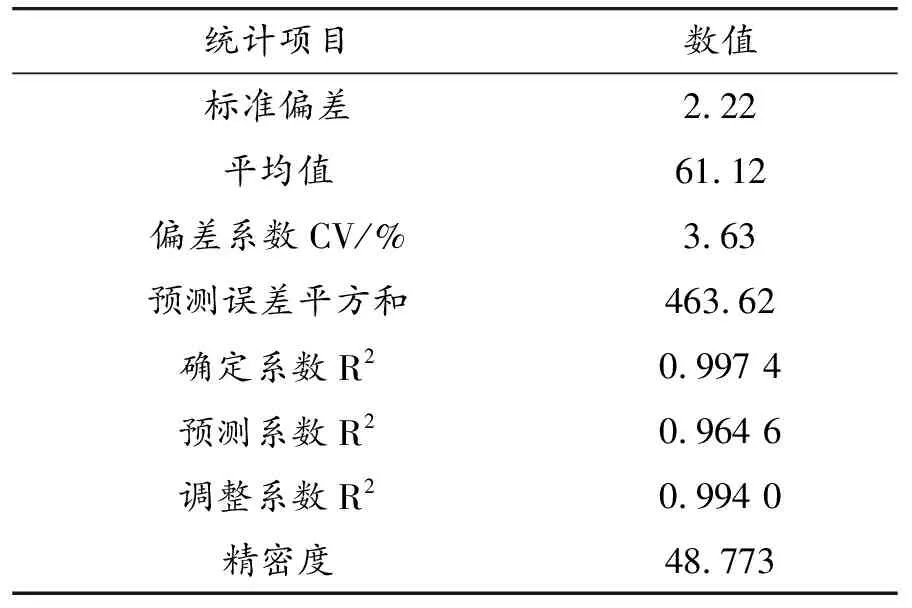
表4 响应面二次模型可信度分析结果
2.3.3各因素的交互效应分析
响应面可以分析机油降解率与各因素的关系,同时能够直观反映各因素之间存在的交互作用。其中等高线的形状可以反映2个因素的交互作用是否显著,等高线形状为椭圆说明2个因素交互作用显著,形状为圆形说明2个因素交互作用不显著[16]。从图9~11可以看出:温度与pH值,温度与机油初始浓度之间的交互作用显著,pH值与机油初始浓度之间的交互作用不显著。
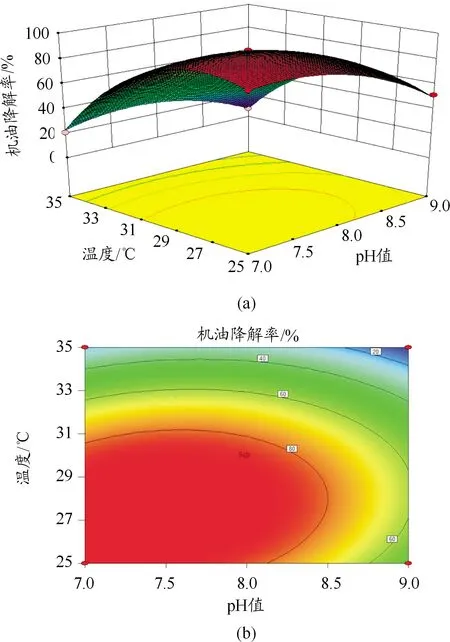
图9 温度和pH值对机油降解率的交互作用图
通过实验模型和响应面分析得到ML-1降解机油的最佳条件为温度为26 ℃,pH值为7.4,机油初始浓度为4 600 mg/L。在此条件下得到ML-1降解机油的理论最大值为99.13%。通过验证,实验结果为94.74%,与预测值偏差不大。可见响应面法优化得到的条件准确,为后续处理石油烃污染土壤和水提供了依据。

图10 温度和机油浓度对机油降解率的相互作用图
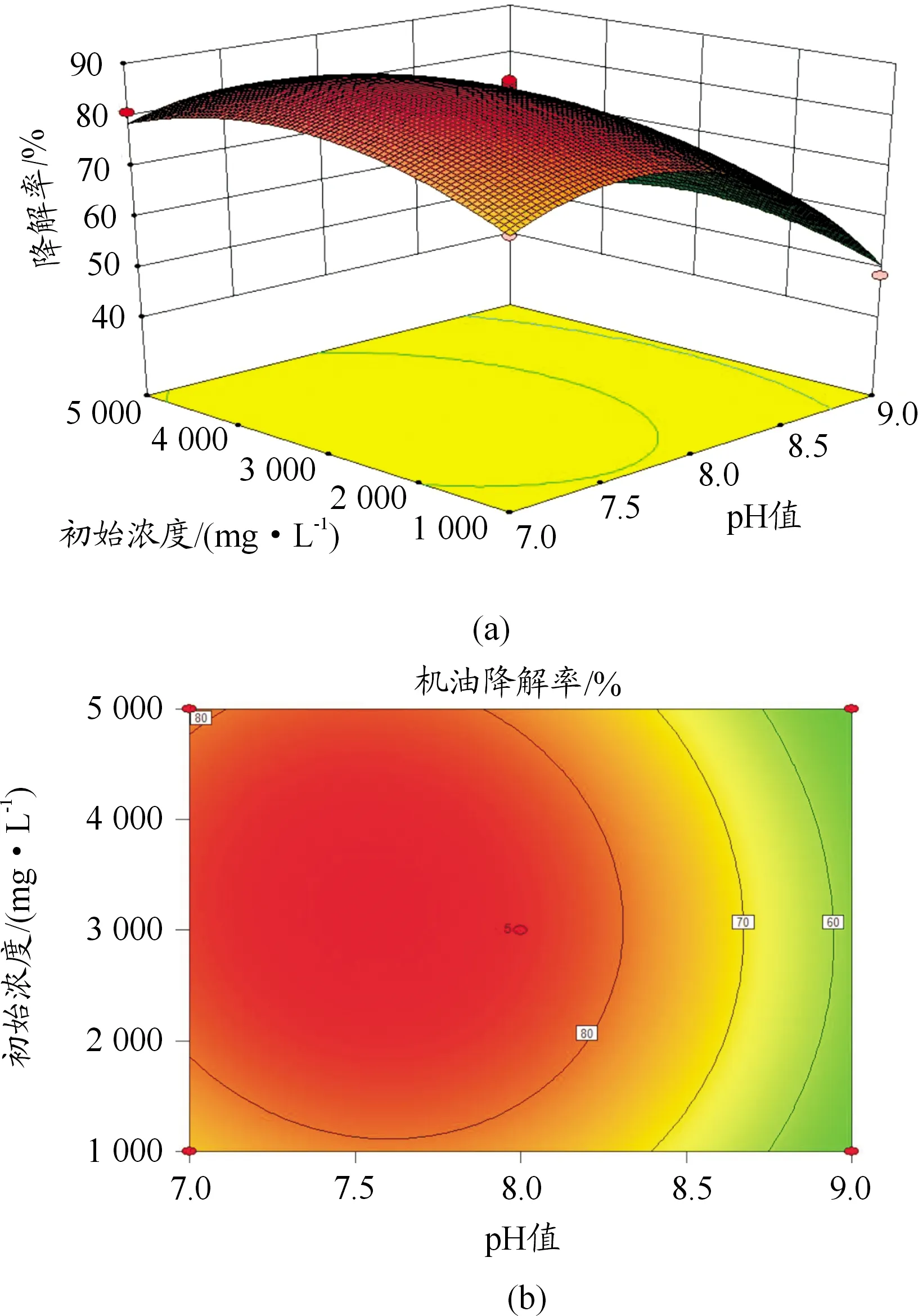
图11 机油浓度和pH值对机油降解率的相互作用图
2.4 ML-1的降解动力学方程模拟
Abioye等[17]研究发现微生物降解机油的过程符合一级反应动力学,可用方程(3)表示。
lnc=-kt+a
(3)
式中:c为底物浓度,k为反应速率常数,t为反应时间。
如图12所示,ML-1降解机油的降解动力学与一级动力学方程拟合效果良好,其过程遵循一级动力学模型,动力学方程为:lnc=-0.941t+9.368,其R2为0.976 7,反应速率常数为0.941 mg/(L·d-1),半衰期为0.74 d。
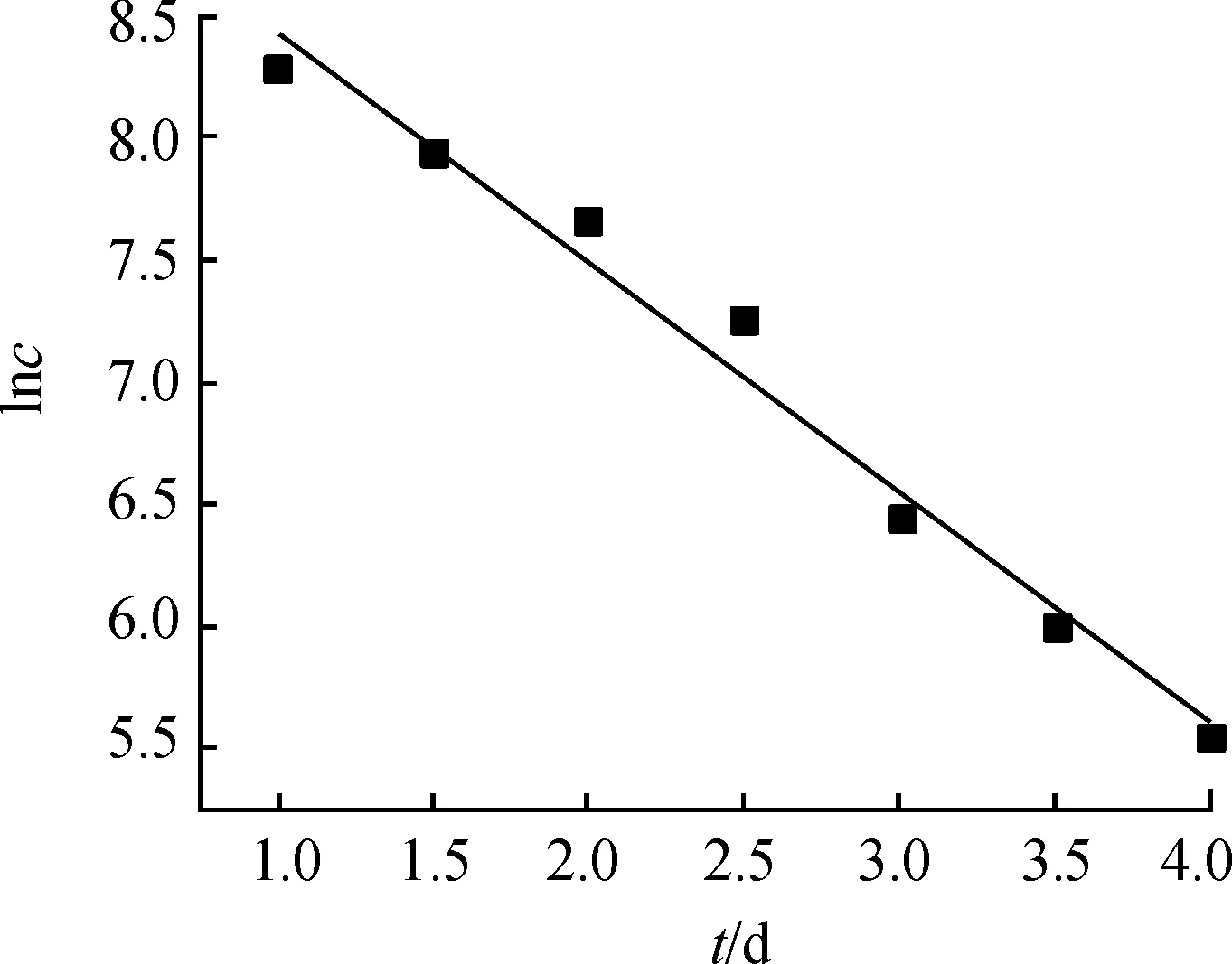
图12 降解动力学特征曲线
3 结论
1) 从石油烃污染土壤中分离出一株高效石油烃降解菌株ML-1对其进行了ITS测序,确定该菌株为Rigidoporus vinctus。
2) 通过响应面法对pH值、温度和机油初始浓度3个对机油的生物降解影响显著的因素进行优化,最终得出3个因素对机油降解的影响排序为温度>pH值>机油初始浓度;响应面法确定的最佳降解条件为pH值为7.4,温度为26 ℃,机油初始浓度为4 600 mg/L,其在最佳降解条件下预测的降解率为99.13%,实际验证降解率为94.74%,两者相差不大。
3) 在响应面法确定的最佳条件下,ML-1降解机油的过程符合一级动力学模型,其R2为0.976 7,反应速率常数为0.941 mg/(L·d-1),半衰期为0.74 d。

