茉莉酸甲酯诱导的玉米对粘虫生长发育的影响
林东江,林港华,王亚如,高三基,王锦达

摘要:【目的】研究取食經茉莉酸甲酯(MeJA)处理的玉米对粘虫生长发育的影响,揭示玉米相关抗虫机制,为利用植物自身抗性进行害虫防治提供理论依据。【方法】对玉米苗喷施100 μmol/L的MeJA溶液,将处理24 h后的玉米苗喂食粘虫1龄幼虫,连续喂食直至化蛹,观察分析粘虫生长发育情况;通过荧光定量PCR研究外源MeJA处理后玉米植株茉莉酸通路上关键基因的表达变化,并用超高效液相色谱—串联质谱(UPLC-MS/MS)对处理后的玉米叶片相关激素进行定性和定量分析。【结果】与对照相比,取食经MeJA处理的玉米叶片后,6龄粘虫幼虫体重减轻11.67%,蛹重减轻18.20%,羽化率降低7.35%,成虫存活时间缩短0.93 d,而蛹期延长0.27 d。荧光定量PCR检测结果,外源MeJA处理24 h后,ZmLox基因的表达量显著上调(P<0.05,下同),达对照的5.57倍;ZmAos基因表达量在处理12 h后显著增加,24 h后降至对照相近水平;ZmAoc基因和ZmOpr基因表达量在处理后12和24 h无显著变化(P>0.05,下同)。UPLC-MS/MS定性定量分析结果表明,喷施MeJA 24 h后,玉米叶片中二氢茉莉酸(H2JA)含量显著增加,为对照的5.67倍,而茉莉酸(JA)、茉莉酸—异亮氨酸(JA-ILE)和MeJA含量无显著变化。【结论】外源喷施MeJA能诱导玉米产生防御能力,影响取食的粘虫生长发育;ZmLox基因的显著表达和激素H2JA的产生可能是玉米抗虫的一个重要机制。
关键词: 茉莉酸甲酯;玉米;粘虫;基因表达;激素检测
中图分类号: S435.132 文献标志码: A 文章编号:2095-1191(2021)09-2465-08
Effects of methyl jasmonate induced corn on the growth and development of Mythimna separata
LIN Dong-jiang, LIN Gang-hua, WANG Ya-ru, GAO San-ji, WANG Jin-da*
(National Engineering Research Center of Sugarcane, Fujian Agriculture and Forestry University,
Fuzhou 035002, China)
Abstract:【Objective】To study the effects of corn leaves treated with methyl jasmonate (MeJA) on the growth and development of Mythimna separata, reveal the relevant insect resistance mechanism of corn, and provide a theoretical basis for the use of plant resistance for pest control. 【Method】Spraying 100 μmol/L of MeJA solution on corn seedlings. After 24 h,fed the corn seedlings to the first instar larvae of M. separata, continued feeding until pupation, observed and analyzed the growth and development of M. separata. Then, quantitative PCR was used to study the expression changes of key genes in the jasmonic acid pathway after treatment with exogenous MeJA, and the qualitative and quantitative analysis of related hormones in the treated corn leaves by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). 【Result】Compared with the control, after feeding on corn leaves treated with MeJA, the body weight of the 6th instar M. separata larvae was reduced by 11.67%, the pupal weight was reduced by 18.20%, the emergence rate was reduced by 7.35%, the adult survival time was shortened by 0.93 d, and the pupal period was extended by 0.27 d. The fluorescence quantitative PCR detection results showed that after 24 h of exogenous MeJA treatment, the expression of ZmLox gene was significantly up-regulated (P<0.05, the same below), reaching 5.57 times that of the control; ZmAos gene expression increased significantly after treatment for 12 h, then it decreased to the level of the control after 24 h. The expression of ZmAoc gene and ZmOpr gene did not change significantly at 12 and 24 h after treatment(P>0.05,the same below). UPLC-MS/MS qualitative and quantitative analysis results showed that after spraying MeJA for 24 h, the content of dihydrojasmonic acid (H2JA) in corn leaves increased significantly, which was 5.67 times that of the control. While there was no significant difference in the content of jasmonic acid (JA), jasmonic acid-isoleucine(JA-ILE) and MeJA. 【Conclusion】Spraying of MeJA induces corn defense ability and affects the growth and development of the M. separata. The induced expression of ZmLox and the production of hormone H2JA would be an important mechanism of corn resistance to insects.
Key words: methyl jasmonate; Zea mays L.; Mythimna separata; gene expression; hormone detection
Foundation item: National Key Research and Development Program of China(2018YFD201100); National Mo-dern Agriculture Industry Technology System Construction Project (CARS-17)
0 引言
【研究意义】粘虫(Mythimna separate)又名行军虫,属鳞翅目夜蛾科,主要危害玉米、水稻、小麦和甘蔗等禾本科作物,具有杂多食性、间歇性暴发的特征,其适应力极强,喜欢高温高湿环境,每年有4~5次大范围迁飞过程(Kong et al.,2019),在我国除新疆外其他各省(区、市)均有发生为害。玉米(Zea mays L.)作为我国重要的粮食作物之一,其生长过程中也不可避免地受到各种害虫的侵扰,对玉米产量带来极大影响。近年来,随着气候条件、种植结构及自身适应性等的变化,粘虫在我国的发生程度有明显加重趋势。目前生产上主要通过喷施化学药剂防治粘虫(谢桂艳,2018),但长期使用农药等化学试剂,不仅会造成环境污染,还会增强粘虫自身的耐药性,从而降低化学药剂对粘虫的防治效果。植食性昆虫对农作物的健康生长带来了极大影响,而利用植物自身抗性抵抗害虫取食则是最为环保和最具应用前景的防治方法之一,也是未来害虫防治的发展方向。【前人研究进展】植物在长期的进化过程中,为抵抗各种植食性动物的取食,形成了包括次生代谢产物调控、形态结构上特化等多种方式抵抗植食性动物(Qiao et al.,2019)。植物诱导抗病技术的常见措施包括交叉保护、根际微生物诱导产生抗性和直接施加激发子3种方法(孟澍雨等,2018)。目前已知的植物次生代谢物质超过10万种,其主要为含氮化合物、萜类和甾类化合物以及包括简单酚类、类黄酮、醌类等在内的酚类化合物(刘陈玮等,2019;吴波等,2019),这些植物次生代谢物质有的能对植食性动物的进食、生长、发育和繁殖等生命行为产生干扰,甚至可毒杀部分幼虫。现有对玉米抗虫机制的研究表明,玉米抗虫性主要体现在玉米生理生化抗性和物理形态抗性两个方面(郭井菲等,2018)。而利用茉莉酸(Jasmonic acid,JA)或茉莉酸甲酯(Methyl jasmonate,MeJA)诱导植物产生抗虫性已有相关研究报道(Markowski et al.,2019)。外源對杨树和烟株喷施MeJA可显著降低杨扇舟蛾和斜纹夜蛾的生存能力(席征等,2007;周艳琼,2011);MeJA处理玉米幼苗能降低亚洲玉米螟的发育速率(王友超等,2018);外源MeJA能诱导菊花产生抗蚜虫性(樊婕,2020);用0.0225 mmol/L外源MeJA处理蕃茄植株,可通过降低营养物质含量、提高次生代谢产物含量以及蛋白防御酶活性来增加番茄对烟粉虱的抗性(张晓霞等,2020)。上述研究结果仅揭示了一个客观现象,未对植物诱导的抗虫机制进行深入研究。茉莉酸类物质作为植物体内的内源调节激素,对植物生长发育及植物对逆境胁迫的响应起着重要作用。植物的茉莉酸通路是由α-亚麻酸在13-脂氧合酶作用下生成13S-氢过氧亚麻酸,接着在丙二烯氧合酶作用下转换成丙二烯氧化物,然后经过丙二烯氧合环化酶反应生成12-氧-植物二烯酸,再经过还原酶的3轮β-氧化生成茉莉酸,最后在茉莉酸甲基转移酶(JMT)作用下生成MeJA或其他物质(蒋科技等,2010)。【本研究切入点】近年来有研究发现外源喷施MeJA可诱导植物产生免疫反应,生成防御蛋白、挥发性物质以及诱导形成防御结构(张知晓等,2018;姚岭柏等,2020),从而表现出一定的抗虫性(巩莎,2012),而其本身对植食性昆虫则无直接毒害作用。植物的防御反应通常是由于其受到外界刺激而启动体内相关防御基因的表达,最终提高相关防御代谢产物的形成。目前在玉米上尚无相关研究报道。【拟解决的关键问题】研究取食经外源MeJA诱导的玉米对粘虫生长发育的影响,并通过检测玉米体内茉莉酸通路相关基因的表达量及茉莉酸类激素的变化,以阐明玉米在MeJA胁迫下的防御应答反应,揭示玉米相关抗虫机制,为利用植物自身抗性进行害虫防治提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试玉米 供试玉米品种为郑单95,玉米种子在实验室内自然光下20~25 ℃盆栽种植,待生长至4叶期时供试。
1. 1. 2 供试虫源 供试虫源为实验室内人工饲养繁育的粘虫。粘虫卵在光照培养箱中(23±1)℃、相对湿度(70%~75%)、光周期(16L∶8D)条件下孵化,选择刚孵化大小及形态发育一致的1龄幼虫作为试验用虫。
1. 2 玉米苗处理
配置100 μmol/L的MeJA溶液,待玉米长到4叶期,对拟需要接虫处理的玉米提前24 h整株喷施约5 mL的MeJA溶液,喷完后用塑料袋封闭,置于26 ℃培养箱中待用。以喷施无菌水为对照。
1. 3 粘虫生长发育观察
1. 3. 1 粘虫接种与记录 将初孵幼虫分别接到对照组与试验组玉米苗上,每盆玉米苗接30头幼虫,第2 d分别再将所有可见的粘虫转移至新处理过的玉米苗上,每日均重复将粘虫转移至新鲜处理过的玉米苗上。每天观察记录粘虫生长发育和存活情况,直到所有粘虫化蛹或死亡。随机从2、4和6龄试验组和对照组粘虫幼虫各抽取15头称重;待所有幼虫化蛹后,收集试验组和对照组中所有的蛹称量;蛹置于光照培养箱中等待羽化,羽化后的成虫仅提供清水,观察记录蛹期的时间及对应成虫的存活天数。所有昆虫均在(26±1)℃、相对湿度(70%~75%)、光周期(16L∶8D)下的光照培养箱中饲养。
化蛹率(%)=化蛹数/试虫总数×100
羽化率(%)=羽化成虫数/试虫总数×100
1. 3. 2 统计分析 运用SPSS 18.0对试验数据进行方差分析,采用ANOVA对粘虫幼虫体重、蛹重和成虫存活时间等进行方差分析。
1. 4 玉米植株茉莉酸通路上相关基因的表达分析
1. 4. 1 处理后玉米叶片取样 接虫前分别从MeJA处理和对照处理后12和24 h的每株玉米植株上随机摘取3片叶片放入液氮瓶中,置于-80 ℃保存,备用。
1. 4. 2 相关基因的表达分析 采用TRIzol试剂(Magen公司)提取玉米叶片总RNA,用Prime Script RT Master Mix Perfect Real Timewith DNA Earser(TaKaRa公司)试剂盒合成cDNA。在玉米基因组网站(https://maizegdb.org/)查找相关基因序列,根据目的基因的序列,利用Beacon designer 8设计定量的PCR引物(表1)。荧光定量PCR反应采用SYBR?Permix ExTaqTM试剂盒(南京诺唯赞生物科技股份有限公司),根据说明书进行反应液配置和试验。对所得试验结果进行数据分析,采用2-ΔΔCt分析计算各基因的相对表达量。
1. 5 玉米植株相关激素测定
取样保存方法同1.4.1,送至武汉迈特维尔生物科技有限公司进行茉莉酸通路上4种激素[JA、MeJA、二氢茉莉酸(H2JA)和茉莉酸—异亮氨酸(JA-ILE)]。试验流程大致为:先称取50 mg研磨后的样本,加入适量内标,用甲醇∶水∶甲酸=15∶4∶1(V∶V∶V)进行提取,提取液浓缩后用100 μL 80%甲醇—水溶液复溶,过0.22 μm PTFE滤膜,置于进样瓶中,最后用超高效液相色谱—串联质谱(UPLC-MS/MS)对相关激素进行定性和定量分析(Fang et al.,2016)。
2 结果与分析
2. 1 取食MeJA处理的玉米对粘虫幼虫体重和蛹重的影响
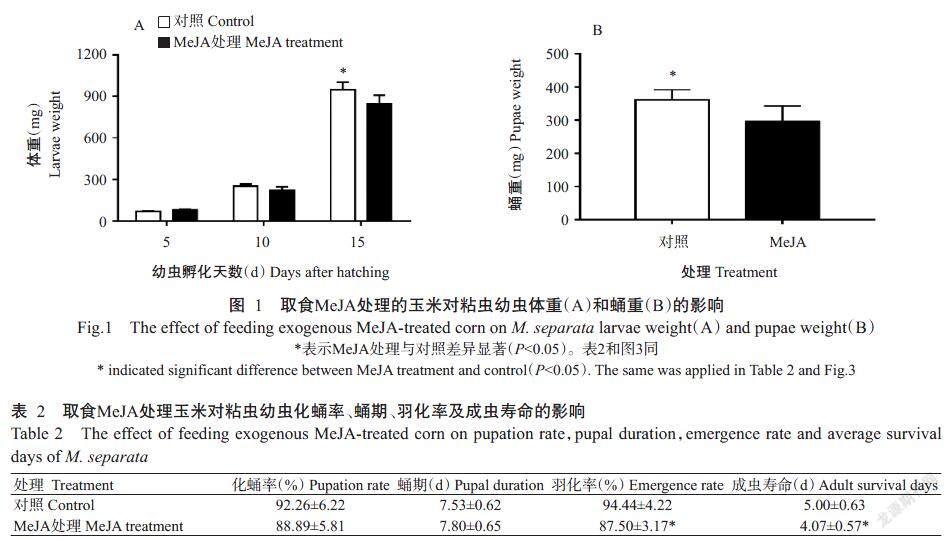
对取食玉米叶片的粘虫进行连续观察,分别对孵化后第5、10、15 d的2、4和6龄粘虫幼虫进行体重称量,结果(图1-A)显示,短期取食经MeJA处理的玉米叶片对粘虫的体重无明显影响,2和4龄粘虫幼虫体重MeJA处理与对照无显著差异(P>0.05,下同),但4龄期的MeJA处理粘虫平均体重略低于对照;连续取食15 d后,取食MeJA处理玉米叶片的6龄粘虫幼虫体重显著降低(P<0.05,下同),比对照轻11.67%。
连续喂养粘虫直至化蛹,收集MeJA处理和对照的粘虫蛹进行称量,结果(图1-B)显示,MeJA处理粘虫蛹重显著低于对照,较对照轻18.20%。
2. 2 取食MeJA处理的玉米对粘虫化蛹率、蛹期、羽化率及成虫寿命的影响
由表2可知,取食MeJA处理玉米叶片对粘虫的化蛹率和蛹期无显著影响,但化蛹率较对照低3.65%,而蛹期较对照延长0.27 d;取食MeJA处理玉米叶片对粘虫的羽化率和成虫寿命有显著影响,羽化率较对照低7.35%,成虫寿命较对照短0.93 d。
2. 3 玉米植株茉莉酸合成通路中相关基因的表达
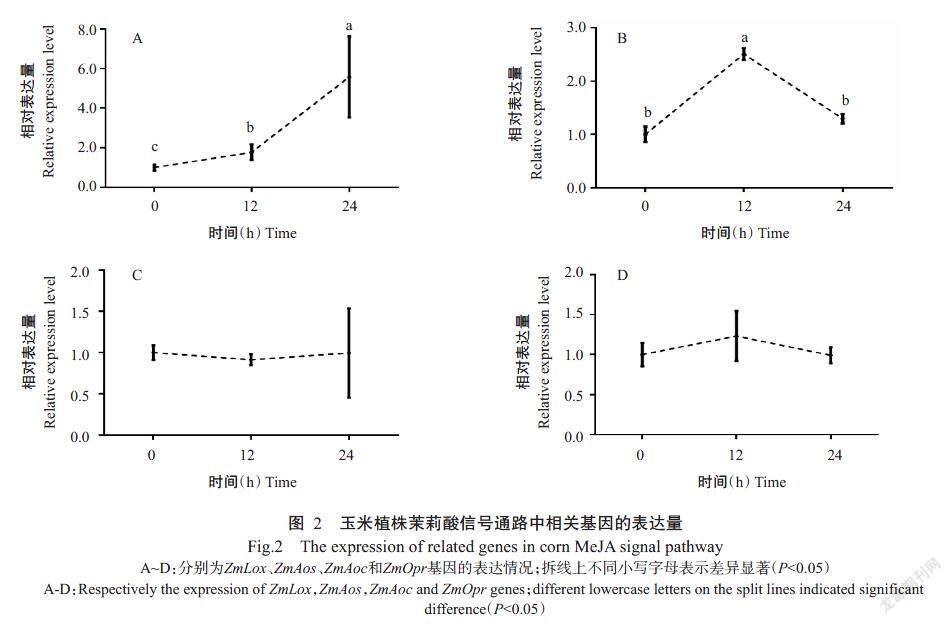
用100 μmol/L的MeJA喷施玉米叶片12和24 h后分别检测茉莉酸通路上相关基因的表达量,结果显示,外源MeJA胁迫下,ZmLox基因的表达量变化较大,处理12和24 h后的ZmLox基因表達量显著增加,分别是对照的1.78和5.57倍(图2-A);经MeJA处理12 h后ZmAos基因的表达量显著增加,24 h后明显下降,分别是对照的2.51和1.29倍(图2-B);经MeJA处理12和24 h后的ZmAoc基因表达量无显著变化,分别是对照的91%和1.00倍(图2-C);经MeJA处理12和24 h后的ZmOpr基因表达量无显著变化,分别是对照的1.23倍和99%(图2-D)。
2. 4 喷施外源MeJA后玉米叶片中相关激素的检测结果
通过UPLC-MS/MS定性定量分析,结果(图3)表明,与对照相比,喷施外源MeJA 24 h后,玉米叶片中H2JA含量显著增加,为对照的5.67倍;而茉莉酸通路上其他相关激素[JA、JA-ILE和MeJA]含量轻微下降,但未达显著差异水平。
3 讨论
植物体内的多种次生代谢物质已被证实具有良好的抵御外界各种生物胁迫的功能,目前以JA为代表的植物激素在农业生产上已逐渐开始应用于植物病害防治(Oka et al.,2013;Cao et al.,2016)。植物在外源MeJA刺激下,植物体的内源茉莉酮酸含量会迅速增加,内源茉莉酮酸信号分子的传导作用直接激活植物体内的多酚氧化酶(PPO)、丙二烯氧合酶(AOS)和过氧化物酶(POD)等酶活性,从而产生具有特异性的蛋白酶抑制剂和植物防卫素等次生代谢产物(桂连友,2005;王云锋等,2019),以达到增强植物自身抵抗逆境的目的。研究发现外源茉莉酸类物质喷施水稻(吴莹莹,2008)、长白落叶松(姜礅等,2016)和棉花(马广民等,2018)后,能分别抑制褐飞虱、舞毒蛾、棉蚜及斜纹夜蛾的生长发育。本研究发现,粘虫取食了喷施MeJA溶液的玉米叶片后其体重降低且蛹期延长,同时对粘虫的羽化率及成虫寿命均有显著影响。说明外源喷施MeJA能有效提升植物的抗虫能力,对植食性昆虫的生长发育带来负面影响。
JA作为多个植物激素的核心组分,参与多个植物激素信号共同调节植物的生长发育和胁迫响应(Ahmad et al.,2016;Wasternack and Strnad,2016)。为进一步研究喷施MeJA提升玉米抗虫的机理,本研究对玉米茉莉酸通路上几个重要基因进行荧光定量PCR检测,结果显示,外源MeJA处理后ZmAos基因和ZmOpr基因的表达量在12 h内呈现上调趋势后下降,ZmLox基因的表达量在24 h内上调趋势变大,表明外源MeJA激活了JA合成及其信号通路。本研究结果表明,在外源MeJA胁迫下,ZmLox基因持续高表达,说明位于茉莉酸通路上游的脂氧合酶基因受到MeJA的影响最直接,也意味着玉米体内的脂氧合酶可能会持续发挥作用,从而促进下游的物质合成转化。在甘蔗、小麦和水稻的研究中也发现,外源喷施MeJA显著提高了甘蔗、小麦和水稻的Lox基因表达(马超,2013;王亚如,2019;李春琴等,2020)。而植物的茉莉酸通路作为植物响应外界刺激的重要信号通路(温小杰等,2010),MeJA对植物茉莉酸通路中相关基因的影响早有报道。吕丽敏等(2018)研究发现,在外源MeJA胁迫下,棉花的GhLox1、GhLox2、GhAos和GhAoc基因均表现出上调表达,作者推测有关JA合成途径的相关基因均受JA类物质的诱导并参与了JA及其衍生物合成过程,起到正反馈调节作用。本研究结果与吕丽敏等(2018)的结果不完全相同,本研究发现外源MeJA胁迫后12和24 h,仅有ZmLox和ZmAos基因有正反馈调节的趋势,而其他2个茉莉酸通路中的基因未表现出显著变化;同时发现外源MeJA胁迫后12和24 h仅有ZmLox基因持续高表达,ZmAos的表达量呈先上升后下降的变化趋势。通常来说,茉莉酸通路对外界刺激较敏感,能在较短时间内对外界刺激做出响应,因此推测这些低表达的基因可能与本研究所选择的时间点存在密切关系。此外,植物体内基因调节可能涉及多个过程,并不是某个代谢通路上所有基因都显著上调才能引起最终产物的变化。刘靖(2011)研究表明,MeJA对于同一抗病基因,在不同品种中的相关基因激活速度和强度也不尽相同。说明植物的基因调节过程较复杂,对外界刺激所产生的基因表达调控反应与刺激类型、刺激强度和植物种类均密切相关,即使是同种刺激在不同植物中的防御反应也可能存在较大差异。
当植物受到外界环境胁迫时,为抵御不良环境,植物本身会调节自身体内的相关激素含量,如乙烯和JA参与盐胁迫对水稻种子根生长的抑制作用(刘莉,2018);在干旱胁迫下,为调控甘薯内源激素含量,应在生长前期喷施6-BA,可提高光合特性,有效缓解干旱造成的产量损失(王金强等,2020)。近年来的研究表明,为启动对生物胁迫的防御应答,植物激素JA可降解茉莉酸途径的抑制因子JAZ(Jasmonate ZIM-domain,JAZ)蛋白释放MYC2和EIN3等转录因子;而脱落酸则通過去抑制化SnRK2激酶,从而磷酸化下游的转录因子和离子通道蛋白,促进对非生物胁迫的应答(孙凯文,2019)。本研究发现在外源MeJA胁迫24 h后,通过UPLC-MS/MS对茉莉酸通路上的4种激素MeJA、JA、H2JA和JA-ILE进行定性定量分析,结果显示MeJA、JA-ILE和JA的含量与对照组相比无显著差异,而H2JA含量显著增加,说明玉米在外界环境胁迫下,可通过调节体内激素以提高自身的防御作用。H2JA在植物体内主要以其衍生物二氢茉莉酸甲酯和二氢茉莉酸酯形式存在并发挥作用,对植物生长、果实品质提升及植株的抗性等均有重要影响(汪磊等,2007;何平等,2019)。前人研究结果显示,外源接种病毒能引起植物体内JA和H2JA含量上升,从而提高植物抗性,推测这种JA和H2JA水平的升高,可能是由于病毒诱导细胞膜破裂,提升亚麻酸的释放,从而提高相应防御物质的含量(Clarke et al.,2000)。推测H2JA的含量上升,可能对粘虫的生长发育具有不良影响。本研究中仅发现1种植物激素显著上调,而结合定量PCR基因表达检测结果可看出,在外源MeJA胁迫24 h后相关的ZmLox和ZmAos基因依旧上调表达,推测植物激素的调节是一个复杂过程,因此未来可通过缩短或延长取样时间,进一步全面检测外源刺激下茉莉酸通路上的激素表达,从而确定植物激素防御的相关机制。此外,目前尚无H2JA在植物防御中作用和机制的报道,因此未来还需对H2JA的作用进行深入研究,从而揭示其在植物防御过程中所扮演的角色。
4 结论
粘虫取食经外源MeJA诱导的玉米叶片后,其体重、蛹重和成虫寿命均明显下降;进一步研究发现MeJA诱导的玉米叶片中茉莉酸合成通路上ZmLox基因持续高表达,而该通路中下游的H2JA激素大量生成。推测ZmLox基因的显著表达和激素H2JA的产生可能是玉米抗虫的一个重要机制。
参考文献:
樊婕. 2020. 茉莉酸甲酯对菊花抗蚜性的影响机理研究[D]. 泰安:山东农业大学. [Fan J. 2020. Study on the effect of methyl jasmonate on aphid resistance of Chrysanthemum[D]. Taian:Shandong Agricultural University.] doi:10.27277/d.cnki.gsdnu.2020.000713.
巩莎. 2012. MeJA对枣树抗虫性的诱导及其对日本龟蜡蚧的影响[D]. 太原:山西大学. [Gong S. 2012. The insect resistance of the jujube tree induced by MeJA and its impact on the pest Japanese wax scale[D]. Taiyuan: Shanxi University.]
桂连友. 2005. 外源茉莉酸甲酯对茶树抗虫作用的诱导及其机理[D]. 杭州:浙江大学. [Gui L Y. 2005. Resistance of tea plant to insect pestsinduced by exogenous methyl jasmunate and its mechanism[D]. Hangzhou: Zhejiang University.]
郭井菲,何康来,王振营. 2018. 玉米对钻蛀性害虫的抗性机制研究进展[J]. 中国生物防治学报,30(6):807-816. [Guo J F,He K L,Wang Z Y. 2018. Research prospects in corn resistance mechanisms to corn borers[J]. Chinese Journal of Biological Control,30(6):807-816.] doi:10. 16409/j.cnki.2095-039x.2014.06.002.
何平,李林光,王海波,常源升. 2019. 茉莉酸酯类对秋甜桃果实着色及品质的影响[J]. 分子植物育种,17(7):2371-2378. [He P,Li L G,Wang H B,Chang Y S. 2019. Effects of jasmonates on coloration and quality of qiutian peach[J]. Molecular Plant Breeding,17(7):2371-2378.] doi:10.13271/j.mpb.017.002371.
姜礅,王杰,姜虹,张文一,孟昭军,严善春. 2016. 茉莉酸甲酯局部诱导长白落叶松对舞毒蛾生长发育的影响[J]. 北京林业大学学报,38(6): 67-71. [Jiang D,Wang J,Jiang H,Zhang W Y,Meng Z J,Yan S C. 2016. Effects of locally inducing Larix olgensis using exogenous methyl jasmonate on the growth and development of Lymantria dispar[J]. Journal of Beijing Forestry University,38(6): 67-71.] doi:10.13332/j.1000-1522.20150493.
蒋科技,皮妍,侯嵘,唐克轩. 2010. 植物内源茉莉酸类物质的生物合成途径及其生物学意义[J]. 植物学报,45(2):137-148. [Jiang K J,Pi Y,Hou R,Tang K X. 2010. Jasmonate biosynthetic pathway: Its physiological role and potential application in plant secondary metabolic engineering[J]. Chinese Bulletin of Botany,45(2):137-148.] doi: 10.3969/j.issn.1674-3466.2010.02.001.
李春琴,段桂花,马笑晴,刘文倩,唐萍,杨静. 2020. 外源茉莉酸对稻瘟病菌引起褐点型坏死斑的水稻防御响应的影响[J]. 南方农业学报,51(5):1053-1061. [Li C Q,Duan G H,Ma X Q,Liu W Q,Tang P,Yang J. 2020. Effects of exogenous jasmonic acids on defense response of resistant rice during the formation of brown necrotic spotscaused by Magnaporthe oryzae infection[J]. Journal of Southern Agriculture,51(5):1053-1061.] doi:10.3969/j.issn.2095-1191.2020.05.009.
刘陈玮,陈素梅,郑丽. 2019. 园艺作物挥发物合成及其生物学功能研究进展[J]. 江苏农业学报,35(6): 1506-1512. [Liu C W,Chen S M,Zheng L. 2019. Research progress on the synthesis and biological function of horticultural crops volatiles[J]. Jiangsu Journal of Agricultural Scien-ces,35(6):1506-1512.] doi:10.3969/j.issn.1000-4440. 2019.06.033.
刘靖. 2011. 茉莉酸甲酯诱导的小麦白粉病抗性和9个抗病相关基因表达间的关系[D]. 郑州:河南农业大学. [Liu J. 2011. The relationship between powdery mildew resistance induced by methyl jasmonate and the expression of nine disease resistance related genes of whate[D]. Zhengzhou:Henan Agricultural University.]
刘莉. 2018. 盐胁迫下植物激素对水稻种子萌发及幼苗根系生长的调控机理研究[D]. 武汉:华中农业大学. [Liu L. 2018. The regulation and mechanism of phytohormone on rice seed germination and seeding root growth under salinity[D]. Wuhan:Huazhong Agricultural University.]
吕丽敏,张帅,雒珺瑜,王春义,王丽,朱香镇,张利娟,李春花,崔金杰. 2018. 甜菜夜蛾和茉莉酸甲酯处理对棉花茉莉酸合成途径关键基因及萜类合酶基因表达的影响[J]. 植物生理学报,54(4):636-644. [Lü L M,Zhang S,Luo J Y,Wang C Y,Wang L,Zhu X Z,Zhang L J,Li C H,Cui J J. 2018. Effects of beet armyworm feeding and methyl jasmonate treatment on transcription levels of key genes involved in the biosynthesis pathway of jasmonic acid and terpene synthase in cotton[J]. Plant Physiology Journal,54(4):636-644.] doi:10.13592/j.cnki.ppj.2017. 0421.
馬超. 2013. 外源茉莉酸甲酯对干旱胁迫下小麦抗旱响应的调控效应研究[D]. 郑州:河南农业大学. [Ma C. 2013. Regulating effect of exogenous methyl jasmonate on response to drought resistance of wheat[D]. Zhengzhou: Henan Agricultural University.]
马广民,刘守柱,杜学林,戴明勋,袁凤英,门兴元. 2018. 外源茉莉酸甲酯诱导的棉花防御对棉蚜及斜纹夜蛾发育的影响[J]. 应用昆虫学报,55(3): 339-406. [Ma G M,Liu S Z,Du X L,Dai M X,Yuan F Y,Men X Y. 2018. Effect of exogenous MeJA treatment of cotton on the development of Aphis gossypii(Hemiptera: Aphididae) and Spodoptera litura[J]. Chinese Journal of Applied Entomology,55(3): 339-406.] doi: 10.7679/j.issn.2095-1353. 2018.052.
孟澍雨,高俊山,张玉琼,刘亚军. 2018. 植物诱导抗病技术在病害防治领域的应用[J]. 生物学杂志,35(3):92-98. [Meng S Y,Gao J S,Zhang Y Q,Liu Y J. 2018. The application of plant induced resistance technology in disea-se control[J]. Journal of Biology,35(3):92-98.] doi:10. 3969/j.issn.2095-1736.2018.03.092.
孙凯文. 2019. 植物激素脱落酸对茉莉酸介导的防御反应的调控[D]. 南京:南京师范大学. [Sun K W. 2019. Regulation of plant hormone abscisic acid on jasmonic acid mediated defense response[D]. Nanjing:Nanjing Normal University.] doi:10.27245/d.cnki.gnjsu.2019.001050.
王金强,李欢,刘庆,曾路生. 2020. 干旱胁迫下喷施外源植物激素对甘薯生理特性和产量的影响[J]. 应用生态学报,31(1):189-198. [Wang J Q,Li H,Liu Q,Zeng L S. 2020. Effects of exogenous plant hormones on physiological characteristics and yield of sweet potato under drought stress[J]. Chinese Journal of Applied Ecology,31(1):189-198.] doi:10.13287/j.1001-9332.202001.026.
汪磊,杨特武,张加路,万家友,骆炳山. 2007. 二氢茉莉酸丙酯对发育进程中小麦种子萌发的影响[C]//湖北省植物生理学会第十五次学术研讨会论文集:74-83. [Wang L,Yang T W,Zhang J L,Wang J Y,Luo B S. 2007. Effects of PDJ on the germination of developing caryopsis of wheat[C]//Proceedings of the 15th Symposium of Hubei Society of Plant Physiology:74-83.]
王友超,王娅丽,张一桐,杨泽众,刘春光,付海燕,杨峰山. 2018. 外源MeJA诱导玉米抗性对亚洲玉米螟生物学特性的影响[J]. 中国农学通报,34(35):98-104. [Wang Y C,Wang Y L,Zhang Y T,Yang Z Z,Liu C G,Fu H Y,Yang F S. 2018. Effects of exogenous methyl jasmonate induced maize defense responses onbiological characteristics of Asian corn borer(Ostriniafurnacalis)[J]. Chinese Agricultural Science Bulletin,34(35):98-104.]
王云锋,李春琴,韩光煜,王长秘,刘林,李晓疆,李晓杰,杨静. 2019. 茉莉酸不同方式处理水稻对稻瘟病的防控效果及对水稻防御体系的影响[J]. 南方农业学报,50(3):562-569. [Wang Y F,Li C Q,Han G Y,Wang C M,Liu L,Li X J,Li X J,Yang J. 2019. Effect of different treatments of jasmonic acid on rice blast disease control and its effect on rice defense system[J]. Journal of Southern Agriculture,50(3):562-569.] doi:10.3969/j.issn.2095-1191.2019.03.17.
王亚如. 2019. 粘虫取食与MeJA胁迫下甘蔗内源抗虫相关基因的筛选与克隆[D]. 福州:福建农林大学. [Wang Y R. 2019. Screening and molecular cloning of sugarcane endogenous insect-resistant genes in response to Mythirnna separata feeding and MeJA stress[D]. Fuzhou:Fujian Agriculture and Forestry University.]
温小杰,张学勇,郝晨阳,蒲文,刘旭. 2010. 植物激素信号传导途径研究进展[J]. 中国农业科技导报,12(6):10-17. [Wen X J,Zhang X Y,Hao C Y,Pu W,Liu X. 2010. Research progresson plant horm one signal pathways[J]. Journal of Agricultural Science and Technology,12(6):10-17.] doi:10.3969/j.issn.1008-0864.2010.06.03.
吴波,程杏安,蔣旭红,刘展眉. 2019. 苦参碱农用活性及其结构修饰研究进展[J]. 江苏农业科学,47(8):123-129. [Wu B,Cheng X A,Jiang X H,Liu Z M. 2019. Research progress on agricultural activity and structure modification of Matrine[J]. Jiangsu Agricultural Science,47(8):123-129.] doi:10.15889/j.issn.1002-1302.2019.08.028.
吳莹莹. 2008. 茉莉酸甲酯诱导水稻后对褐飞虱的抗性研究[D]. 南宁:广西大学. [Wu Y Y. 2008. Studies on resistance of rice induced by methyl jasmonate to rice brown planthopper[D]. Nanning:Guangxi University.]
席征,程新胜,杨丽文,王方晓. 2007. 茉莉酸甲酯诱导烟草抗斜纹夜蛾的作用[J]. 烟草科技,(3):51-55. [Xi Z,Cheng X S,Yang L W,Wang F X. 2007. Effects of methyl jasmonate induced tobacco resistance to Spodopteralitura[J]. Tobacco Science & Technology,(3):51-55.] doi:10.3969/j.issn.1002-0861.2007.03.014.
谢桂艳. 2018. 东北地区玉米主要病虫害防治技术[J]. 乡村科技,(28):95-96. [Xie G Y. 2018. Control technology of main corn diseases and insect pests in Northeast China[J]. Xiangcun Keji,(28):95-96.] doi:10.19345/j.cnki. 1674-7909.2018.28.048.
姚岭柏,徐松鹤,郭美兰,王菁,任琴. 2020. 不同施钾量对马铃薯抗蚜虫能力的影响[J]. 河南农业科学,49(3):107-112. [Yao L B,Xu S H,Guo M L,Wang J,Ren Q. Effect of different potassium supply on the aphid resistance of potato[J]. Journal of Henan Agricultural Sciences.] doi:10.15933/j.cnki.1004-3268.2020.03.014.
张晓霞,洪波,景亮亮,曹爽,贾彦霞. 2020. 外源茉莉酸甲酯诱导番茄对烟粉虱的抗虫性[J]. 生态学杂志,39(11): 3651-3657. [Zhang X X,Hong B,Jing L L,Cao S,Jia Y X. 2020. Insect resistance of tomato induced by exogenous methyl jasmonate to Bemisia tabaci[J]. Chinese Journal of Ecology,39(11): 3651-3657.] doi:10.13292/j.1000-4890.202011.026.
张知晓,泽桑梓,户连荣,刘凌,季梅. 2018. 茉莉酸甲酯生物活性研究进展[J]. 河南农业科学,47(11):1-7. [Zhang Z X,Ze S Z,Hu L R,Liu L,Ji M. 2018. Research advance in biological activities of methyl jasmonate[J]. Journal of Henan Agricultural Sciences,47(11):1-7.] doi:10. 15933/j.cnki.1004-3268.2018.11.001.
周艳琼. 2011. 茉莉酸甲酯对杨树诱导抗性的研究[D]. 南京:南京林业大学. [Zhou Y Q. 2011. Studied on resistance of poplar induced by methyl jasmonate[D]. Nanjing: Nanjing Forestry University.]
Ahmad P,Rasool S,Gul A,Sheikh S A,Akram N A,Ashraf M,Kazi A,Gucel S. 2016. Jasmonates:Multifunctional roles in stress tolerance[J]. Frontiers in Plant Science,7: 813. doi: 10.3389/fpls.2016.00813.
Cao J J,Li M Y,Chen J,Liu P,Li Z. 2016. Effects of MeJA on Arabidopsis metabolome under endogenous JA deficiency[J]. Scientific Reports,6(1): 37674. doi: 10.1038/srep37674.
Clarke S F,Guy P L,Jameson P E,Schmierer D,Burritt D J. 2000. Influence of white clover mosaic potexvirus infection on the endogenous levels of jasmonic acid and rela-ted compounds in Phaseolus vulgaris L. seedlings[J]. Journal of Plant Physiology,156(4):433-437. doi: 10.1016/S0176-1617(00)80155-8.
Fang L C,Su L Y,Sun X M,Li X B,Sun M X,Karungo K,Fang S,Chu J F,Li S H,Xin H P. 2016. Expression of Vitis amurensis NAC26 in Arabidopsis enhances drought tolerance by modulating jasmonic acid synthesis[J]. Journal of Experimental Botany,67(9):28-45. doi:10.1093/jxb/erw122.
Kong H L,Dong C L,Jing W H,Zheng M Y,Tian Z,Hou Q L,Wang C,Cheng Y X,Zhang L,Jiang X F,Luo L Z,Zhu S D. 2019. Transcriptomic insight into antimicrobial peptide factors involved in the prophylactic immunity of crowded Mythimna separata larvae[J]. Developmental and Comparative Immunology,98:34-41. doi: 10.1016/j.dci.2019.02.009.
Markowski M,D?ugosz M,Szakiel A,Durli M,Poinsignon S,Bouguet-Bonnet S,Vernex-Loset L,Krier G,Henry M. 2019. Increased synthesis of a new oleanane-type saponin in hairy roots of marigold (Calendula officinalis) after treatment with jasmonic acid[J]. Natural Product Research,33(8):1218-1222. doi: 10.1080/14786419.2018. 1460840.
Oka K,Kobayashi M,Mitsuhara I,Seo S. 2013. Jasmonic acid plays a negative role in resistance to tobacco Mosaic virus in tobacco[J]. Plant & Cell Physiology,54(12):1999-2010.
Qiao D H,Yang C,Chen J,Guo Y,Li Y,Niu S Z,Cao K M,Chen Z W. 2019. Comprehensive identification of the full-length transcripts and alternative splicing related to the secondary metabolism pathways in the tea plant (Camellia sinensis)[J]. Scientific Reports,9(1):239-248. doi: 10.1038/s41598-019-39286-z.
Wasternack C,Strnad M. 2016. Jasmonate signaling in plant stress responses and development-active and inactive compounds[J]. New Biotechnology,33(5):604-613. doi:10. 1016/j.nbt.2015.11.001.
(責任编辑 麻小燕)

