剑叶龙血树内生真菌的分离及体外抑菌活性筛选
赵玉瑛 黄之镨 张琼 赵庆 柏叶涛 张晓梅


摘 要: 为研究剑叶龙血树内生真菌资源多样性,初步探討和筛选具有抑菌活性的特异性菌株以及进一步开发剑叶龙血树内生真菌的抗菌活性化合物。该文采用植物组织分离法从剑叶龙血树茎和叶中分离内生真菌,对内生真菌进行液体发酵7 d,经乙酸乙酯萃取后制得粗提物,并采用牛津杯扩散法,以10种常见病原菌和5种临床耐药菌为靶标检测其发酵粗提物的抑菌活性,对有较好抑菌活性的内生真菌进行分子鉴定。结果表明:(1)从剑叶龙血树茎、叶中共分离得到345株内生真菌,294株对一种以上指示菌有抑制活性;(2)其中84株内生真菌对5株临床耐药菌均有不同程度的抑制活性,占所分离菌株总数的24.35%,75%的内生真菌对金黄色葡萄球菌有抑制活性。这说明剑叶龙血树中存在多种有抑菌活性的内生真菌,为剑叶龙血树内生菌抗菌活性成分挖掘及新型抗菌药物筛选奠定了基础。
关键词: 剑叶龙血树, 内生真菌, 分离, 抗菌活性, 真菌鉴定
中图分类号: Q939.9 文献标识码: A 文章编号: 1000-3142(2021)07-1126-09
Abstract: To explore the resource diversity and antimicrobial capability of endophytic fungi from the endangered Dracaena cochinchinensis, and mine novel antimicrobial secondary metabolites from talent strains, endophytic fungi were isolated from stem and leaf tissues of D. cochinchinensis. All isolated strains were cultured in liquid media for seven days, the culture media were extracted with ethyl acetate and then used to estimate the antimicrobial activities against 10 pathogenic bacteria and 5 drug-resistance pathogens by using the oxford-cup test. The results were as follows:(1)345 strains were isolated and 294 of which displayed antimicrobial activities against more than one pathogen;(2)Among them, 84 endophytes(accounted for 24.35%) displayed potent inhibition against 5 drug-resistance pathogens to very degrees and 75% endophytes displayed obvious inhibition against Staphylococcus aureus. Accordingly, 40 talent strains were selected and identified to 32 species by phylogenetic analysis based on ITS sequencing. This study indicated that diverse endophytic fungi with strong antimicrobial activities inhabiting in D. cochinchinensis, which could be potential for developing antimicrobial reagents.
Key words: Dracaena cochinchinensis, endophytic fungi, isolation, antimicrobial activities, fungal identification
抗菌药物的出现给感染性疾病的治疗带来了很大改变,为挽救人类生命做出了很大贡献,但同时也加快了病原菌耐药性形成的速度及多重耐药菌的出现(Schmalstieg et al., 2012;Lewis,2012),如耐甲氧西林金黄色葡萄球菌(MRSA)。目前,抗菌药物开发上市的速度远远赶不上病原菌耐药性发展的速度,这就使得寻找新作用机制或新活性的化合物来开发药物成为迫切需要。从自然界寻找抗菌成分(尤其是抗耐药菌成分),逐渐成为抗菌药物研发的一个重要方面。而普通环境中的微生物作为样本被反复研究和开发,化合物挖掘重复率越来越高。因此,越来越多的研究者把目光投向了特殊环境微生物。
生活在健康的植物组织中,而不会引起宿主植物组织病害症状的真菌称为内生真菌,其广泛存在于不同种类的植物组织内(Tanaka et al., 2002)。植物内生菌是重要的微生物资源,尤其是一些内生真菌在进化过程中能产生与宿主结构相同或相似的活性代谢产物如鬼臼素、长春碱、紫杉醇和姜黄素等(Stierle et al., 1993;张玲琪等,2000;彭清忠等,2010;王婷等,2017),这就意味着从植物内生真菌中挖掘到与宿主植物相同或相似化学成分的潜力极大。由于生存环境的特殊性,因此,使得植物内生真菌具有产生结构丰富多样的活性代谢产物的能力。目前,已从植物内生真菌的代谢产物中分离得到生物碱类、甾体类、黄酮类、多肽类、萜类、环肽类等多种类型的化合物,这些不同类型的化合物具有抗菌、抗肿瘤、抗病毒及酶抑制等多种生物活性(肖支叶等,2018)。由于这些化合物具有开发成抗菌药物的潜力,因此广泛从内生真菌中分离和筛选具有抗菌活性的化合物,可以为新型抗菌药物的研发提供前期实验基础,进而改善日益严重的病原菌耐药性问题。
剑叶龙血树(Dracaena cochinchinensis)系百合科(Liliaceae)龍血树属(Dracaena Vand. ex L.)常绿乔木,在我国主要分布于云南、广西。剑叶龙血树树脂是提取中药要药“龙血竭”的原料,在活血化瘀、敛疮止血等方面具有较强的疗效,药效主要成分为龙血素A和龙血素B(蔡希陶和许再富,1979)。由于剑叶龙血树生长环境恶劣,生长缓慢且产量较低,采集龙血竭入药使得野生资源面临着枯竭的威胁,现已被列为国家二级保护植物。为合理利用剑叶龙血树资源,虽然近年来对剑叶龙血树主成分的抗氧化活性、结血诱导剂的筛选、疏松愈伤组织诱导等方面进行了研究(周艳林等,2015;韦莹等,2016;陈乾平等,2018),但对剑叶龙血树内生真菌抗菌活性的研究却鲜有报道。本研究针对此现象进行了以下研究:对剑叶龙血树内生真菌进行了分离及其抑菌活性研究,以期获得具有抗菌活性的特异性菌株;为下一步从抑菌活性菌株中挖掘活性成分奠定基础;为剑叶龙血树的综合利用、新药开发提供前期实验研究基础;也为解决传统民族药用植物资源紧缺提供新的思路。
1 材料与方法
1.1 材料、仪器和试剂
1.1.1 药材 剑叶龙血树茎、叶于2016年1月采自云南省西双版纳勐腊县勐仑镇(样品编号为B)、云南省热带作物科学研究所-西双版纳热带花卉园(样品编号RJ为茎、RY为叶),采集时,戴上无菌手套用无菌工具将剑叶龙血树健康的茎、叶采集后放入无菌的容器内,4 ℃保存备用。材料由曹旸博士提供和鉴定。
1.1.2 仪器和试剂 仪器:GR-200 分析天平,广州艾欣科学仪器有限公司;ES-315 高压蒸汽灭菌锅,TOMY 公司;恒温培养箱,上海一恒科学仪器有限公司;LRH-250 生化培养箱,上海一恒科学仪器有限公司;N-1100 旋转蒸发仪,上海爱朗仪器有限公司;SW-CJ-2FD 洁净工作台,AIRTECH 公司;电热恒温鼓风干燥箱,上海一恒科技有限公司;培养基配料等常用试剂耗材均购自雅云生物科技有限公司。试剂:蒸馏水,无水乙醇、甲醇、冰乙酸、乙酸乙酯、丙酮等均为分析纯,通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)由生工生物工程(上海)股份有限公司合成。其他:柱式真菌基因组 DNA 抽提试剂盒从生工生物工程(上海)股份有限公司购买。
1.1.3 指示菌 大肠杆菌(Escherichia coli ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus ATCC 25923)、枯草芽孢杆菌(Bacillus subtilis ATCC 6633)、铜绿假单胞菌(Pseudomonas aeruginosa PA01)、鼠伤寒沙门氏菌(Salmonella typhimurium χ 8956)、肺炎克雷伯氏菌(Klebsiella pneumonia ATCC 13883)、白色葡萄球菌(Staphylococcus albus 1029)、耻垢分枝杆菌(Mycobacterium smegmatis 1037)、鲍曼不动杆菌(Acinetobacter baumanii ATCC 19606)、粪肠球菌(Enterococcus faecalis ATCC 29212)、3株耐甲氧西林金黄色葡萄球菌(MRSA 1-3)、2株白色念珠菌的临床耐药菌(Drug-resistant Candida albicans 1-2)。以上供试菌株均由课题组前期研究保存。
1.1.4 培养基 病原细菌培养基 LB:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15 g,水1 L,pH 7.2~7.6。
真菌培养基 (1)沙保氏培养基:蛋白胨10 g,葡萄糖40 g,琼脂15 g,水1 L,pH 6.0;(2)PDA培养基:马铃薯200 g (煮沸20 min 后过滤,弃渣取汁),葡萄糖20 g,琼脂15 g,水1 L,pH 6.0~7.0;(3)PDB培养基:马铃薯200 g (煮沸20 min 后过滤,弃渣取汁),葡萄糖20 g,水1 L,pH 6.0~7.0。
1.2 方法
1.2.1 内生真菌的分离与纯化 将植物样本在流水洗净后,选择没有破损的叶片和茎,切成2 cm左右的小块(段、片),在50%乙醇中浸泡1 min 后置于75%乙醇中1 min;根使用0.10% HgCl2处理11 min,茎使用0.10% HgCl2处理7 min,叶使用2%的NaClO处理5 min 进行表面消毒,无菌水冲洗3~5次。将材料切成0.5 cm 左右的小块并将切口面接入PDA培养基,28 ℃恒温培养,待组织边缘长出真菌菌丝,挑取菌丝接种于PDA培养基上,28 ℃恒温培养进行反复纯化后,根据菌落形态、菌丝长势及产色素情况进行菌株去重复。同时,取最后一次洗涤植物材料的无菌水0.2 mL涂布PDA培养基,相同条件培养一周观察无菌丝生长证明表面消毒成功,所分离菌株为植物内生菌(杨明俊等,2014;侯晓群等,2015)。将纯化去重复所得菌株每株接种3~5只PDA斜面,4 ℃保存,详细记录每株菌的分离源及其在固体和液体培养基中的形态、颜色和长势等信息,建立剑叶龙血树内生真菌菌种库。
1.2.2 优势菌株的筛选 内生真菌在PDB培养基中培养7 d,采用牛津杯扩散法对发酵粗提物进行体外抑菌活性检测,并结合TLC结果及产量,筛选出优势菌株。
菌株发酵及提取:挑取经活化的内生真菌菌丝或孢子接种于100 mL PDB液体培养基中,28 ℃,200 r·min-1恒温振荡培养7 d,记录真菌的长势、形态、颜色等特征,加入等体积的乙酸乙酯浸泡过夜后超声提取3次,提取液减压浓缩回收溶剂,用有机溶剂将样品转移至棕色样品瓶保存,溶剂挥干后称取质量。
抑菌活性检测:病原细菌接种至液体LB培养基,37 ℃、200 r·min-1黑暗培养12 h,白色念珠菌接种至液体沙保氏培养基28 ℃、200 r·min-1黑暗培养24 h,用液体培养基将各菌液分别稀释至1×106~1×107cfu·mL-1备用。
采用牛津杯扩散法(邵颖等,2012)对各菌株的发酵粗提物进行抑菌实验,将稀释后的指示菌菌液均匀涂布在固体培养基上。用丙酮溶解粗提物至质量浓度为20 mg·mL-1,分别取50 μL进行活性检测,以50 μL丙酮做空白对照,以等体积的抗生素做阳性对照(病原细菌以5 μg万古霉素为阳性对照,白色念珠菌以20 μg 两性霉素B为阳性对照)。白色念珠菌28 ℃培养,其余病原细菌于37 ℃培养,恒温培养12 h后测量抑菌圈直径。
1.2.3化学多样性检测 采用薄层层析色谱法检测内生真菌化学多样性。取一定量样品加入适量的甲醇溶液,制备成5 mg·mL-1的样品,超声振荡30 min后,用0.45 μm滤膜滤过。用微量点样器吸取适量样品,于GF254硅胶板(5 cm × 10 cm)上点样后,以氯仿∶甲醇=10∶1为展开剂展开,当所有样品展开高度达到4 cm时,将薄层板移出晾干,观察、标记色谱结果。以各种显色条件下条带/斑点数较多,显色特异的样品对应的菌株记为化学多样性好的菌株。
1.2.4 优势菌株的分子鉴定 挑选抑制活性强且化学多样性丰富的菌株培养3 d后,刮取菌丝50~100 mg,采用柱式真菌基因组DNA提取试剂盒提取真菌总DNA,用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行ITS区域扩增。PCR反应体系50 μL:TSINGKE Master Mix 25 μL,ITS1 1 μL,ITS4 1 μL,DNA 2 μL,ddH2O 21 μL。反应程序:94 ℃预变性3 min,进入循环,94 ℃变性1 min,55 ℃复性45 s,72 ℃延伸1 min,共35个循环,72 ℃延伸 8 min(侯晓强等,2015)。扩增产物送至生工生物工程(上海)股份有限公司测序。
根据测序结果,进行NCBI/BLAST比对,搜索同源序列,选出与该序列相关性较高的核酸序列,进行多序列比对分析,采用MEGA 6.0(NJ法)构建系统发育进化树(杨明俊等,2014)。
2 结果与分析
2.1 剑叶龙血树内生真菌的分离
从三份剑叶龙血树植物样品中共分离得到345株内生真菌。其中勐仑镇采集的叶片材料分离得到152株,编号为B1-152,占总数的44.05%;从热带花卉园采集的茎中分离得到100株,编号为RJ1-100,占总数的28.99%,叶中分离得到93株,编号为RY1-93,占总数的26.96%。可见傣药剑叶龙血树中蕴藏着丰富的内生真菌资源。
2.2 优势菌株的筛选
对分离自剑叶龙血树的345株内生真菌进行抗病原细菌、抗病原真菌、化学多样性及产量研究,拟筛选出兼具多种抗菌活性,且化学多样性丰富、产量较高的优势菌株。筛选结果表明,分离自云南省西双版纳勐腊县勐仑镇剑叶龙血树的菌株(样品编号为B),其发酵产物在各种显色条件下条带/斑点数最多,预示着有丰富的代谢产物,且有109株菌(71.71%)对一种以上指示菌有抑制活性;分离自云南省热带作物科学研究所-西双版纳热带花卉园的剑叶龙血树茎部的菌株(样品编号为RJ)抗菌活性最好,抗菌谱最广,所有菌株对至少一种指示菌有抑制活性;分离自云南省热带作物科学研究所-西双版纳热带花卉园的剑叶龙血树叶部的菌株(样品编号为RY)产量最高,抗菌活性较好,有80株菌(86.02%)对一种以上指示菌有抑制活性。在所有分离到的内生真菌中,对金黄色葡萄球菌和耻垢分支杆菌有抑制效果的内生真菌数量最多,分别占总数的75.5%和62.61%。不同来源的内生真菌对15株病原指示菌的抑制活性如表1所示。
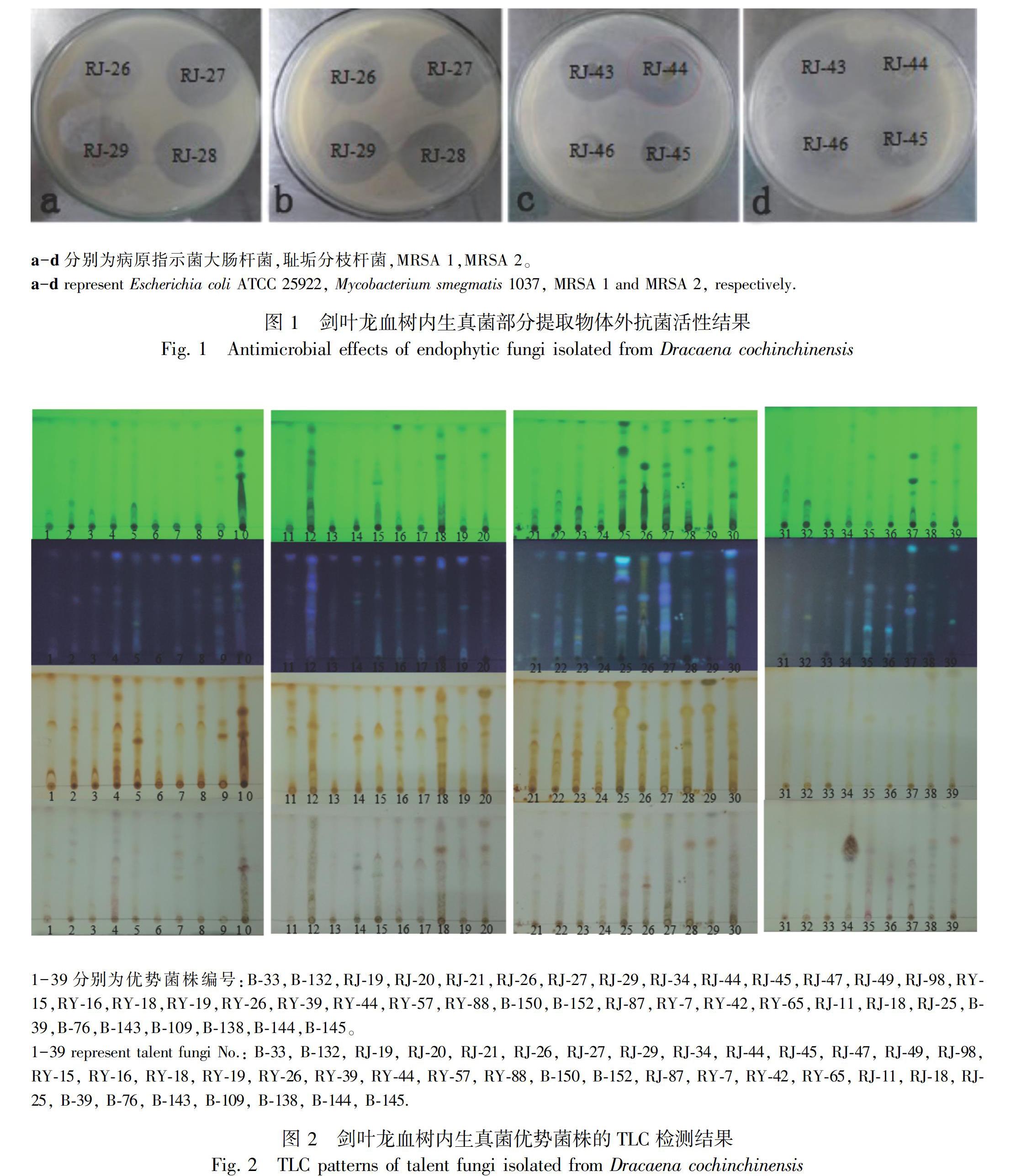
结合内生真菌发酵粗提物体外抑菌活性和TLC检测结果,筛选到多株活性强且化学多样性丰富的优势菌株,综合结果较好的前10株菌的发酵提取物对15株病原菌的体外抑菌活性结果见表2。图1为部分菌株对大肠杆菌、耻垢分支桿菌、MRSA 1和MRSA 2抑制作用效果。图2为优势菌株的发酵粗提物的TLC检测结果,从上到下依次为紫外254 nm、365 nm、碘、硫酸乙醇下显色,各份样品在在各种显色条件下条带/斑点数较多,显色特异,初步判断其化学多样性丰富,具有挖掘新颖化合物的潜力。
2.3 优势菌株的分子鉴定
结合体外抑菌活性评价、TLC筛选和代谢产物产量,选择抑菌谱广、活性较强、化学多样性丰富且产量高的40株内生真菌进行ITS分子鉴定。测序结果提交至GenBank数据库中进行BLAST相似性比较。比对结果显示这些菌株分属于柱锈菌属(Diaporthe)、镰刀菌属(Fusarium)、拟盘多毛孢属(Pestalotiopsis)、轮层炭壳菌属(Daldinia)、帚梗柱孢属(Cylindrocladium)、炭角菌属(Xylaria)、炭疽菌属(Colletotrichum)、拟茎点霉属(Phomopsis)、丛赤壳属(Nectria)、黑孢属(Nigrospora)、黑团孢属(Periconia)、枝孢属(Cladosporium)、暗球腔菌属(Phaeosphaeria)、Acrocalymma 14个属的30个种以及粪壳菌纲(Sordariomycetes)和格孢腔菌目(Pleosporales)的2个物种。菌株B-132、RY-44、RJ-34、B-150、B-76、RJ-44、B-143、RY-15分别与GenBank数据库中标准菌株Cladosporium sp. (JQ388271)、Xylaria sp. (JQ341078)、Acrocalymma sp. (KU747920)、Phaeosphaeria papaya (KT224848)、Nigrospora sp. (FJ527872)、Sordariomycetes sp. (HQ130707)、Periconia sp. (MK367489)、Pestalotiopsis sp. (MH445915)相似性为100%,其余菌株与其最相近菌株的相似性在95%~99%之间。在40株活性菌株中,镰刀菌属6株、轮层炭壳菌属5株、炭疽菌属5株和柱锈菌属5株,4个属物种超过所选物种50%,为剑叶龙血树活性内生真菌的优势种群(表3,图3)。
3 讨论与结论
本实验获得的40株优势菌株经ITS分子类鉴定,归于32个物种,其中部分活性内生真菌的亲缘菌属已有抗菌、抗肿瘤等活性化合物的报道,如与B-152同属的黄花蒿内生真菌Colletotrichum sp.产生的colletotricacid对真菌具有很强的抑制作用(Lu et al., 2000);与RJ-27同属的红树尖瓣海莲内生真菌(Phomopsis longicolla HL-2232)能产生具有抗菌活性的生物碱类化合物 2-(2′S-羟丙基)-5-甲基-7-羟基对氧萘酮(宋鑫明等,2015);本实验所获优势菌属镰刀菌属真菌能产生多种具有抗菌活性的次生代谢产物类型(Kyekyeku et al., 2017;Liu et al., 2019)。由此可见,剑叶龙血树抑菌活性内生真菌具有产生多种抑菌活性物质的潜力,值得进行下一步活性代谢产物挖掘。同时,我们还从剑叶龙血树中分离到Acrocalymma sp.(RJ-34),该菌株对15株病原指示菌均有较好的抑制活性,对3株MRSA的抑菌效果较为突出,且化学多样性丰富,但这个属物种迄今均未有次生代谢产物研究报道,可以大胆推测从中发现新颖抗菌活性成分的几率较大,并将其列为优先进行活性代谢产物挖掘的对象。
研究表明,一些内生真菌在与宿主植物协同进化过程中,能产生与宿主植物相同或相似的活性代谢产物,因此,在化学多样性检测实验中,加入了“龙血竭”的主要成分龙血素A和龙血素B作为对照,期望能找到这样的特异性菌株,为剑叶龙血树资源的保护提供新的途径。但是未能找到,可能的原因有以下两点:其一,发酵液中的目的产物量少,未能检测出来,在今后的实验中可以加大发酵量,并采用更加灵敏的检测手段(如高效液相);其二,内生真菌的分离和培养通常采用PDA培养基,28 ℃培养,而有些内生真菌并不适合在此条件下培养而导致没有被分离出来,即使采用多种培养基对植物组织进行培养也并不能保证植物组织内的内生真菌被全部分离出来,所以最重要的还是要建立与宿主植物内环境类似的生态模型,才能真实反映植物内生菌的生物学特征。
综上所述,剑叶龙血树中广泛分布具有抗菌活性的菌株,筛选出的优势菌株具有较好的抑菌活性、产量高、化学多样性丰富,且菌种稳定易培养,具有巨大的开发潜能,部分菌株活性代谢产物的挖掘工作正在积极进行中。
参考文献:
CAI XT, XU ZF, 1979. Study on the plant resources of Dracaena draconis in China [J]. Acta Bot Yunnan, 1(2): 1-10. [蔡希陶, 许再富, 1979. 国产血竭植物资源研究 [J]. 云南植物研究, 1(2): 1-10.]
CHEN QP, TANG CF, LONG HR, et al., 2018. Determination of Loureirin A and Loureirin B inartificially induced dragons blood of Dracaena cochinchinensis [J]. Contemp Chem Ind, 47(2): 434-436. [陈乾平, 唐春风, 龙海荣, 等, 2018. 剑叶龙血树化学诱导结血物中龙血素A、龙血素B的测定及诱导剂效果评价 [J]. 当代化工, 47(2): 434-436.]
HOU XQ, REN XY, FU YJ, et al., 2015. Study on antimicrobial activity and classification of endophytic fungi from Glehnia littoralis [J]. Chin Trad Herbal Drug, 46(19): 2932-2936. [侯晓强, 任秀艳, 付亚娟, 等, 2015. 北沙参内生真菌的抑菌活性与分类研究 [J]. 中草药, 46(19): 2932-2936.]
KYEKYEKU JP, KUSARI S, ADOSRAKU RK, et al., 2017. Antibacterial secondary metabolites from an endophytic fungus, Fusarium solani JK10 [J]. Fitoterapia, 4(7): 108-114.
LEWIS W, 2012. Antibiotics: recover the lost art of drug discovery [J]. Nature, 485(7399): 439-440.
LIU XB, ZHENG N, LIANG LQ, et al., 2019. Secondary metabolites from the endophytic fungus Fusarium equiseti and their antibacterial activities [J]. Chem Nat Compd, 55(6): 1141-1143.
LU H, ZOU WX, MENG JC, et al., 2000. New bioactive metabolites produced by Colletotrichum sp., an endophytic fungus in Artemisia annua [J]. Plant Sci, 151(1): 67-73.
PENG QZ, CHEN L, YI LB, et al., 2010. Transformation of curcumin by endophytic fungus Diaporthe sp. isolated from Curcuma longa [J]. Lett Biotechnol, 21(2): 196-199. [彭清忠, 陳玲, 易浪波, 等, 2010. 内生真菌对姜黄素的微生物转化 [J]. 生物技术通讯, 21(2): 196-199.]
SCHMALSTIEG AM, SRIVASTAVA S, BELKAYA S, et al.,2012. The antibiotic resistance arrow of time: Efflux pump induction is a general first step in the evolution of mycobacterial drug resistance [J]. Antimicrob Agents Chemother, 56(9): 4806-4815.
SHAO Y, CHEN HW, CHAI WB, et al., 2012. Isolation and purification of antibacterial components in fermentation broth of Paecilomyces militaris [J]. Food Sci, 33(23): 116-120. [邵颖, 陈宏伟, 柴文波, 等, 2012. 蛹拟青霉发酵液中抑菌活性成分的分离纯化 [J]. 食品科学, 33(23): 116-120.]
SONG XM, ZHOU XM, LI XB, et al., 2015. Secondary metabolites of a Bruguiera sexangula var. rhynchopetala derived fungus Phomopsis longicolla HL-2232 [J]. Chin J Org Chem, 35(10): 2102-2107. [宋鑫明, 周学明, 李小宝, 等, 2015. 红树尖瓣海莲内生真菌Phomopsis longicolla HL-2232 次级代谢产物研究 [J]. 有机化学, 35(10): 2102-2107.]
STIERLE A, STROBEL GA, STIERLE D, 1993. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew [J]. Sci, 260(5105): 214-216.
TANAKA M, YOSHIMURA M, SUTO M, et al., 2002. Production of lepidimoide by an endophytic fungus from polysaccharide extracted from Abelmoschus sp.: Identification of the product and the organism producing it [J]. J Biosci Bioeng, 93(6): 531-536.
WANG T, MA YX, YE YH, et al., 2017. Screening and identification of endophytic fungi producing podophyllotoxin compounds in Sinopodophyllum hexandrum stems [J]. Chin J Exp Trad Med Formul, 23(2): 27-31. [王婷, 马越兴, 叶耀辉, 等, 2017. 桃儿七茎部产鬼臼毒素类成分的内生真菌筛选及鉴定 [J]. 中国实验方剂学杂志, 23(2): 27-31.]
WEI Y, HUANG BY, MIAO JH, et al., 2016. Study on the loose callus induction technology of Dracaena cochinchinensis (Lour) S. C. Chen [J]. Seed, 35(8): 80-82. [韦莹, 黄宝优, 缪剑华, 等, 2016. 剑叶龙血树疏松愈伤组织诱导技术研究 [J]. 种子, 35(8): 80-82.]
XIAO ZY, HUA M, YUAN XL, et al., 2018. Activity inhibition of human pathogenic bacteria by secondary metabolites from Malania oleifera endophytic fungi [J]. Guihaia, 38(7): 903-910. [肖支叶, 华梅, 原晓龙, 等, 2018. 蒜头果内生真菌次生代谢产物抑制人类致病菌活性的研究 [J]. 广西植物, 38(7): 903-910.]
YANG MJ, LI J, XUE HY, et al., 2014. Isolation of endophyte fungi in Narcissus tazetta var. chinensis and their antimicrobial and antitumor activities [J]. Chin Trad Herb Drug, 45(6): 819-824. [杨明俊, 李娟, 薛鸿燕, 等, 2014. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究 [J]. 中草药, 45(6): 819-824.]
ZHANG LQ, GUO B, LI HY, et al., 2000. Preliminary study on the isolation of endophytic fungus of Catharanthus roseus and its fermentation to produce products of therapeutic value [J]. Chin Trad Herbal Drug, 31(11): 805-807. [張玲琪, 郭波, 李海燕, 等, 2000. 长春花内生真菌的分离及其发酵产生药用成分的初步研究 [J]. 中草药, 31(11): 805-807.]
ZHOU YL, MIN JG, ZOU Z, et al., 2015. Evaluation on anti-oxidant capacity of Dracaena cochinchinensis by HPLC-DPPH and analysis on structure-activity relationship [J]. Chin Trad Herbal Drug, 46(12): 1797-1799. [周艳林, 闵建国, 邹准, 等, 2015. HPLC-DDPH评价剑叶龙血树中抗氧化活性成分及构效关系 [J]. 中草药, 46(12): 1797-1799.]
(责任编辑 周翠鸣)

