苹果坏死花叶病毒烟台分离物的鉴定与序列分析*
弟豆豆,宋来庆,曹晓敏,胡 慧,张 硕,张学勇,姜中武,2,赵玲玲,2
(1 烟台市农业科学研究院,山东 265500)(2 烟台大学生命科学学院)
苹果花叶病在我国各苹果产区发生严重[1]。其中,山东、河南、山西、甘肃、陕西等地受害较为普遍[2],在陕西省一些苹果产区,病株率在30%以上,而山东省烟台市的一些老果园病株率竟在80%~100%[1]。苹果花叶病受温度、光照等因素影响较大,春季至夏季叶片症状明显,感病叶片出现花叶、褪绿黄化等症状,引起叶绿素降解,从而影响光合作用,进而影响树势、产量及果品质量[3-6]。据报道,苹果花叶病在苹果上的危害为慢性危害,潜育期长,最长可达8年才表现症状[1],病株产量下降30%~40%[7]。
1933年,Bradford等在美国首次报道苹果花叶病毒[8]。20世纪50 年代,我国发现了苹果花叶病并开展其相关研究,80年代开始进行病毒的调查和鉴定[9-11]。近年来,研究人员发现苹果花叶病毒(Apple mosaic virus,ApMV)并不是导致苹果花叶病的唯一病原,李属坏死环斑病毒(Prunus necrotic ring spot virus,PNRSV)、苹果坏死花叶病毒(Apple necrotic mosaic virus,ApNMV)也可能会引起苹果花叶病[12-13]。ApNMV基因组由3条RNA 组成,其中,RNA1和RNA2都是单顺反子,分别编码与病毒复制相关的酶类MET/HEL(methyltransferase/NTP-binding helicase)和RNA依赖的RNA聚合酶(RNA polymerase),RNA3编码MP(Movement protein,MP)和CP(Coat protein,CP)。基于CP 和MP 氨基酸序列的系统发育分析表明,ApNMV属于Ilarvirus属的第3亚组[13-14]。
2017年,日本学者从表现花叶病的中国苹果中首次检测到ApNMV[13]。2018年,邢飞[14]克隆了6条ApNMV中国分离物全基因组序列,并且明确了ApNMV与我国苹果花叶病症状高度相关。2019年,Hu 等测定了海棠的ApNMV 全基因组序列[15]。目前,NCBI共登录10条ApNMV的RNA3全基因组序列,其中包括日本1条、中国陕西延安4 条、中国山东泰安3条、中国辽宁兴城2条,而关于山东省烟台市苹果坏死花叶病毒分离物的研究尚未见报道。本研究利用RT-PCR技术对山东省烟台地区ApNMV进行了鉴定和序列分析,以期为该病的防治、流行规律的判断以及致病机理研究提供理论依据。
1 材料与方法
1.1 试验材料
2019年5月,在烟台市农业科学研究院采集表现花叶症状的植物样品37个,其中,‘红将军’苹果8个、‘长富2号’苹果23个、海棠1个、月季2个、梨3个(图版1),每株采集3~5片嫩叶片作为1个样品,编号后置于冰盒中,带回实验室后立即放入液氮中冷冻,-80 ℃保存备用。
RNA提取试剂盒购于北京艾德莱公司(RN09),DH5α感受态细胞、PLB(lethd Based simple Fast Cloning Kit)和TIAN Gel Midi Purification Kit 购于天根生化科技(北京)有限公司;Thermo Scientific revertAid First Stand cDNA Synthesis Kit、Escherichia coli聚合酶和Phusion High-Fidelity DNA 聚合酶购于赛默飞世尔科技(中国)有限公司;rTaq、pMD18-T、Maker DL2000、ddH2O 购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 叶片总RNA 提取
叶片总RNA提取参照北京艾德莱公司的RNA提取试剂盒说明书进行,提取的总RNA溶解于40 μL ddH2O中,贮存于-70 ℃冰箱中备用。
1.2.2 RT-PCR 扩增
以提取的总RNA 为模板反转录成cDNA,反转录过程参照Thermo Scientific revertAid First Stand cDNA Synthesis Kit说明书进行。采用ApN-F1和ApN-R1[13]为第1轮扩增引物,以ApN-F2 和ApN-F2[14]为第2 轮扩增引物进行ApNMV 巢氏PCR(Nested RT-PCR)检测。第1轮PCR 反应扩增体系:10×Buffer 2.5μL、dNTPs 1.6 μL、10 μmol/L 正反向引物各0.6 μL、cDNA 1μL、rTaq DNA聚合酶0.2 μL,补水至20μL。取0.25μL 第1轮PCR 产物为模板进行第2轮PCR 反应。反应程序为:94℃预变性4 min;94℃变性30 s,54 ℃退火30 s,72℃延伸50 s,循环35次;72℃延伸10 min。1.5%琼脂糖凝胶电泳检测扩增产物。为明确苹果样品中病毒复合侵染的情况,参照梁成林等[16]的方法进行苹果茎痘病毒(ASPV)、苹果茎沟病毒(ASGV)、苹果褪绿叶斑病毒(ACLSV)和苹果锈果类病毒(ASSVd)的检测[16]。检测所用引物序列见表1。

表1 苹果花叶病病毒检测引物
1.2.3 ApNMV RNA3基因克隆测序
从‘红将军’和‘长富2号’中各随机选取3个阳性样品进行RNA3基因组序列克隆和测序。分别以ApNMV呈阳性的‘红将军’和‘长富2号’cDNA 样品为模板,使用E.colipoly(A)Polymerase(NEB,北京)进行3′端加尾反应,反转录过程参照Thermo 反转录试剂盒说明书进行。
参考邢飞[14]设计合成特异性引物,以RNA3-mcf(5′-GTCGAAGTACTTTTCTGCCAAATG-3′)和RNA3-R1(5′-GATTGGGCATCTACTTTCGTA-3′)为引物进行第1轮PCR反应,以RNA3-mcf 和RNA3-R2(5′-GCTTCCCTAACGGGGCATCCAAT-3′)为引物,以第1 轮PCR 反应产物为模板进行Nested RT-PCR,扩增ApNMV RNA3 全长核苷酸序列,目的片段大小约为1 752 nt。25 μL PCR 反应扩增体系:5×Phusion HF Buffer 5μL、dNTPs(10 mmol/L)0.5 μL、10 μmol/L正反向引物各0.8μL、cDNA 1.5μL、Phusion High-Fidelity DNA Polymerase(2 U/μL)0.3μL,补水至25μL。Nested RT-PCR反应体系:5×Phusion HF Buffer 5μL、dNTPs(10 mmol/L)1.6μL、10 μmol/L正反向引物各0.8μL、上述PCR 产物0.2μL、Phusion High-Fidelity DNA Polymerase(2 U/μL)0.3μL,补水至25μL。反应程序:98℃预变性50 s;98℃变性10 s,58℃(APNA1)或48℃(RNA3-R5)退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸8 min。1.5%琼脂糖凝胶电泳检测扩增产物,在4 ℃条件下保存。
按照TIAN Gel Midi Purification Kit说明书回收DNA 目的片段,取3μL 纯化后的目的片段连接PLB载体,连接产物转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选,挑取白色菌落进行PCR 阳性克隆筛选。选取3~5个阳性克隆由生工生物工程(上海)有限公司进行序列测定。
1.2.4 阳性克隆序列多重比对
每个阳性样品选取3~5 个阳性克隆进行测序,将测序结果在GenBank中进行BLAST 比对,利用DNAMAN(Version6.0)比较序列同源性。
1.2.5 ApNMV RNA3序列系统进化分析
将获得的2 条分离物与GenBank 中已发表的10条ApNMV RNA3 序列,利用MEGA 7.0 软件,采用邻接法(Neighbor-joining,NJ),以PNRSV(NC004346)为外群,构建系统发育树,bootstrap 值为1 000,其余参数为默认设置。
2 结果与分析
2.1 ApNMV RT-PCR检测结果
RT-PCR结果(图1)显示,31份苹果样品中有27份检测出了ApNMV,检出率为87.1%。表明ApNMV与我国苹果花叶病高度相关。
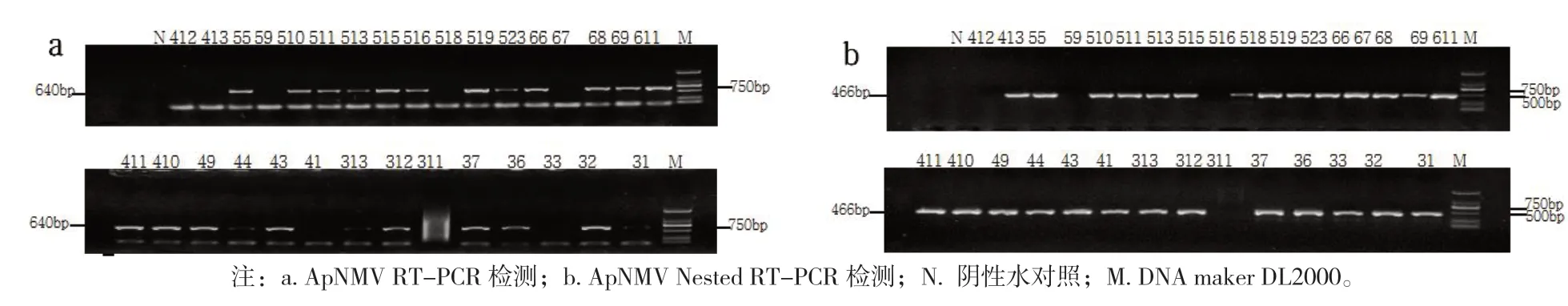
图1 Ap NMV 在表现花叶病症状的苹果样品中的检测结果
从表现花叶症状的海棠、梨和月季样品中均扩增出440 nt 左右的目的条带。将目的条带序列测定后,明确海棠(H281)、梨(L16)、月季(Y6)中扩增到445、435、440 bp大小的ApNMV 特异片段(图2)。
2.2 苹果样品病毒复合侵染情况
ASPV、ASGV、ACLSV是苹果树中3种主要的潜隐性病毒,ASSVd 是主要的非潜隐性类病毒。对31 份花叶样品进行ASPV、ASGV、ACLSV 和ASSVd带毒情况检测结果显示,31份花叶样品的ApNMV、ACLSV、ASPV、ASGV和ASSVd 的检出率分别为87.1%、70.9%、54.8%、61.3%和0.1%(图3-a);1种病毒和ApNMV复合侵染的样品占33.1%(图3-b);2 种病毒和ApNMV 复合侵染的样品占22.0%(图3-c);3 种及3种以上病毒和ApNMV复合侵染的样品占41.0%(图3-d);ApNMV与ASPV、ASGV、ACLSV、ASSVd 总复合侵染率为96.1%。
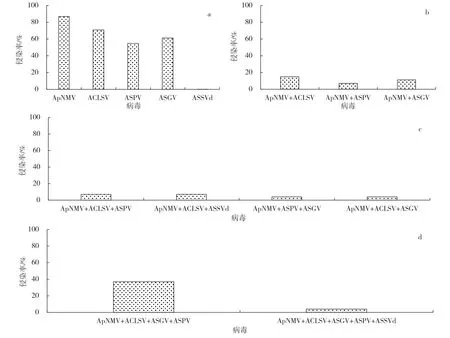
图3 花叶样品中ApNMV 和其他4 种病毒的检测与混合侵染情况
2.3 ApNMV RNA3 基因克隆测序及序列同源性分析
利用ApNMV RNA3引物(RNA3-mcf 和RNA3-R1、RNA3-R2)进行Nested-PCR,分别在‘红将军’和‘长富2号’中扩增得到大小约为1 780 bp大小特异片段,与目的条带大小一致(图4)。PCR产物纯化后,连接到PLB 载体,转化大肠杆菌DH5 α感受态细胞中,然后每个样品随机选取3~5个阳性克隆进行序列测定。最终获得2 条长度为1 785 nt(YF515)和1 783 nt(YF31)的序列。
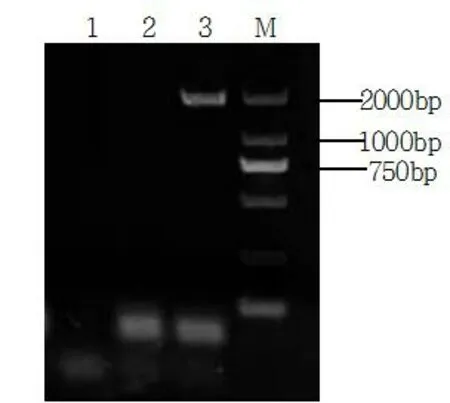
图4 Ap NMV RNA3 基因的RT-PCR扩增图谱
获得的YF515和YF31核苷酸序列一致性为91.71%,与GenBank 中已报道的10条来自不同国家和地区的ApNMV RNA3核苷酸序列一致性为89.88%~96.64%。2条分离物与已发表序列在编码区MP、CP 核酸序列相似性分别为89.09%~97.52% 和89.85%~96.21%,氨基酸序列相似性分别为91.79%~98.21%、90.02%~95.43%(图5、图6);在非编码IR区,与已发表序列核苷酸相似性为58.39%~91.26%,其中与日本分离物NC040470.1相似性最低,核苷酸序列相似性为58.39%(图7)。

图5 来自不同国家不同寄主Ap NMV 分离物MP氨基酸序列比对

图6 来自不同国家不同寄主Ap NMV 分离物CP氨基酸序列比对

图7 来自不同国家不同寄主Ap NMV分离物IR 区基因组序列比对
2.4 RNA3系统发育分析
RNA3基因系统进化分析结果表明,‘红将军’分离物YF31(MN911186)与中国陕西苹果分离物(KY808390.1、KY808381.1、KY808378.1)、辽宁苹果分离物(MG924901.1)和山东海棠分离物(MG924900.1)进化关系较近,聚于同一分支;‘长富2号’分离物YF515(MN911185)与陕西苹果分离物(KY808393.1)进化关系最近,与日本苹果分离物(NC040470.1)、辽宁苹果分离物(MG924902.1)、山东苹果分离物(KY808387.1)、陕西苹果分离物(KY808393.1)聚在同一分支。分离物之间没有表现出寄主特异性以及地域分布规律。
将苹果、月季、海棠和梨上获得的分离物序列构建系统进化树,结果表明,梨、月季、海棠分离物均与苹果(F411)聚在同一分支,亲缘关系较近,而与ApMV、PNRSV关系较远。其中,月季(Y6)分离物与苹果(F411)关系最近,其次是梨(L16)分离物,与海棠分离物关系较远(图8)。
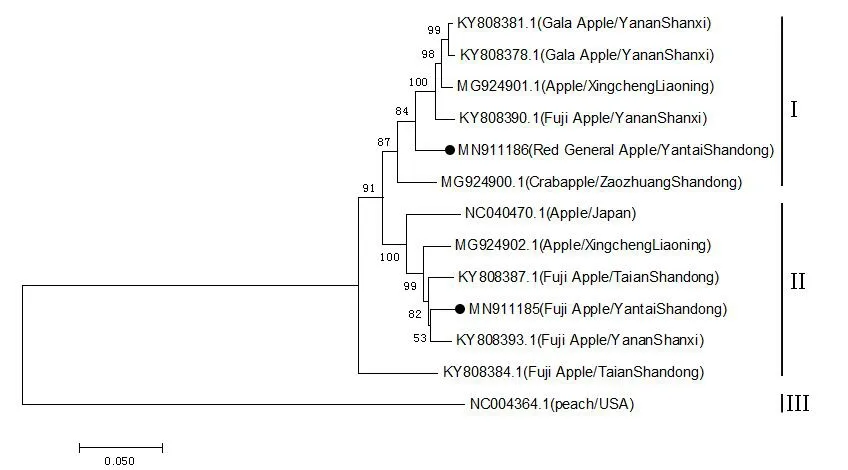
图8 Ap NMV 不同分离物RNA3 核苷酸序列的系统进化树
3 讨论与结论
关于苹果花叶病的病原研究,目前研究结果表明,存在3种可能病原ApMV、PNRSV和ApNMV。本研究通过对31份苹果花叶样品进行带毒情况检测,发现ApNMV 的检出率高达87.1%,而未检出ApMV,表明ApNMV与烟台地区花叶病高度相关,可能为苹果花叶病的病原。该结果与邢飞[14]的研究结果基本一致。此外,本研究对31份花叶样品中4种病毒ASPV、ASGV、ACLSV 和ASSVd 进行检测,发现ApNMV与这4种病毒的复合侵染率高达96.1%,1 种病毒和ApNMV 复合侵染的样品占33.1%;2 种病毒和ApNMV复合侵染的样品占22.0%;3种及3 种以上病毒和ApNMV 复合侵染的样品占41.0%。表明ApNMV与其他病毒复合侵染率高,而邢飞[14]的研究结果表明ApNMV与3种潜隐性病毒的复合侵染率为48%,这可能与样品的采集种类、采集数量和采集方法有关。此外,还初步检测到ApNMV与烟台地区海棠、梨、月季中花叶病症状有关。
烟台市是我国主要的苹果产区,富士系为主栽品种,面积占全市苹果面积的86%,分离‘红将军’和‘长富2号’2个品种苹果花叶病原对本地区苹果花叶病的防治具有非常重要的意义。本试验从7个‘红将军’和20个‘长富2 号’ApNMV 花叶阳性样品中随机选取3个阳性样品,对ApNMV RNA3序列进行克隆、测序结果完全相同,表明本研究获得的2 条ApNMV RNA3分离物MN911186和MN911185可能为侵染烟台地区‘红将军’和‘长富2 号’的ApNMV主要序列。对这2 条分离物进一步序列比对发现,这2条序列之间相似性为91.71%,与已报道的ApNMV RNA3核苷酸序列一致性为89.88%~96.64%。虽然,NCBI数据库中已登录4 条侵染富士苹果的ApNMV RNA3序列,分别为陕西富士分离物2 条、山东苹果分离物2 条。但是,本研究获得的‘长富2 号’分离物MN911185与陕西富士分离物KY808390.1和KY808393.1、山东富士分离物KY808384.1 和KY808387.1 核苷酸一致性较低,分别为89.03%、85.71%、84.57%和85.66%,表明侵染烟台地区富士苹果为不同的ApNMV变体导致。
系统进化分析结果表明,‘长富2号’分离物MN911185 与陕西苹果分离物KY808393.1 有更近的亲缘关系,而与山东苹果分离物KY808387.1、辽宁苹果分离物MG924902.1的亲缘关系较远,这可能与不同地区苹果引种或苗木运输频繁调运有关。因此,在苗木运输过程中,必须加强病毒的检疫工作。
综上所述,本研究主要检测了烟台地区富士苹果花叶病的病原,分析了序列特征,表明其为不同的ApNMV变体导致。此外,还初步检测到ApNMV与海棠、梨、月季中花叶病症状有关。这些结果一方面丰富了我国ApNMV分离物的基因组序列信息和分子特性,并为进一步开展侵染性克隆载体的构建奠定了基础。另一方面为研究ApNMV的遗传多样性和进化提供了参考和依据,也为苹果花叶病防治及流行规律等研究提供了参考。

