钙钛矿型锂离子固体电解质Li2x-ySr1-xTi1-yNbyO3的性能
卢佳垚,厉 英✉,倪培远,唐甜甜
1) 东北大学冶金学院,沈阳 110819 2) 辽宁省冶金传感器材料及技术重点实验室,沈阳 110819
全固态锂电池被公认为是下一代储能电池,越来越受到科研工作者的重视. 全固态锂电池全部是由固体材料构成,不存在使用含有易燃易爆的液态电解液,因而具有高安全性. 同时还具有以下优点:高能量密度,配合高电压正极材料使用,低电子电导率,较宽的使用温度,抑制锂枝晶生长[1-4]. 锂离子固体电解质作为全固态锂电池中重要的组件而被广泛的研究. 目前在研的锂离子固体电解质有锂超离子固体电解质(LISICON)[5]、钠超离子固体电解质(NASICON)[6]、石榴石型固体电解质[7]、钙钛矿型固体电解质[8-17]、硫化物型固体电解质[18]、聚合物锂离固体电解质[19]等.
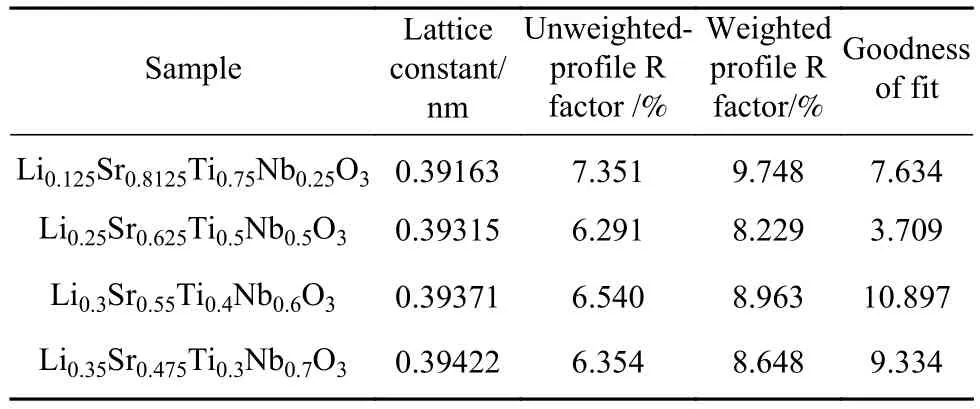
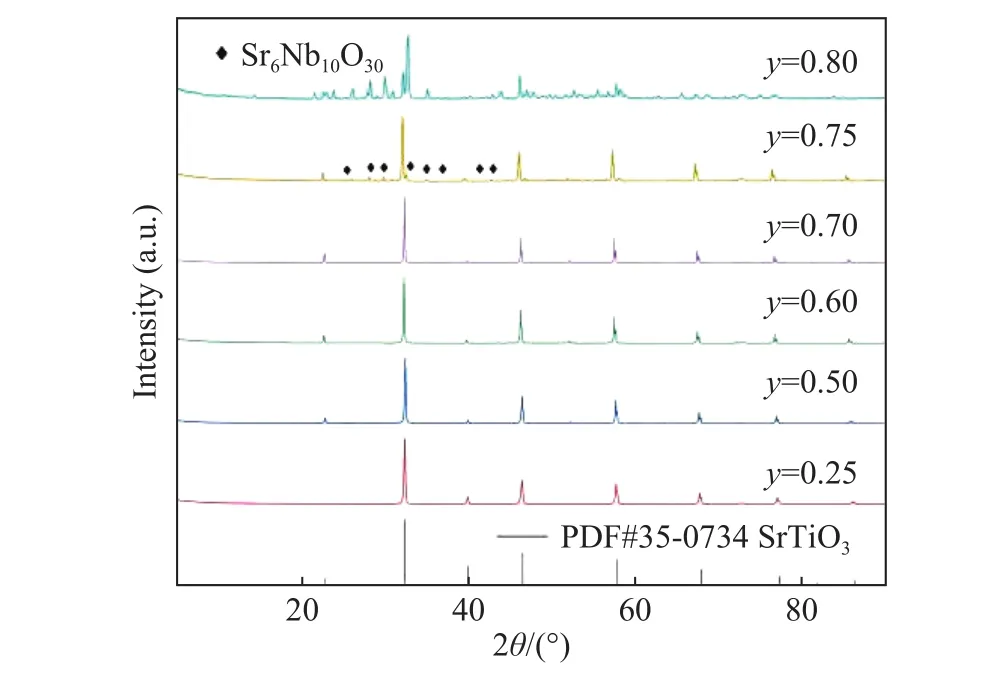
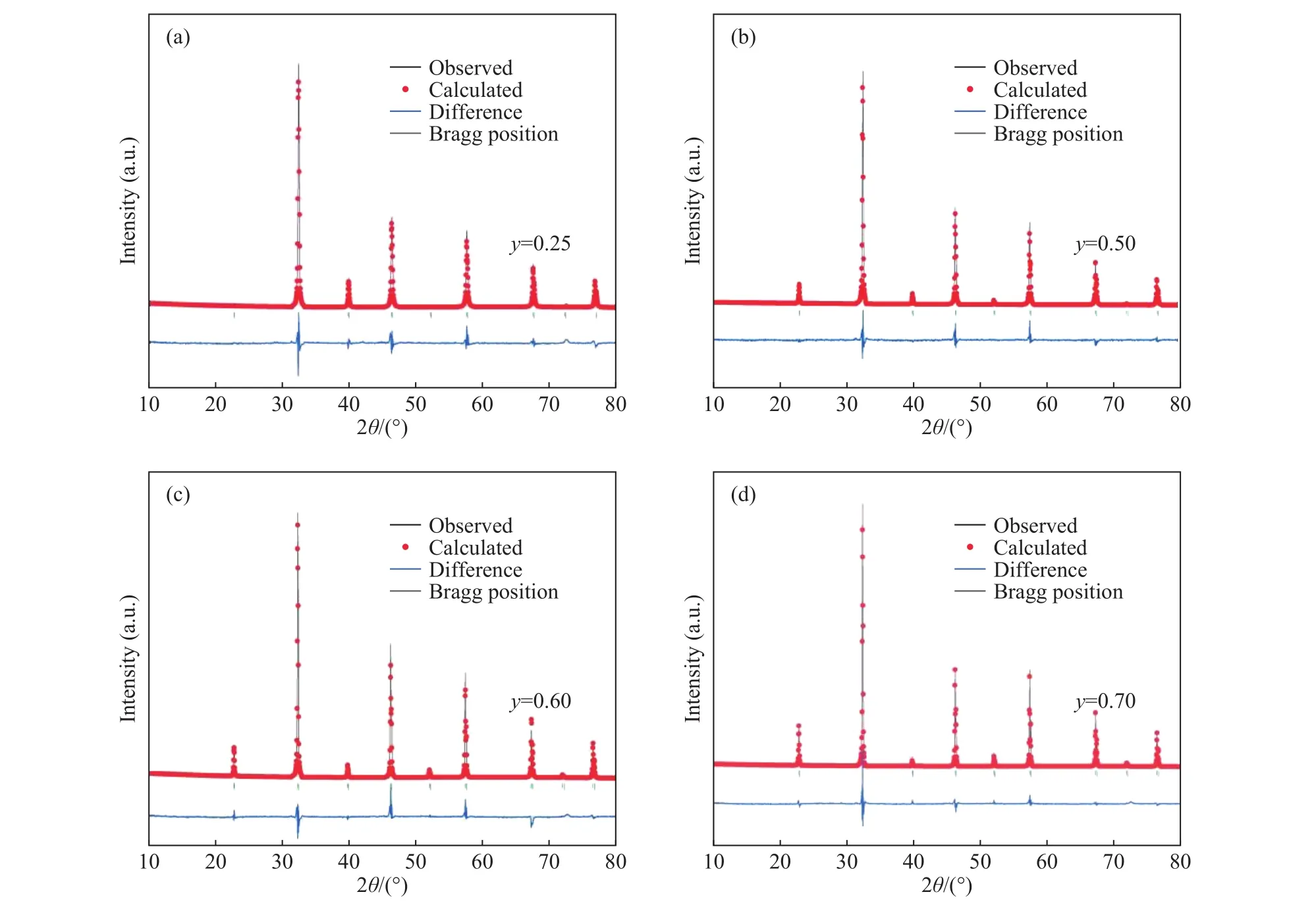
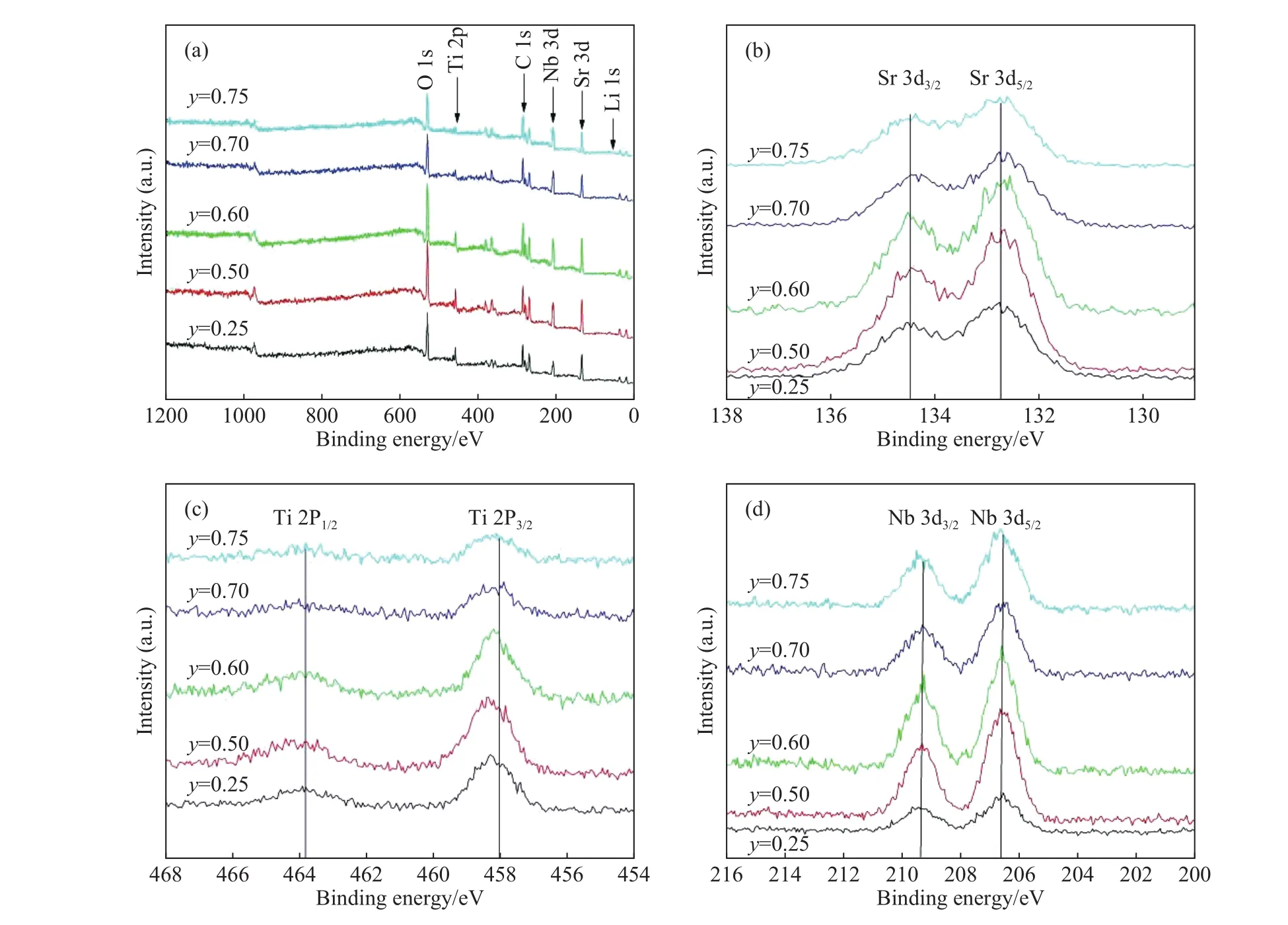
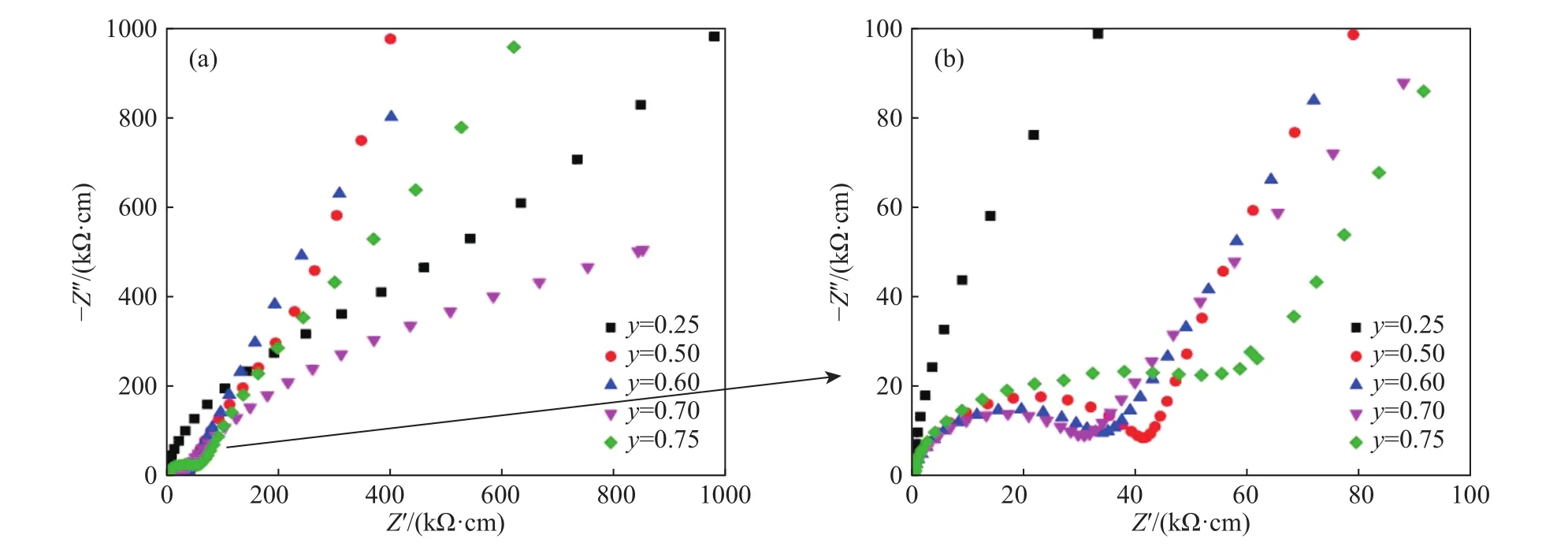
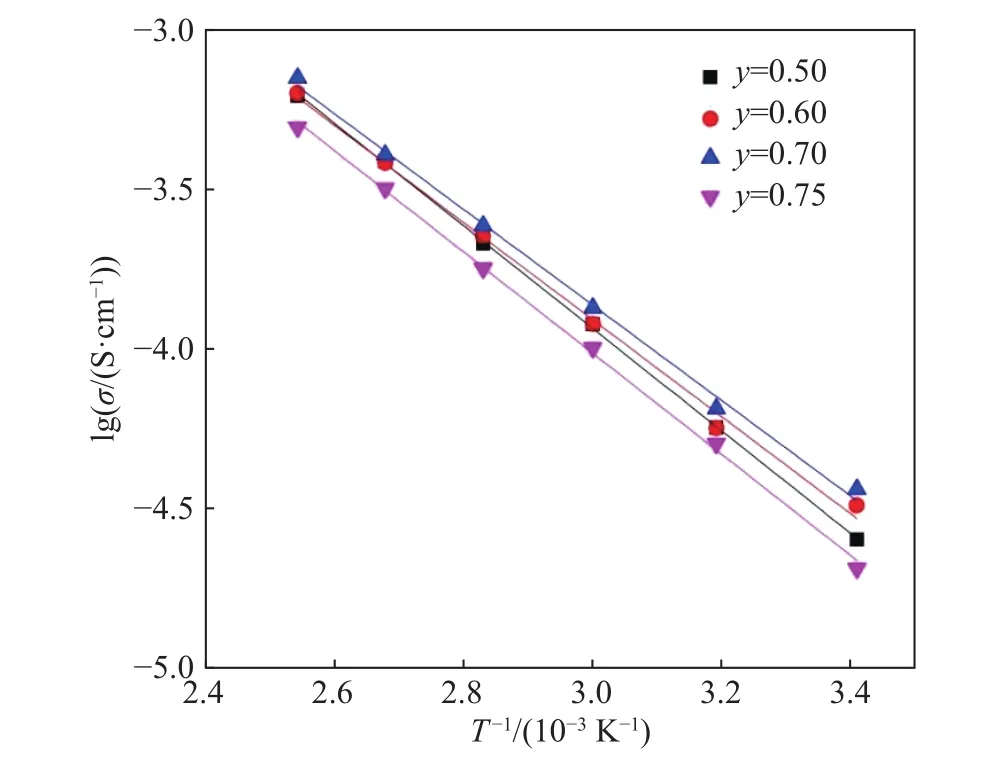
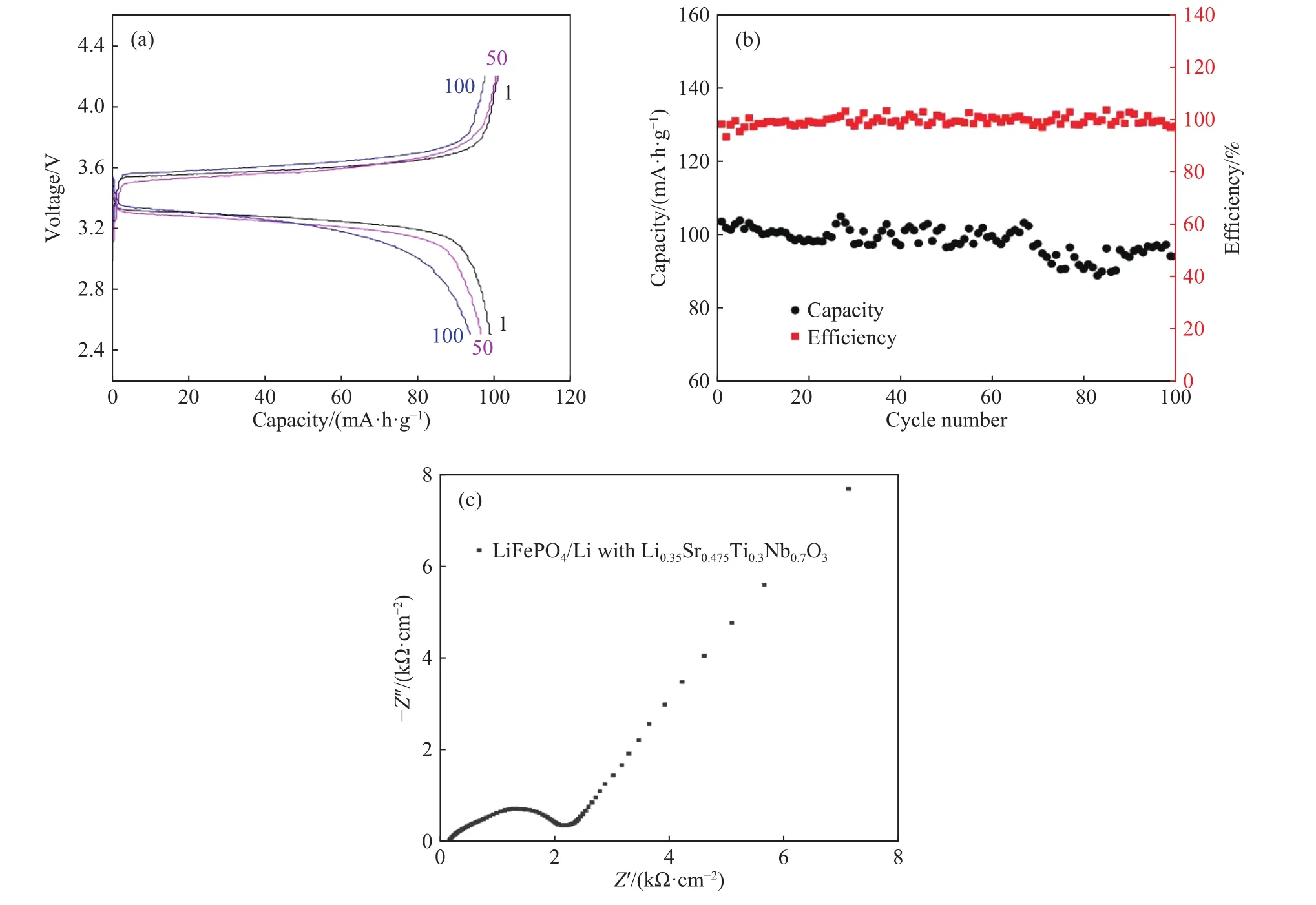
在众多的锂离子固体电解质中,钙钛矿型锂离子固体电解质是一种重要的材料,其结构式为ABO3,其中A位一般为大离子半径的元素,B位一般为小离子半径的元素. 另外钙钛矿型物质有着较宽的容许因子t (0.75 本文通过文献报道的组分设计方式,得到了系列Li2x-ySr1-xTi1-yNbyO3(x=3y/4)固体电解质材料. 相比LLTO与含有Ta的钙钛矿型材料,本文研究的材料烧结温度低,其在1250 ℃即可合成立方钙钛矿结构的物质. 另外,文献[15]只报道了一种Li0.375Sr0.4375Ti0.25Nb0.75O3材料,并没有对该系列不同组分的结构和性能进行对比. 本文通过各组分的性能研究,发现Li0.375Sr0.4375Ti0.25Nb0.75O3材料在该体系中的电导率并不是最高的. 采用X射线衍射图谱(XRD)、扫描电子显微镜(SEM)、交流阻抗技术、恒电位极化法分别对该系列固体电解质的晶体结构、微观形貌、离子电导率、电子电导率进行性能研究. 通过对比,选取了有着较高离子电导率的Li0.35Sr0.475Ti0.3Nb0.7O3作为固体隔膜应用到锂电池中,电池在多次充放电过程中运行良好. 基于SrTiO3,以Nb5+部分取代Ti4+,载流子Li+作为电荷补偿并部分取代Sr2+,此时该物质可写成LizSr1-xTi1-yNbyO3,根据电荷守恒,可得以下公式: 即z=2x-y,目标产物可写成Li2x-ySr1-xTi1-yNbyO3,根据文献报道的电导率公式如下: 式中:σ为离子电导率,S·cm-1;K 为比例常数. 电导率σ是关于x和y的曲面函数,为获得一组组分信息,取y为常数,对电导率σ取一阶导数如下: 当 dσ/dx=0 时,x=3y/4,其中 0 容许因子公式如下: 其中:t为容许因子;rA为A位元素离子半径,nm;rO为O离子半径,nm;rB为B位元素离子半径,nm. 经计算各材料的容许因子分别为0.09358、0.08706、0.08446、0.08188、0.08059、0.07930 nm. 本文采用传统的高温固相法制备Li2x-ySr1-xTi1-yNbyO3(x=3y/4, y=0.25, 0.5, 0.6, 0.7, 0.75, 0.8)钙钛矿型锂离子固体电解质,原材料采用Li2CO3(99.0%)、SrCO3(99.0%)、TiO2(99.9%)、Nb2O5(99.0%),其中多添加20%的Li2CO3来弥补高温烧结过程中锂元素的挥发. 按照各个固体电解质的组分进行配料,将原料与适当酒精倒入球磨罐中,在行星式球磨机中以300 r·min-1进行球磨10 h. 球磨后的浆料倒入玻璃培养皿中,放入干燥箱内加热除去酒精,干燥后的原料使用研钵磨细,再将磨细的原料倒入氧化铝坩埚中进行煅烧,煅烧温度为1100 ℃,时间为10 h,煅烧的目的是原料碳酸盐分解和材料的初步合成. 煅烧后的材料使用不锈钢模具压片,压制压力为5 MPa,保压时间为30 s,得到直径为15 mm,厚度约为2 mm的电解质片. 将电解质片排列在氧化铝板并覆盖有母粉,最后放入电阻炉中烧结,烧结温度为1250 ℃,时间为10 h,覆盖母粉目的是减少在烧结过程中电解质片中锂元素的挥发. 商业化的磷酸铁锂(LiFePO4)与金属锂片分别作为锂电池的正极活性材料与负极,其中正极制备为:首先将聚偏氟乙烯(PVDF)溶解于N-甲基吡咯烷酮(NMP)溶液中,质量比例为1∶19,然后乙炔黑与LiFePO4按照质量比为1∶8进行研磨混合,在将乙炔黑与LiFePO4混合料与PVDF溶液按照质量比9∶20进行混合,并搅拌3 h. 将混合均匀的浆料涂覆在铝箔上,厚度为150 μm. 将涂覆好的电极片放入干燥箱内干燥一昼夜. 将干燥好的电极片剪切成直径为10 mm的圆电极片. 使用固体电解质隔膜的锂电池装备方法为:在手套箱内,按照正极壳,正极片,电解液,固体电解质隔膜,电解液,金属锂片,不锈钢圆片,弹片,负极壳的顺序进行组装. 材料的物相分析由X射线衍射仪(XRD,Ultima IV,日本理学)来表征,扫描角度为 5°~90°;X射线光电子能谱(XPS,ESCALAB 250Xi,Thermo Fisher Scientific)用来确定材料各元素的化合价态;电子扫描显微镜(SEM,Rigaku Ultima IV,日本理学)用来观察材料的微观形貌;材料的离子电导率由高频阻抗相位分析仪(1260型,英国输力强精密测量有限公司)来测试,其中施加电压为100 mV,频率范围为1 Hz~10 MHz;电子电导率采用恒电位极化法(VersaSTAT 3,阿美特克科学仪器部)来测试,极化电压为4 V,时间为60 min;电池的充放电测试由电池(LAND CT-2001A,武汉蓝电公司),充放电倍率为0.2 C(C表示倍率,1C表示电池在1 h内释放全部额定容量所需的电流值),充放电电压范围为2.5~4.2 V. 固体电解质的离子电导率一般由交流阻抗图计算而来,公式如下: 式中:σtotal为总电导率,S·cm-1;L 为材料的厚度,cm;S为材料的圆面积,cm2;R为材料的阻抗,Ω. 活化能可以由Arrhenius公式计算得到,其公式如下: 式中:σtotal为材料的总电导率,S·cm-1;Ea为材料的活化能,kJ·mol-1;A 为指前因子,J·K-1;kB为玻尔兹曼常数,J·K-1;T 为温度,K. 式(6)两边取对数,可得: 通过lgσtotal与1000/T作图,可得如下公式: 式中,b为图(lgσtotalvs T-1)与横坐标的截距;m为图(lgσtotalvs T-1)的斜率,联立(7)与(8)式可得: 式中,活化能 Ea的单位为 kJ·mol-1,通过换算,得到单位为eV的活化能. 电子电导率一般由恒电位极化法测得,计算公式如下: 式中:σe为材料的电子电导率,S·cm-1;U 为极化电压,V;I为稳定的极化电流,A;L为材料的厚度,cm;S为材料的圆面积,cm2. 图1为Li2x-ySr1-xTi1-yNbyO3(x=3y/4, y=0.25, 0.5,0.6, 0.7, 0.75, 0.8)系列固体电解质的XRD图谱,在测试前应对材料进行预处理,使用不同目数的砂纸对材料的表面进行逐级打磨,其目的是除去表面因元素挥发生成的杂质相并保证表面平整. 由图 1可知,当 y=0.25、0.5、0.6、0.7时,固体电解质材料成功合成了具有立方结构的钙钛矿结构,各衍射峰与SrTiO3标准谱图(PDF#35-0734)相似,其空间群为Pm-3m,并未发现明显的杂质相. 随着摩尔掺杂量的增加,材料的容许因子逐渐减小,造成掺杂元素不能完全进入钙钛矿结构中相应的位置. 加之,A位掺杂元素Li的离子半径(0.076 nm)要远小于Sr(0.144 nm),过多的Li掺杂也不能支撑整个 ABO3结构. 当Nb的掺杂量 y≥0.75时,Nb不能完全进入到钙钛矿型结构中,部分合成了钙钛矿相,部分形成了贫锂的杂质相(Sr6Nb10O30).Sr6Nb10O30为贫锂物质将会对固体电解质材料的锂离子迁移造成阻碍,进一步降低材料的离子电导率. 随着进一步Nb的含量增加,出现了更多的未知杂质相. 因此可以得出结论:过多的掺杂不利于合成立方结构的钙钛矿结构,适当量元素掺杂可以进入ABO3结构中. 图2为y=0.25、0.5、0.6、0.7的拟合XRD图谱,采用的精修软件为Rietica,精修后的晶胞参数如表1所示. 由表可以看出,随着y值的增加,晶胞参数逐渐增加. 由文献[20]~[22]可知,Li+通过BO6八面体构成的通道内迁移的,提高晶胞参数能有效扩大离子迁移通道,更有利于提高电导率. 表1 Li2x-ySr1-xTi1-yNbyO3 (x=3y/4, y=0.25, 0.5, 0.6, 0.7)的晶胞精修数据Table 1 Crystal refinement data of Li2x-ySr1-xTi1-yNbyO3 (x = 3y/4, y =0.25, 0.5, 0.6, 0.7) 图1 Li2x-ySr1-xTi1-yNbyO3材料的XRD图谱Fig.1 XRD pattern of Li2x-ySr1-xTi1-yNbyO3 图2 Li2x-ySr1-xTi1-yNbyO3 (x=3y/4, y=0.25, 0.5, 0.6, 0.7)的拟合XRD图谱Fig.2 Fitted XRD patterns of Li2x-ySr1-xTi1-yNbyO3 (x = 3y/4, y = 0.25, 0.5, 0.6, 0.7) 图3为Li2x-ySr1-xTi1-yNbyO3(x=3y/4,y=0.25, 0.5,0.6, 0.7, 0.75)系列固体电解质的微观形貌图. 各组分的平均晶粒直径分别为2.1、3.8、5.2、5.7和7.2 μm,随着y值的增加,材料的晶粒的尺寸也逐渐增大. 晶粒之间结合较为紧密,但随着锂含量的增加,逐渐出现了锂元素挥发产生的气孔. 图3 Li2x-ySr1-xTi1-yNbyO3材料的SEM图Fig.3 SEM photographs of Li2x-ySr1-xTi1-yNbyO3 图4(a)~(d)分别为y= 0.25、0.5、0.6、0.7、0.75样品的 XPS总谱图,以及 Sr 3d、Ti 2p、Nb 3d的高精度XPS谱图. 所有的结合能数据以C 1s的结合能(284.6 eV)进行修正. 由图 4(b)可知,Sr 3d有两个峰,位于132.7 eV与134.4 eV的峰分别为Sr 3d5/2与Sr 3d3/2,与La0.4Sr0.6CoO3中的 Sr2+结合能相同[23]. 在图 4 (c)中,位于 458.0 eV 与 463.8 eV的峰对应着Ti 2p3/2与Ti 2p1/2,与Li0.35La0.35Sr0.3TiO3中的 Ti4+结合能相同[24]. 图 4(d)为 Nb 3d的 XPS谱图,其中位于206.5 eV与209.3 eV的峰分别为Nb 3d5/2与 Nb 3d3/2,与 Sr1-xNbO3-δ(Sr∶Nb=1.3)中的 Nb5+结合能相同[25]. 综上,材料中 Sr、Ti、Nb 元素的价态分别为二价、四价、五价. 图4 Li2x-ySr1-xTi1-yNbyO3样品的 XPS 总谱图(a)及 Sr 3d(b)、Ti 2p(c)、Nb 3d(d)的区域 XPS 谱图Fig.4 XPS spectra of Li2x-ySr1-xTi1-yNbyO3 samples (a), regions XPS spectra of Sr 3d (b), Ti 2p (c), Nb 3d (d) Li2x-ySr1-xTi1-yNbyO3(x=3y/4,y=0.25, 0.5, 0.6,0.7, 0.75)系列固体电解质在20 ℃测试条件下的阻抗图谱如下图5所示,其中,Z′表示交流阻抗图谱的实部,Z′′表示的是虚部. 可以看出各组分固体电解质的交流阻抗图谱均只含有一个半圆弧和一条倾斜的直线,所有材料均不能区分晶粒电阻和晶界电阻,可以认定为半圆弧代表的是材料的总阻抗. 经过计算,可以得到Li0.25Sr0.625Ti0.5Nb0.5O3、Li0.3Sr0.55Ti0.4Nb0.6O3、Li0.35Sr0.475Ti0.3Nb0.7O3、Li0.375 Sr0.4375Ti0.25Nb0.75O3的总的离子电导率分别为2.52×10-5、3.22×10-5、3.62×10-5和 2.04×10-5S·cm-1.其中,Li0.125Sr0.8125Ti0.75Nb0.25O3电阻过大,电导率可以忽略不计. Li0.4Sr0.4Ti0.2Nb0.8O3并没有合成钙钛矿型结构,因而没有测试其离子电导率. 随着Nb的摩尔掺杂量的增加,Li2x-ySr1-xTi1-yNbyO3体系的离子电导率先增大后减小,Li0.35Sr0.475Ti0.3Nb0.7O3的电导率最高. 原因是:当y≤0.70时,锂离子浓度和空位浓度随摩尔掺杂量的增加而增加,有利于提高锂离子的电导率. 另外,晶胞参数的增加有利于扩大离子迁移通道,同样可以提高电导率;当y=0.75时,虽然理论锂离子浓度和空位浓度都有所提高,但是材料在烧结过程中形成了较多的杂质相不利于锂离子的传导. 图5 20 ℃时Li2x-ySr1-xTi1-yNbyO3固体电解质的交流阻抗图谱Fig.5 AC Impedance spectra of Li2x-ySr1-xTi1-yNbyO3 solid electrolytes at 20 ℃ 图6为各材料的Arrhenius曲线,经过计算,Li0.25Sr0.625Ti0.5Nb0.5O3、 Li0.3Sr0.55Ti0.4Nb0.6O3、 Li0.35 Sr0.475Ti0.3Nb0.7O3、Li0.375Sr0.4375Ti0.25Nb0.75O3的活化能分别为0.32、0.30、0.29和0.31 eV. 锂离子通过A位空位进行迁移,随着y值的增加,锂离子载流子浓度和A位空位浓度也逐渐增加,锂离子可以迁移的通道也随之增加,电导率随之升高,锂离子更容易迁移. 而y>0.7时,材料生成了贫锂的杂质相,阻碍了锂离子的迁移,活化能升高. 因此Li0.35Sr0.475Ti0.3Nb0.7O3电导率最高,活化能最低,更有利于锂离子的迁移. 图6 Li2x-ySr1-xTi1-yNbyO3固体电解质的Arrhenius曲线Fig.6 Arrhenius curves of Li2x-ySr1-xTi1-yNbyO3 solid electrolytes 对于固体电解质而言,锂离子电导率应占优的,电子电导率应忽略不计,前文交流阻抗图谱测得的电导率为总的电导率,包括锂离子电导率和电子电导率. 图7为材料的恒电位极化曲线图,Li0.25Sr0.625Ti0.5Nb0.5O3、 Li0.3Sr0.55Ti0.4Nb0.6O3、 Li0.35 Sr0.475Ti0.3Nb0.7O3、 Li0.375Sr0.4375Ti0.25Nb0.75O3的 稳定电流分别为 0.184、0.162、0.171 和 0.294 μA. 经过计算,电子电导率分别为 4.11×10-9、2.03×10-9、2.55×10-9和 8.03×10-9S·cm-1. 可以看出,材料的电子电导率要比总的电导率低四个数量级,可以忽略不计. 因而,总的电导率可以看做是锂离子电导率. 图7 Li2x-ySr1-xTi1-yNbyO3固体电解质的恒电位极化曲线Fig.7 Li2x-ySr1-xTi1-yNbyO3 solid electrolytes constant potential polarization curves 本文将具有较高离子电导率的Li0.35Sr0.475Ti0.3Nb0.7O3作为隔膜材料应用到LiFePO4/Li半电池中,由图8可知,半电池以0.2 C速度充放电可以稳定的运行100圈以上. 首次放电比容量为103.5 mA·h·g-1. 经过 100 圈循环后,放电比容量仍有 93.9 mA·h·g-1,容量保持率为 90.72%. 图 8(c)为电池的阻抗图谱,其阻抗为2206.7 Ω·cm-2. 相比文献中报道的同类电池容量,本实验中首次放电比容量较低. 原因可能是:电解质隔膜的电导率较低,增加了整体电池的阻抗,导致电池的能量损耗增加,进而降低了电池的容量. 图8 以Li0.35Sr0.475Ti0.3Nb0.7O3为隔膜LiFePO4/Li半电池的充放电曲线图(a),放电比容量与库伦效率曲线图(b),电池的阻抗图谱(c)Fig.8 Charge-discharge curves (a), discharge capacity and coulombic efficiency curves (b), AC impedance plot (c) of LiFePO4/Li half-cell with Li0.35Sr0.475Ti0.3Nb0.7O3 as the separator 本文采用高温固相法合成了Li2x-ySr1-xTi1-yNbyO3(x=3y/4, y=0.25, 0.5, 0.6, 0.7, 0.75, 0.8)系列固体电解质,XRD显示当y≤0.70时,材料为立方钙钛矿型结构. 离子电导率随着掺杂含量的增加先增后减小,Li0.35Sr0.475Ti0.3Nb0.7O3总的离子电导率最高 为 3.62×10-5S·cm-1,电子电导 率 为 2.55×10-9S·cm-1,活化能仅为 0.29 eV. 以 Li0.35Sr0.475Ti0.3Nb0.7O3为固态隔膜的LiFePO4/Li半电池的首次放电容量为 103.5 mA·h·g-1,并能稳定运行 100 圈以上.1 实验部分
1.1 材料组分设计及容许因子计算


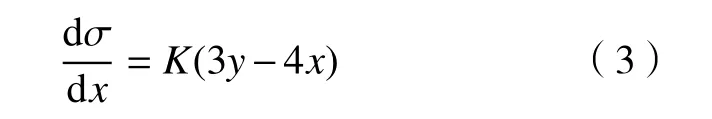

1.2 锂离子固体电解质材料制备
1.3 电池制备
1.4 测试方法
1.5 总电导率、电子电导率及活化能计算






2 结果与分析
2.1 材料物相与微观形貌分析

2.2 离子电导率与电子电导率分析

2.3 半电池充放电分析
3 结论

