啤酒糟中醇溶蛋白的提取及氨基酸组成分析
闵建华,陈世乾,冉强波,石强
(湖北理工学院化学与化工学院,湖北 黄石 435000)
世界上每年啤酒的产销量是各种酒类之首,2018年全年我国啤酒累计产量达到3 812.2万千升,是世界主要啤酒生产国和消费国之一[1]。啤酒糟作为啤酒酿造中的主要副产物,我国每年产出含水量在80%左右的啤酒糟约为300万吨。啤酒糟中主要成分为蛋白质、膳食纤维、糖类等,如不对其加以利用而直接丢弃,不仅会造成资源浪费,还会带来严重的环境污染。
啤酒糟中蛋白质含量在15%~25%之间,主要为醇溶蛋白、谷蛋白、清蛋白和球蛋白4种蛋白质[2-4]。其中醇溶蛋白占总蛋白40%~60%,不溶于水,具有较好耐热性、成膜性、膨胀性和抗氧化性,可用于保鲜、防静电、抗紫外线、隔氧、防潮等方面[5-9],并且具有一定的抑菌效果。近年来,啤酒糟除了用于饲料外,还用于发酵原料和人工栽培基料提供碳源和氮源[2-3],啤酒糟中营养物质的提取及利用也受到越来越多的关注[10-15]。通过响应面法优化醇溶蛋白的提取工艺,并对其氨基酸组成进行测定分析,为啤酒糟综合开发利用提供参考。
1 材料与方法
1.1 材料与仪器
啤酒糟:湖北理工学院化学与化工学院发酵实验室自制;无水乙醇、茚三酮(分析纯):国药集团化学试剂有限公司。
DHG-Ш型电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司;AR2140电子天平:梅特勒-托利多仪器(上海)有限公司;D2F-6000真空干燥箱:湖北科学器材公司;UV-2700紫外分光光度计:岛津中国公司;TGL-16G台式离心机:杭州汇尔仪器设备有限公司;121MB型氨基酸自动分析仪:BECAMAN公司。
1.2 方法
1.2.1 啤酒糟醇溶蛋白提取
取一定量啤酒糟干粉,过40目筛,采用超声辅助法提取啤酒糟醇溶蛋白[16-17]。
1.2.2 标准蛋白曲线的制作
参考文献[2,6],测定不同浓度的标准蛋白质溶液在595 nm处吸光度值,以不同浓度对应吸光度值绘制标准曲线。
1.2.3 啤酒糟醇溶蛋白提取率的计算
采用 65%的乙醇溶液,液料比为 4∶1(mL/g),经过超声处理20 min,进行浸提,在4 000 r/min条件下离心15 min,收集上清液,重复上述操作3次,合并3次收集的上清液,经减压蒸馏,冷冻干燥后得到粗醇溶蛋白粉,595 nm处测定吸光度,可得提取醇溶蛋白质量,采用下式计算提取率[9]。

1.2.4 单因素试验
称取5.0 g啤酒糟干粉进行试验,分别研究不同的乙醇体积分数、超声时间、液料比对醇溶蛋白提取率的影响。各因素水平取值分别为:乙醇体积分数55%、60%、65%、70%、75%、80%;液料比 1∶1、2∶1、4∶1、6∶1、8∶1、10∶1(mL/g);超声时间 5、10、20、30、40、50 min。
1.2.5 响应面法优化试验方案
采用响应面法对试验数据进行处理,选用Box-Behken模型对乙醇体积分数、液料比、超声时间等影响因素进行响应面设计,以醇溶蛋白提取率为响应值进行优化。具体因素水平见表1。

表1 醇溶蛋白提取响应面因素水平设计Table 1 Response surface factor level design of gliadin extraction
1.2.6 氨基酸含量的测定
采用GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》中氨基酸的测定方法,对提取的醇溶蛋白采用氨基酸分析仪进行氨基酸含量的测定。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对大麦醇溶蛋白提取率的影响乙醇体积分数对醇溶蛋白提取率的影响见图1。

图1 乙醇体积分数对醇溶蛋白提取率的影响Fig.1 Effect of ethanol volume fraction on the extraction rate of alcohol-soluble protein
大麦醇溶蛋白主要为单链蛋白,多由非极性氨基酸构成,无亚基结构和肽链间二硫键,肽与肽之间主要通过氢键和疏水键相互作用。因含有较多疏水性残基导致醇溶蛋白有较高的疏水性,而易溶解于非极性溶剂中[18-20]。由图1可知,随着乙醇体积分数的增加,蛋白质提取率逐渐增大,在乙醇体积分数达到65%时,醇溶蛋白提取率达到最大值1.4%,因此本试验选择乙醇体积分数为65%作为醇溶蛋白提取适宜溶剂浓度。
2.1.2 液料比对醇溶蛋白提取率的影响
液料比对醇溶蛋白提取率的影响见图2。
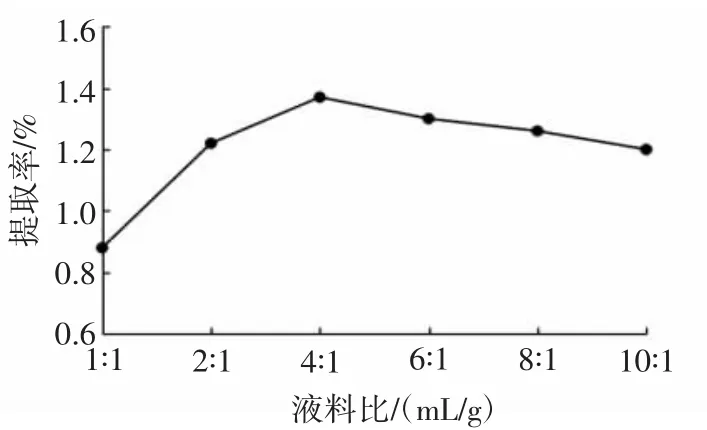
图2 液料比对醇溶蛋白提取率的影响Fig.2 Effect of the ratio of liquid to solid on the extraction rate of alcohol-soluble protein
由图2可见,随着液料比的增加,醇溶蛋白提取率逐渐增大,在液料比为 4∶1(mL/g)时,醇溶蛋白的提取率达到最大值1.37%。之后,在液料比继续增加的情况下,醇溶蛋白的提取率不再增大,说明醇溶蛋白在液料比为4∶1(mL/g)时已被充分提取,继续增加液料比,会造成溶剂等资源的浪费,因此本试验选择液料比为4∶1(mL/g)作为醇溶蛋白提取适宜液料比。
2.1.3 超声时间对醇溶蛋白提取率的影响
超声时间对醇溶蛋白提取率的影响见图3。
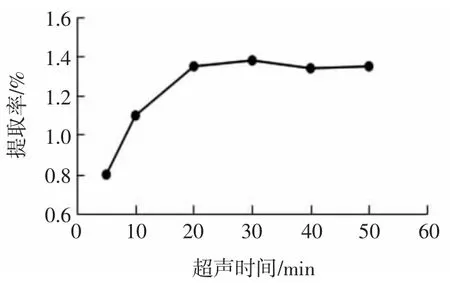
图3 超声时间对醇溶蛋白提取率的影响Fig.3 Effect of ultrasonic duration on extraction rate of alcoholsoluble protein
由图3可知,随着超声时间的增加,醇溶蛋白提取率逐渐增大,超声波处理可对蛋白质产生强有力的物理作用,随着超声波处理的进行,使得醇溶蛋白更容易分散到溶剂中被提取出来。在超声时间为30 min时,醇溶蛋白提取率达到最大值1.38%,之后随着时间的延长,醇溶蛋白提取率变化不大。因此本试验选择超声波提取时间为30 min,作为醇溶蛋白提取适宜超声时间。
2.2 响应面优化方案
2.2.1 响应面试验结果与分析
在单因素试验基础上利用Design-Expert 8.6.0软件按照Box-Behnken原理进行响应面设计,试验方案及结果见表2。

表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments

续表2 Box-Behnken试验设计及结果Continue table 2 Design and results of Box-Behnken experiments
2.2.2 回归方程的建立与检验
根据表2,利用Design-Expert 8.6.0软件对试验数据进行回归分析,由此得到提取大麦醇溶蛋白对乙醇体积分数、液料比、超声时间的二次多项回归方程为:Y=1.45+0.043A-5.687×10-3B+0.028C-2.325×10-3AB+4.475×10-3AC-0.021BC-0.13A2-0.14B2-0.13C2。
对回归模型各项方差进行分析,结果见表3。

表3 回归模型各项方差分析Table 3 Analysis of variance of each regression model
通过表3方差分析可以看出,该模式P<0.001,表明二次回归方程模型极显著,模型的相关系数R2=0.999 7,校正决定系数R2Adj=0.920 9,表明模型实际值与预测值拟合良好,失拟项P=0.673 5>0.05,失拟不显著,试验误差小,因此可用该模型对醇溶蛋白提取试验进行分析与预测。
各因素对醇溶蛋白提取率的影响都极显著,表明乙醇体积分数、液料比和超声时间对大麦醇溶蛋白提取率影响较大;超声时间与乙醇体积分数、超声时间与液料比、液料比与乙醇体积分数都存在交互作用,因此表明各因素对大麦醇溶蛋白提取率的影响不是简单的线性关系。
2.2.3 双因素交互作用分析
液料比和乙醇体积分数的交互作用响面图见图4。

图4 液料比和乙醇体积分数的互交作用Fig.4 Interaction between liquid-solid ratio and ethanol volume fraction
超声时间和乙醇体积分数的交互作用响应面图见图5。
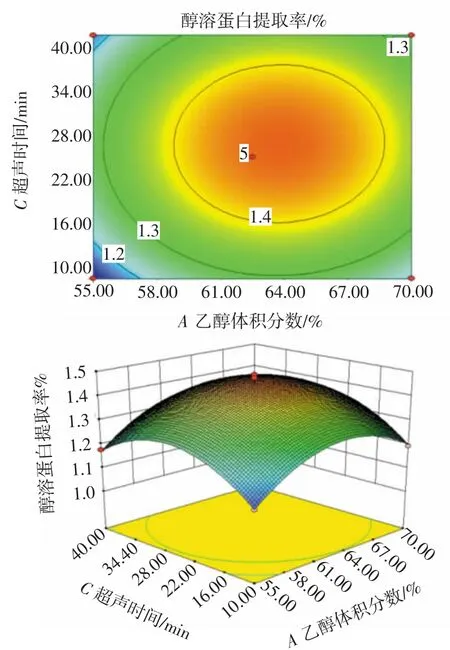
图5 超声时间和乙醇体积分数的交互作用Fig.5 Interaction between ultrasonic time and ethanol volume fraction
超声时间和液料比的交互作用响应面图见图6。

图6 超声时间和液料比的交互作用Fig.6 Interaction between ultrasonic time and liquid-solid ratio
由图4可知,当超声时间固定在26 min时,液料比与乙醇体积分数的交互作用显著,在所选范围内有极值;由图 5 可知,液料比固定为 4∶1(mL/g)时,乙醇体积分数与超声时间交互作用明显,醇溶蛋白提取率随着时间的作用效果延长而增加,当超声时间为26 min左右,乙醇体积分数为64%时,醇溶蛋白提取率最大;由图6显示,当乙醇体积分数为65%时,醇溶蛋白提取率受液料比和超声时间的影响较大。醇溶蛋白提取率随着液料比、超声时间的增加而变大,当液料比为4∶1(mL/g),超声时间为 26 min 左右时,醇溶蛋白提取率最大,为1.35%左右
2.2.4 优化提取工艺参数的验证
采用Design-Expert 8.6.0软件,分析得到的最佳工艺提取条件是:超声时间26.66 min,液料比4.45∶1(mL/g),乙醇体积分数63.26%。在此条件下大麦醇溶蛋白提取率为1.45613%。考虑到实际操作条件,确定最佳提取条件为超声时间27 min,液料比为4.5∶1(mL/g),乙醇体积分数为64%。经过3次平行试验,醇溶蛋白的提取率为1.4%,与理论值相差不大。
2.3 氨基酸成分分析
啤酒糟醇溶蛋白氨基酸组成见表4。87.7%,必需氨基酸含量在20.52%,非必需氨基酸含量为67.18%。含量最高氨基酸为谷氨酸,含量达到40.221%,其次为脯氨酸,含量为12.991%,而作为粮食作物的第一限制性氨基酸赖氨酸含量为0.889%,含量较低。
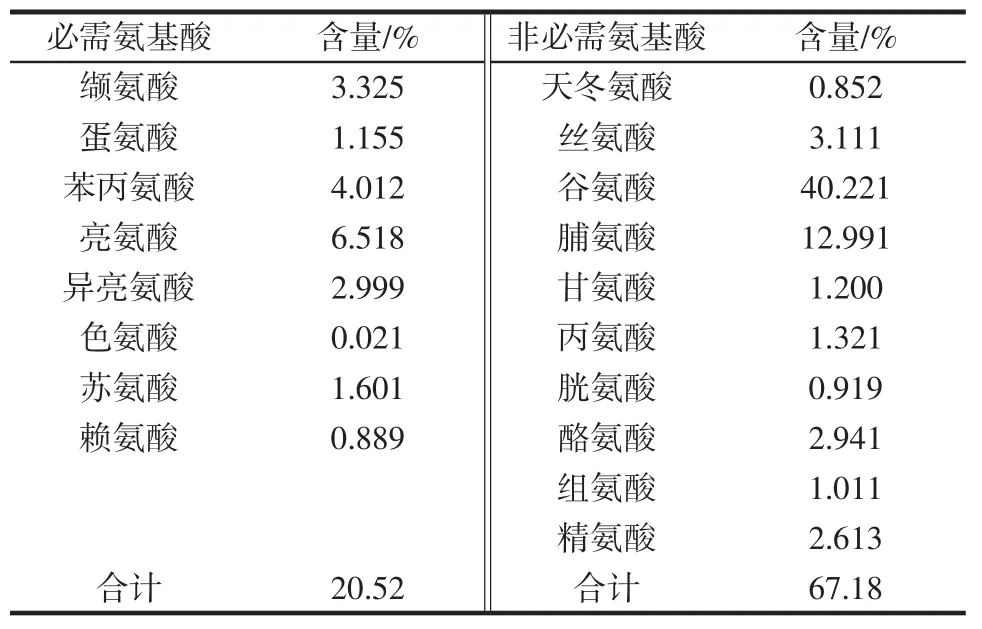
表4 啤酒糟醇溶蛋白氨基酸组成Table 4 Amino acid composition of gliadin
啤酒糟醇溶蛋白氨基酸评分见表5。

表5 啤酒糟醇溶蛋白氨基酸评分Table 5 Score of gliadin amino acids
由表5可知,根据世界卫生组织建议,以鸡蛋蛋白质所含氨基酸比例为标准,评分为100分,对啤酒糟醇溶蛋白氨基酸进行评分,得分为46.7分,低于常见大豆蛋白氨基酸得分74分。结合表4结果,啤酒糟醇溶蛋白中必需氨基酸含量占总氨基酸含量23.4%,必需氨基酸含量占非必需氨基酸含量的30.5%,而联合国粮食及农业组织/世界卫生组织建议,理想蛋白质以上两项占比分别要大于36%和60%[20],说明啤酒糟醇溶蛋白氨基酸比例不理想,没有达到理想蛋白质氨基酸比例要求,限制了啤酒糟在食品营养方面的应用。但是,啤酒糟醇溶蛋白含较多疏水性氨基酸,蛋白质之间主要通过氢键和疏水键相互作用,使蛋白质分子间具有一定的水不溶性及延伸性,可通过一定技术手段制成天然高分子膜在食品保鲜等方面得到很好的应用[5,21-25]。
3 结论
在单因素分析基础上,通过响应面法对大麦醇溶蛋白的提取工艺进行优化设计,通过Box-Behnken试验设计建立数学模型,并进行响应面分析,得出最佳提取工艺:超声时间 27 min,液料比 4.5∶1(mL/g),乙醇体积分数64%,此时最大醇溶蛋白提取率为1.4%。通过该法提取啤酒糟中醇溶蛋白,技术手段简单,提取效率较高,可为啤酒糟的工业化综合开发利用提供依据。通过对啤酒糟醇溶蛋白氨基酸含量及比例进行分析,得出啤酒糟醇溶蛋白在食品营养学方面不是一种良好蛋白质来源,但是因其特殊的氨基酸组成,使其具有柔软、可食,黏稠及高弹性,可在食品保鲜、包装及制药等领域得到很好的应用。

