褪黑素对蛛网膜下腔出血小鼠模型早期脑损伤的影响及机制研究
杨松,李军鹏,王彦茗,马廉亭
据统计,蛛网膜下腔出血(subarachnoid hemorrhage,SAH)发病30 d内死亡率高达50%,且50%以上的幸存者伴有不可逆的神经功能损伤,给患者家庭及社会带来沉重的负担[1]。SAH的主要发病原因是颅内动脉瘤破裂和颅内血管畸形,且以颅内动脉瘤破裂多见。近年随着手术技术的提高,越来越多的SAH患者能够得到较好的治疗,但术后仍有部分患者出现情感和认知障碍[2]。研究表明,SAH后迟发性脑血管痉挛是患者死亡的主要原因之一,但减轻迟发性脑血管痉挛又不能改善患者预后[3]。近年有学者提出了早期脑损伤(early brain injury,EBI)的概念并认为其是SAH患者致死、致残的主要原因之一[4]。因此,研究SAH后EBI的发生机制、寻找药物靶点可能为SAH患者提供新的治疗思路。本实验通过构建SAH小鼠模型并给予褪黑素(melatonin,MT)干预后发现,MT能有效减轻SAH后EBI,其机制可能与MT保护神经元、抑制神经元凋亡有关,现报道如下。
1 材料与方法
1.1 实验动物 本实验时间为2019年9月至2020年6月。选取健康成年C57BL/6J雄性小鼠54只,体质量22~25 g,饲养于SPF级实验动物屏障环境中,温度(25 ℃)、湿度(65%)恒定,12 h光照/黑暗交替进行;并给予小鼠充足的灭菌饮用水、专用饲养饲料。所有小鼠适应性饲养3 d后,随机分为假手术组(Sham组)、SAH组、SAH+MT组,每组18只。所有实验操作经过中部战区总医院动物伦理委员会批准,且严格遵守相关操作规范和规定。
1.2 主要试剂及仪器 本实验过程中的主要试剂及仪器见表1~2。

表1 主要试剂Table 1 Main reagents
表2 主要仪器Table 2 Main instruments
1.3 实验方法 所有小鼠造模前禁食12 h,禁水6 h。SAH组和SAH+MT组小鼠经戊巴比妥钠(30 mg/kg)麻醉后仰卧位固定于手术板上,仔细分离颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(exernal carotid artery,ECA),结扎ECA近心端及远心端,中间剪断,并在ICA和ECA分叉处的ECA起始部置线,然后将ICA、CCA采用动脉夹夹闭,将线栓由ECA插入,打开ICA处动脉夹,将线栓插入ICA;将进入ICA的锐化尼龙线继续插入至翼腭动脉起始部时,轻抬ECA使此处的弯曲消失,以利于尼龙线顺利通过。向远端继续插入尼龙线至ICA颅内段,有阻力感后再插入2 mm左右,刺破willis环,造成SAH后迅速将尼龙线拔出,缝合创口[5]。Sham组小鼠除不刺破willis环外,其他手术操作同SAH组和SAH+MT组。待小鼠复苏后放回鼠笼。SAH+MT组小鼠分别于造模后2 h及12 h腹腔注射MT 150 mg/kg[6],SAH组小鼠分别于造模后2 h及12 h腹腔注射等体积0.9%氯化钠溶液。造模后24 h,各组分别选取6只小鼠进行Garcia评分,之后处死并取脑组织测定含水量,选取6只小鼠用于尼氏染色实验及TUNEL染色,选取6只小鼠用于提取蛋白组织并进行Western Blot。
1.4 建模成功的标准 建模后24 h取小鼠脑组织评估SAH严重程度,具体如下:将基底包括脑干分为6个节段,每个节段分为0~3级,对应评为0~3分:0级为无SAH;1级为轻度SAH;2级为中度SAH伴可辨认动脉;3级为SAH覆盖脑动脉。6个节段得分之和≥8分为造模成功,剔除造模不成功小鼠并重新补充小鼠进行建模。
1.5 观察指标
1.5.1 神经功能缺损程度 参考Garcia评分系统评估三组小鼠神经功能缺损程度[7],包括前肢伸展(0~3分)、自发活动(0~3分)、攀爬(1~3分)、四肢运动的对称性(0~3分)、对触痛的反应(1~3分)和本体感觉(1~3分)6项内容,Garcia评分越高表明神经功能缺损越严重。Garcia评分均是在对研究者和数据测量者施盲的情况下进行的。
1.5.2 脑含水量 采用标准湿法测定三组小鼠脑含水量,具体如下:建模后24 h,采用1%的戊巴比妥钠深度麻醉小鼠,立刻断头取脑组织,分离右脑、左脑、大脑半球和脑干,并尽快采用电子分析天平称取其湿重;大脑切片后在105 ℃下干燥24 h,尽快采用电子分析天平称取其干重,并计算脑含水量,脑含水量=(湿重-干重)/湿重×100%。
1.5.3 大脑皮质存活神经元数目 采用尼氏染色实验观察大脑皮质存活神经元情况,具体如下:取全脑组织制成石蜡切片,脱蜡至水,切片置于60 ℃温箱,采用0.5%甲苯胺蓝染色40 min;95%乙醇镜下控制分色,脱水封固;在高倍镜下(×400)观察小鼠右侧颞叶皮质切片连续5个相邻视野,并记录存活神经元数目。
1.5.4 神经元凋亡率 采用TUNEL染色检测神经元凋亡情况,主要步骤如下:脑组织切片先在50 μl TUNEL反应缓冲液中孵化1 h,期间保持37 ℃和黑暗湿润的环境。然后,切片采用DAPI孵育5 min,以染出所有细胞核,采用封固液封固,调整荧光显微镜激发波长范围为450~500 nm,发射波长范围为515~565 nm,观察视野并拍照(绿色荧光)。最后,采用流式细胞仪测定TUNEL阳性神经元数目。神经元凋亡率=TUNEL阳性神经元数目/总神经元数目×100%。
1.5.5 凋亡相关蛋白相对表达量 采用Western Blot检测Bax蛋白、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)蛋白、Caspase-3蛋白相对表达量,主要步骤如下:配制裂解液,研磨组织,裂解提取小鼠右侧颞叶皮质总蛋白;配制SDS-PAGE凝胶,蛋白样品变性处理,上样,电泳,转膜,封闭,一抗孵育,二抗孵育,蛋白显影,重复3次取平均值。
1.6 统计学方法 应用SPSS 20.0统计学软件进行数据处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损程度和脑含水量 三组小鼠Garcia评分及右脑、左脑、大脑半球、脑干含水量比较,差异有统计学意义(F值分别为56.35、60.36、47.87、30.17、26.34,P值均< 0.001);SAH组和SAH+MT组小鼠Garcia评分低于Sham组,右脑、左脑、大脑半球、脑干含水量高于Sham组,差异有统计学意义(P<0.05);SAH+MT组小鼠Garcia评分高于SAH组,右脑、左脑、大脑半球、脑干含水量低于SAH组,差异有统计学意义(P<0.05),见图1。
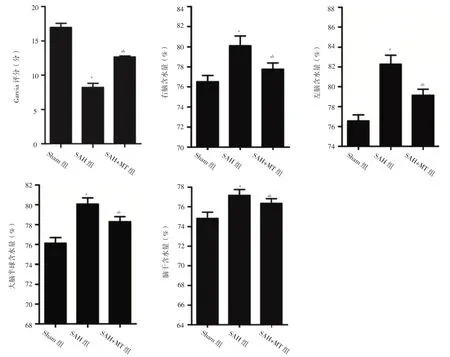
图1 三组小鼠Garcia评分及右脑、左脑、大脑半球、脑干含水量比较Figure 1 Comparison of Garcia score and water content of right brain,left brain,cerebral hemisphere and brain stem among the three groups
2.2 大脑皮质神经元情况 三组小鼠大脑皮质存活神经元数目比较,差异有统计学意义(F=26.14,P<0.01);SAH组和SAH+MT组大脑皮质存活神经元数目少于Sham组,SAH+MT组大脑皮质存活神经元数目多于SAH组,差异有统计学意义(P<0.05),见图2。Sham组小鼠大脑皮质存活神经元数目最多且状态最好,神经元胞体与尼氏小体清晰可见;SAH组小鼠大脑皮质存活神经元排列松散且出现染色质凝集;SAH+MT组小鼠存活神经元状态较SAH组明显改善,尼氏小体数量较SAH组有所增加,见图3。三组小鼠大脑皮质神经元凋亡率比较,差异有统计学意义(F=60.42,P<0.01);SAH组和SAH+MT组小鼠大脑皮质神经元凋亡率高于Sham组,SAH+MT组小鼠大脑皮质神经元凋亡率低于SAH组,差异有统计学意义(P<0.05),见图4~5。2.3 凋亡相关蛋白相对表达量 三组小鼠Bax蛋白、Bcl-2蛋白、Caspase-3蛋白相对表达量比较,差异有统计学意义(F值分别为42.17、85.25、54.19,P值均<0.01);SAH组与SAH+MT组小鼠Bax蛋白、Caspase-3蛋白相对表达量高于Sham组,Bcl-2蛋白相对表达量低于Sham组,差异有统计学意义(P<0.05);SAH+MT组小鼠Bax蛋白、Caspase-3蛋白相对表达量低于SAH组,Bcl-2蛋白相对表达量高于SAH组,差异有统计学意义(P<0.05),见图6。
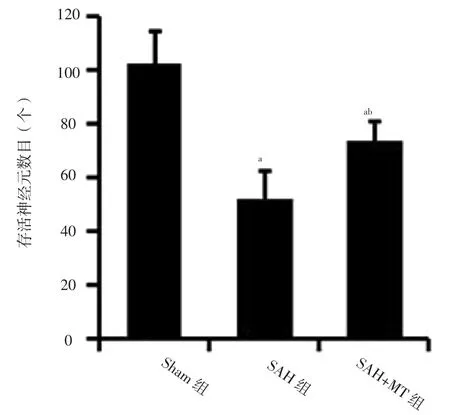
图2 三组小鼠大脑皮质存活神经元数目比较Figure 2 Comparison of number of surviving neuron of cerebral cortex among the three groups
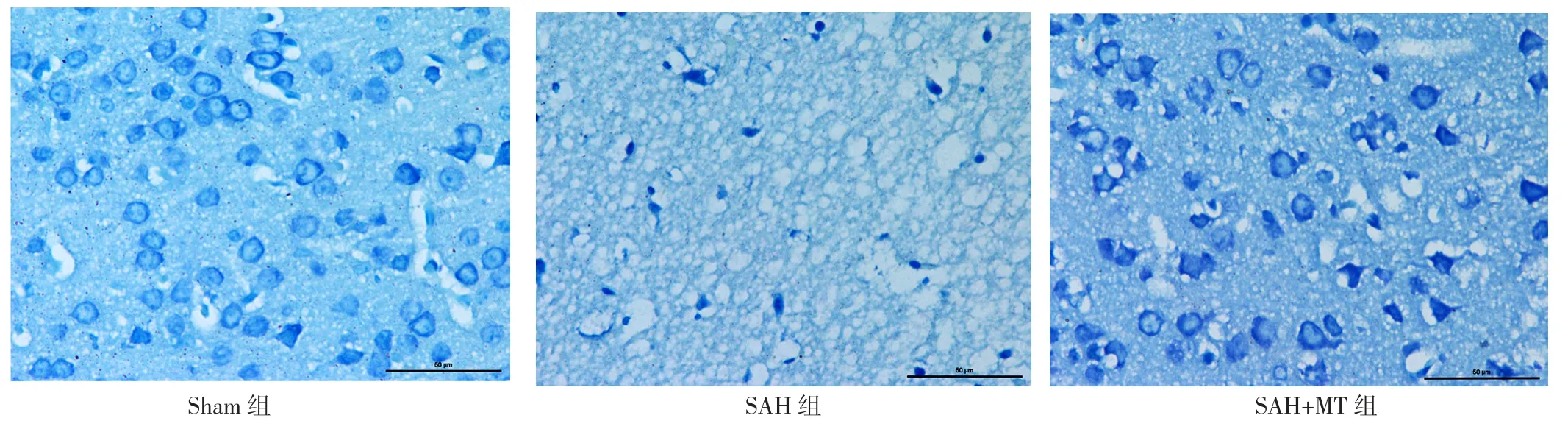
图3 三组小鼠脑组织尼氏染色结果(×400)Figure 3 Nissl staining results of brain tissue in three groups of mice
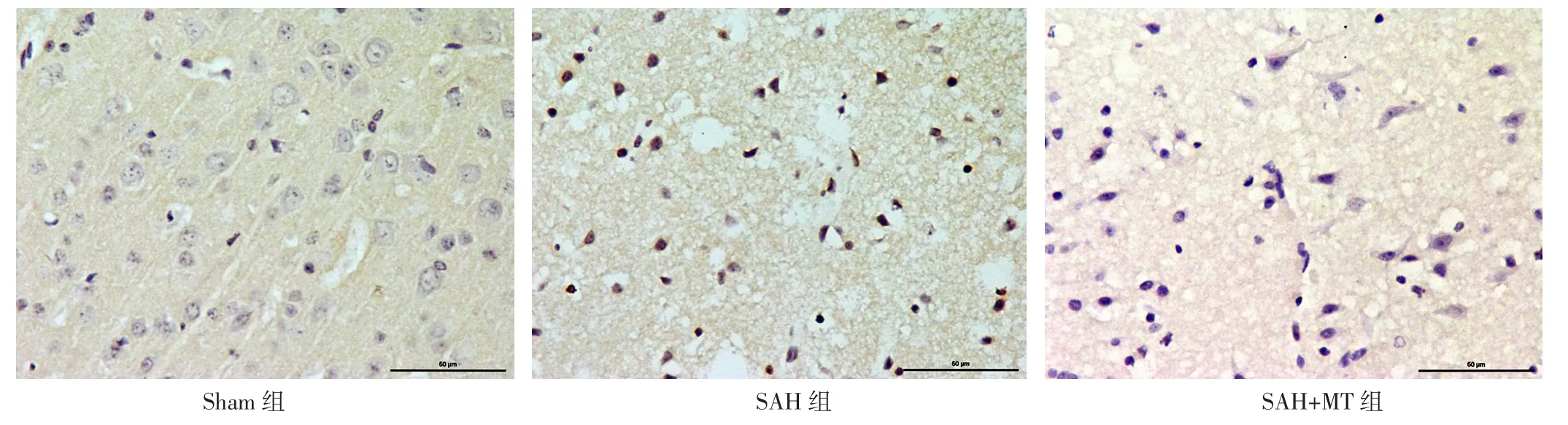
图4 三组小鼠大脑皮质神经元形态Figure 4 Morphology of cerebral cortex of the three groups
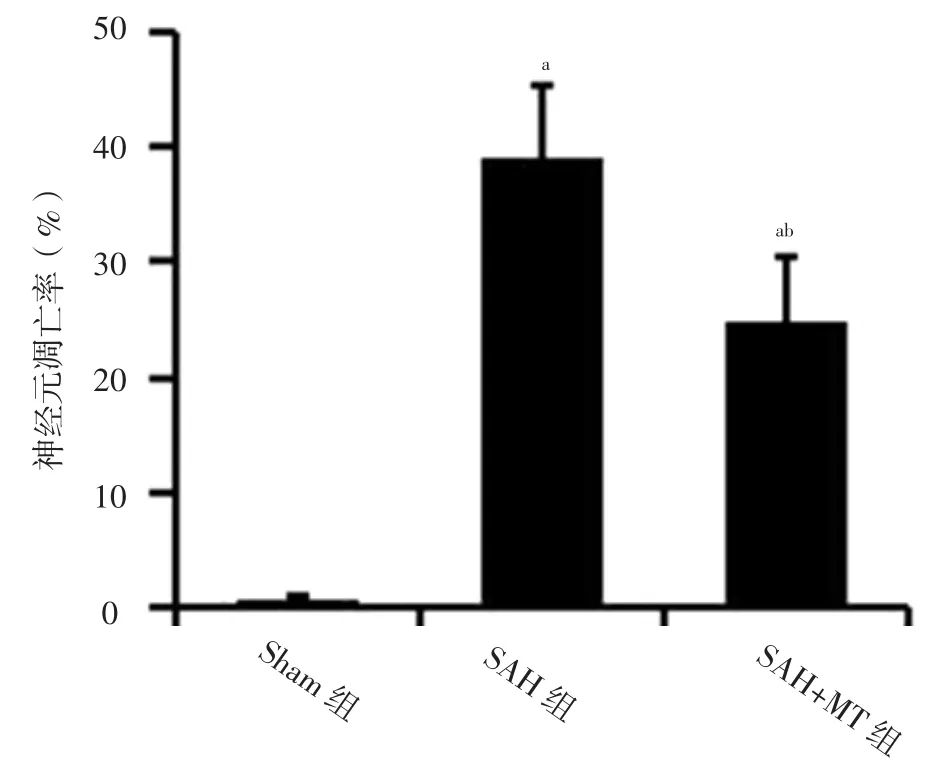
图5 三组小鼠大脑皮质神经元凋亡率比较Figure 5 Comparison of neuronal apoptosis rate of cerebral cortex among the three groups
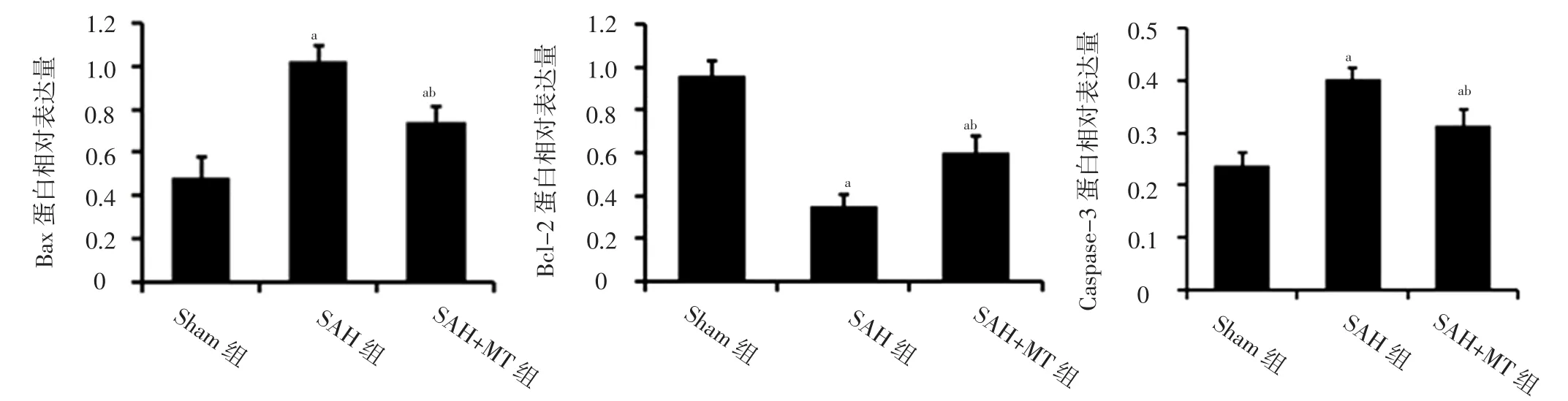
图6 三组小鼠凋亡相关蛋白相对表达量比较Figure 6 Comparison of relative expression levels of apoptosis related proteins among the three groups
3 讨论
脑血管痉挛指颅内动脉的持续性收缩状态,其是SAH的并发症之一,且被认为是SAH后的主要致死原因之一,但减轻迟发性脑血管痉挛又不能改善患者预后[2]。既往研究表明,SAH患者出血后30 d内死亡者占50%,且死亡病例中60%~70%是在SAH后48 h内死亡,但迟发性血管痉挛常于SAH后1~2周出现[8],这说明迟发性脑血管痉挛并非是SAH后的主要致死原因。近年研究认为,SAH后EBI可能是导致患者致残、致死的主要原因,而神经元凋亡又是SAH后EBI的主要病理过程之一[9]。神经元凋亡可分为诱导启动阶段、细胞内调控阶段、实施阶段和吞噬搬运4个阶段[10],对凋亡进程有重要作用的凋亡相关蛋白包括Caspase蛋白家族、IAP蛋白家族、Bcl-2蛋白家族及P53蛋白等,其中Bcl-2蛋白家族的主要功能是调节线粒体膜的通透性,家族成员通过形成同源(Bcl-2/Bcl-2,Bax/Bax)或异源(Bcl-2/Bax)二聚体而影响细胞色素c的释放,最终Bcl-2同源二聚体可抑制细胞凋亡,Bax异源二聚体可促进细胞凋亡,但无论哪一条凋亡信号途径均需要通过激活Caspase蛋白家族实现。
MT又名抑黑素,最早是于牛松果体内提取出来的,因其可以使皮肤的黑色素凝集从而变白而得名,其主要由松果体分泌,人视网膜也能分泌少量的MT[11]。MT在心脏和肾脏等多种器官的缺血和再灌注损伤中均具有重要的保护作用,临床研究表明,术前以预防为目的地注射MT能够明显改善患者心脏功能,减轻氧化损伤和心肌细胞凋亡[12]。
林达等[13]研究表明,MT可以减轻SAH后细胞凋亡,从而减轻SAH后EBI。毛崇丹等[14]进行的动物实验表明,MT可以抑制NLRP3炎性小体,从而减轻小鼠SAH后EBI。也有研究表明,MT可以通过抗炎、抗氧化机制而减轻SAH后脑损伤[15]。本研究结果显示,SAH组和SAH+MT组小鼠Garcia评分低于Sham组,右脑、左脑、大脑半球、脑干含水量及大脑皮质神经元凋亡率高于Sham组,大脑皮质存活神经元数目少于Sham组;SAH+MT组小鼠Garcia评分高于SAH组,右脑、左脑、大脑半球、脑干含水量及大脑皮质神经元凋亡率低于SAH组,大脑皮质存活神经元数目多于SAH组,提示SAH小鼠存在神经功能缺损、脑水肿及神经元凋亡增加等情况,而MT能有效减轻神经功能缺损、脑水肿并抑制神经元凋亡。本研究结果还显示,SAH组与SAH+MT组小鼠Bax蛋白、Caspase-3蛋白相对表达量高于Sham组,Bcl-2蛋白相对表达量低于Sham组(P<0.05);SAH+MT组小鼠Bax蛋白、Caspase-3蛋白相对表达量低于SAH组,Bcl-2蛋白相对表达量高于SAH组,提示SAH小鼠Bax蛋白表达上调、Bcl-2蛋白表达下调,Bax/Bcl-2比例升高,裂解性Caspase-3明显升高,细胞更倾向于发生凋亡;而MT能够下调Bax蛋白,上调Bcl-2蛋白水平,降低Bax/Bcl-2比例,抑制Caspase-3蛋白活化,从而抑制SAH后神经元凋亡。
综上所述,SAH小鼠存在神经功能缺损、脑水肿及神经元凋亡增加等情况,而MT可以通过下调Bax蛋白表达、上调Bcl-2蛋白表达、抑制Caspase-3蛋白活化而阻断神经元凋亡过程,进而减轻SAH后EBI;但MT的具体作用通路及靶点还不明确,仍需后期进一步研究。
作者贡献:杨松进行文章的构思与设计,负责撰写、修订论文;李军鹏进行研究的实施与可行性分析,数据收集、整理、分析;王彦茗进行结果分析与解释;马廉亭负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

