杞归八味口服液对鱼藤酮诱导PC12细胞损伤的防护作用*
傅若秋,李 斌,王显凤,张 琳,王林丽,陈剑鸿
(中国人民解放军陆军军医大学大坪医院药剂科,重庆400042)
神经退行性疾病是中老年人的常见疾病,如阿尔茨海默病、帕金森病、肌萎缩侧索硬化、多发性硬化等[1],发病原因较复杂,大多机制不明,其共同点为大脑和脊髓的神经元细胞发生病变,出现损伤,常用的治疗策略为对神经元细胞进行保护[2]。中药及中药单体在调节神经系统、保护神经细胞方面有独特作用,如半夏泻心汤、天麻钩藤饮、槲皮素、花青素等多种中药复方制剂或中药单体均可防护神经细胞免受损伤[3-6]。杞归八味口服液(曾用名益精灵口服液)为我院特色自制制剂,由何首乌、枸杞子、菟丝子、牛膝、当归、补骨脂、茯苓、陈皮8味中药组方,具有健脑安神、滋补肝肾功效,用于治疗失眠多梦、健忘、腰膝酸软、神疲乏力等症,疗效显著,已在临床使用近30年。其组方中所含甜菜碱、β蜕皮甾酮、异鼠李素等活性成分具有神经保护作用[7-9]。前期研究证实,其具有神经系统调节作用,可抗抑郁和增强小鼠的学习能力[10]。本研究中探讨了杞归八味口服液对鱼藤酮诱导PC12细胞损伤的防护作用及其作用机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:3111型CO2细胞培养箱(美国Thermo公司);GS-15KGS型高速冷冻离心机(美国Beckman公司);CKX41型光学倒置显微镜(日本Olympus公司);165-8001型蛋白电泳仪、转膜槽、Chem I Doc型超高灵敏度化学发光成像系统(美国Bio-Rad公司);HR30-11A2型生物安全柜(青岛海尔股份有限公司);C6型流式细胞仪(美国BD公司);STNERGYH1型酶标仪(美国Agilent公司)。
试药:杞归八味口服液(医院制剂,批号为200413);鱼藤酮(美国Selleck公司,批号为S2348);PRIM培养基(美国Hyclone公司,批号为SH30809.01);胎牛血清(天津康源生物技术有限公司,批号为20200408);Western细胞裂解液(批号为P0013),BCA蛋白浓度测定试剂盒(批号为P0009),胰酶消化液(批号为C02010),均购自上海碧云天生物技术有限公司;细胞凋亡检测试剂盒(美国BD公司,批号为556547);CCK-8试剂盒(美国MCE公司,批号为HY-K0301);辣根酶标记山羊抗兔免疫球蛋白(Ig)G(北京中杉金桥生物技术有限公司,批号为ZB2305);预染蛋白Marker(美国Thermo公司,批号为26619型);蛋白激酶B(AKT)抗体(批号为ab200195),磷酸化AKT(p-AKT)抗体(批号为ab192623),哺乳动物雷帕霉素靶蛋白(mTOR)抗 体(批 号 为ab2723),磷 酸 化mTOR(pmTOR)抗体(批号为ab137133),c-Jun氨基端蛋白激酶(JNK)抗体(批号为ab179461),磷酸化JNK(p-JNK)抗体(批号为ab124756),均购自美国Abcam公司;磷酸甘油醛脱氢酶(GAPDH)抗体(美国CST公司,批号为21185);聚腺苷二磷酸-核糖多聚酶(PARP)抗体(批号为13371-1-AP),cleaved-Caspase3(c-Caspase3)抗体(批号为19677),均购自武汉三鹰生物技术有限公司)。
细胞:鼠肾上腺髓质嗜铬细胞瘤PC12细胞株(美国ATCC细胞库,批号为CRL-1721)。
1.2 方法
1.2.1 细胞培养
PC12细胞用PRIM培养基(含10%胎牛血清)于37℃、5% CO2条件下恒温培养箱中培养,隔天传代,取对数生长期细胞进行试验。
1.2.2 CCK-8试验检测
取对数生长期的PC12细胞,经胰酶消化后得细胞悬液,按(5 000个细胞,90 μL)/孔接种于96孔板中,于37℃、5% CO2培养箱中培养24 h,加入受试药物10 μL。药物分组:1)杞归1组、2组、3组、4组、5组(以杞归八味口服液原液浓度为100%计,作用浓度分别为0.1%,0.2%,0.4%,0.6%,0.8%),药物作用24 h;2)鱼藤酮1组、2组、3组、4组、5组(相当于鱼藤酮0.5,1.0,2.0,4.0,8.0 μmol/L),药物作用24 h;3)杞归八味口服液联用鱼藤酮:空白对照组(水)、鱼藤酮4组,以及杞归1,2,3,4,5(0.2%,0.4%,0.6%,0.8%)+鱼藤酮4组,先给予杞归八味口服液预处理2 h,再给予鱼藤酮作用24 h。药物处理结束后,每孔加入CCK-8试剂10 μL,置培养箱中孵育1 h,用酶标仪于450 nm波长处检测吸光度,并计算细胞存活率。
1.2.3 流式细胞仪检测
取对数生长期的PC12细胞悬液,按2.0×105个/孔接种于6孔板中,每孔培养基体积2 mL,于37℃、5% CO2培养箱中培养24 h,给予杞归八味口服液及鱼藤酮药液作用24 h。胰酶消化后收集于15 mL离心管中,800 r/min离心5 min,弃上清液,用2 mL磷酸盐缓冲液(PBS)混悬细胞,800 r/min离心5 min,弃上清液,加入凋亡检测染色液(含Annexin V-FITC染液2 μL,PI染液5 μL,Binding buffer 100 μL),混匀,室温避光染色15 min。用流式细胞仪检测细胞凋亡情况,并计算凋亡率。
1.2.4 蛋白质印迹(Western blotting)法检测
取对数生长期的PC12细胞悬液,按2.0×106个/孔接种于100 mm培养皿中,每孔培养基10 mL,于37℃、5% CO2培养箱中培养24 h,给予杞归八味口服液预处理2 h,然后给予鱼藤酮作用24 h。提取全细胞蛋白,用BCA法测定蛋白含量。蛋白液中加入5×loading buffer混匀,于98℃加热使蛋白变性。变性后的蛋白样品用聚丙烯凝胶电泳进行分离,分离后的蛋白转至PVDF膜上,5%脱脂牛奶封闭1 h,加一抗孵育过夜。次日回收一抗,TBST漂洗后于室温下孵育二抗1 h。TBST漂洗后加入发光底物,用凝胶成像系统进行曝光。WB条带用Image J 1.37C软件测量其灰度值,以目的蛋白与内参蛋白的灰度比值作为蛋白表达水平。
1.3 统计学处理
2 结果
2.1 对PC12细胞存活率的影响
与空白对照组比较,杞归3组、4组、5组的细胞存活率均显著升高,且呈量效依赖趋势(P<0.05);鱼藤酮1组、2组、3组、4组、5组的细胞存活率均显著降低,且呈量效依赖趋势(P<0.01)。详见表1。

表1 杞归八味口服液及鱼藤酮对PC12细胞存活率的影响Tab.1 Effects of Qigui Bawei Oral Liquid and rotenone on the survival rate of PC12 cells
2.2 对鱼藤酮降低PC12细胞存活率的影响
与鱼藤酮4组比较,杞归3,4,5+鱼藤酮4组的细胞存活率均显著升高,且呈量效依赖趋势(P<0.01)。可见,联用杞归八味口服液可明显减弱鱼藤酮导致的细胞存活率下降。详见表2。

表2 杞归八味口服液对鱼藤酮降低PC12细胞存活率的影响Tab.2 Effect of Qigui Bawei Oral Liquid on rotenone reducing the survival rate of PC12 cells
2.3 对鱼藤酮诱导细胞凋亡的影响
与空白对照组比较,鱼藤酮组细胞凋亡率显著升高(P<0.01);与鱼藤酮组比较,杞归4+鱼藤酮4组细胞凋亡率显著降低(P<0.01)。可见,鱼藤酮能明显诱导PC12细胞凋亡,但杞归八味口服液能阻止鱼藤酮诱导的PC12细胞凋亡。详见图1和表3。
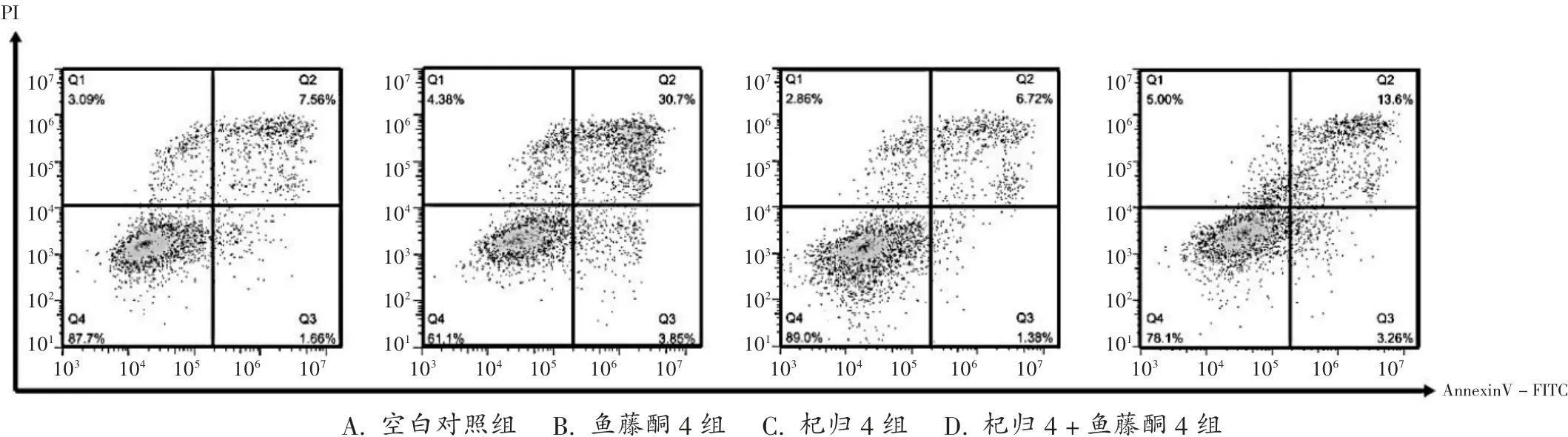
图1 流式细胞仪检测PC12细胞凋亡情况A.Blank control group B.Rotenone group 4 C.Qigui group 4 D.Qigui group 4+rotenone group 4Fig.1 The apoptosis of PC12 cells detected by flow cytometry
2.4 对鱼藤酮激活凋亡相关蛋白和AKT/mTOR及JNK信号通路的影响
与空白对照组比较,鱼藤酮4组PARP蛋白表达水平显著降低,c-Caspase3蛋白表达水平显著升高(P<0.05);与鱼藤酮组比较,杞归4+鱼藤酮4组PARP蛋白表达水平显著升高,c-Caspase3蛋白表达水平显著降低(P<0.01)。可见,鱼藤酮能明显激活凋亡相关蛋白,但联用杞归八味口服液可明显减弱鱼藤酮对凋亡蛋白的激活。与空白对照组比较,鱼藤酮4组p-AKT和p-mTOR蛋白表达水平均显著降低,p-JNK蛋白表达水平显著升高(P<0.05);与鱼藤酮4组比较,杞归4+鱼藤酮4组p-AKT和p-mTOR蛋白表达水平均显著升高,p-JNK蛋白表达水平显著降低(P<0.05)。可见,鱼藤酮抑制了AKT/mTOR信号通路,并激活了JNK信号,但联用杞归八味口服液可明显减弱鱼藤酮对AKT/mTOR及JNK信号通路的影响。详见表3和图2。
表3 细胞凋亡率及蛋白表达水平比较(±s)Tab.3 Comparison of apoptosis rate and protein expression level(±s)

表3 细胞凋亡率及蛋白表达水平比较(±s)Tab.3 Comparison of apoptosis rate and protein expression level(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与鱼藤酮4组比较,△P<0.05,△△P<0.01。Note:Compared with those in the blank control group,*P<0.05,**P<0.01;compared with those in the rotenone group 4,△P<0.05,△△P<0.01.
?

图2 Western blotting法检测PC12细胞的蛋白表达水平A.Blank control group B.Rotenone group 4 C.Qigui group 4 D.Qigui group 4+rotenone group 4Fig.2 The protein expression of PC12 cells detected by Western blotting
3 讨论
PC12细胞是一种大鼠肾上腺髓质嗜铬细胞瘤细胞株,具有神经内分泌细胞的普遍特征,且可传代,广泛用于神经生理及药理学研究[11]。鱼藤酮是一种从豆科鱼藤属植物中提取的异黄酮化合物,在农业上作为杀虫剂被广泛使用,因具有较强的神经毒性,也被作为神经细胞损伤的造模药物广泛应用[12]。在构建鱼藤酮损伤的PC12细胞模型中,不同研究者所用的鱼藤酮剂量及作用时间不一致,作用浓度为0.5~10 μmol/L,作用时间为4~24 h[13-15],这可能与各实验室所用培养条件、细胞状态及细胞对药物的敏感度不一致有关。通过前期试验,选择鱼藤酮浓度为4 μmol/L,作用时间为24 h,成功构建了PC12细胞损伤模型,细胞凋亡率可达33%,细胞活性下降约40%。
通过预试验发现,0.5%及1.0%浓度的杞归八味口服液可增强PC12细胞的活性,但2.0%浓度的杞归八味口服液反而使PC12细胞活性降低。进一步考察杞归八味口服液在0.1%~0.8%浓度范围内对PC12细胞活性的影响,结果发现0.4%~0.8%浓度的杞归八味口服液可增强PC12细胞的活性,可明显减弱鱼藤酮导致的PC12细胞活性下降,且0.6%浓度时作用即达到最大,故选择0.6%浓度作为后续药理机制研究的作用浓度。
细胞凋亡是细胞死亡的一种常见方式,也是鱼藤酮损伤PC12细胞的主要原因[16]。PARP蛋白可特异性地识别DNA断裂末端并结合,是一种重要的DNA修复酶,当凋亡发生时,可被上游的Caspase-3剪切降解而丧失DNA修复功能[17]。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,通过自身剪切激活后,再催化PARP发生降解[18]。因此,Caspase-3剪切激活及PARP发生降解被认为是凋亡发生的标志[19]。本试验结果证实,鱼藤酮诱导PC12细胞发生凋亡,Wester blotting试验结果证实,鱼藤酮可导致PARP降解(PARP蛋白表达水平降低)和Caspase-3剪切激活(c-Caspase3蛋白表达水平升高)。同时,杞归八味口服液能减弱鱼藤酮诱导的细胞凋亡,并减弱鱼藤酮导致的PARP蛋白表达水平的降低及c-Caspase3蛋白表达水平的升高,表明杞归八味口服液减轻了鱼藤酮对PC12细胞的损伤作用。
常见的有PI3K/AKT/mTOR,MAPK(JNK/ERK/P38),STAT3,Wnt/β-catenin,NF-κB等[20]信号通路蛋白参与细胞凋亡的调控。而AKT/mTOR通路的抑制及JNK信号激活是鱼藤酮导致神经细胞损伤的常见机制[21-22]。AKT是一种丝氨酸/苏氨酸蛋白激酶,作用广泛,与细胞内许多信号通路有关;mTRO是AKT的下游分子,属于一种不典型的丝氨酸/酪氨酸蛋白激酶。AKT/mTOR信号通路对维持细胞存活、促进细胞增殖和生长非常重要。在中枢神经诱导损伤的研究中发现,抑制AKT/mTOR通路可加重神经细胞的损伤作用,而激活该通路则可对神经细胞起保护作用[23]。JNK是一种丝氨酸/苏氨酸蛋白激酶,属于MAPK家族的一员,在细胞凋亡的调控中发挥重要作用,JNK磷酸化激活后能介导多种细胞(如神经、心肌、肝、肿瘤等)的凋亡反应[24]。本试验结果显示,鱼藤酮可抑制AKT/mTOR信号通路,并激活JNK信号;同时发现杞归八味口服液可减弱鱼藤酮对AKT/mTOR通路的抑制及对JNK的激活作用,表明杞归八味口服液通过AKT/mTOR及JNK途径保护了PC12细胞。
综上所述,杞归八味口服液可减轻鱼藤酮对PC12细胞的损伤作用,可能与其减弱了鱼藤酮对AKT/mTOR及JNK信号通路的影响有关。由于杞归八味口服液成分复杂,其发挥神经保护作用的具体物质基础(有效单体化合物)还有待进一步研究。

