萝卜紫红叶色突变体的色素含量及光合特性研究
蒲全明, 杨鹏*, 雍磊, 邓榆川, 何自涵,林邦民*, 施松梅, 向承勇, 方芳
(1.南充市农业科学院, 四川 南充 637000; 2.西南大学资源环境学院, 重庆 400716)
叶色突变作为植物界中比较常见的突变性状,其发生频率相对较高,多由自然突变、插入突变、物理化学诱变等原因引起[1]。叶色突变体被广泛用于植物光合系统[2-3]、色素合成[4-6]、抗病机制[5]及遗传发育调控机制[7-8]等方面的研究,也可被作为标记性状用于辅助育种及杂交种子的生产[9-10],是研究植物叶片色彩变异形成机制、分析鉴定基因功能与创制优异种质的理想材料。
目前,已在水稻[11]、玉米[12]、大豆[13]、小麦[14]、棉花[15]等大田作物和辣椒[16]、番茄[17]、黄瓜[18]、甘蓝[19]等蔬菜作物中发现了特征显著的叶色突变体。其中,水稻与玉米的叶色突变体超过410个[20-21],而辣椒、黄瓜、甘蓝、番茄等蔬菜作物的叶色突变体则不超过60个[16-19],已报道的大田作物叶色突变体数量远高于蔬菜作物。相较于以上植物,萝卜作为重要的蔬菜作物,其有关叶色突变体的研究鲜有报道。本研究以野生型绿叶萝卜Ra9为对照,以诱变获得的萝卜紫红叶色突变体mu17为材料,在对突变体植物学性状进行观测的同时,测定其光合特性和色素含量,并采用透射电镜观察了叶绿体结构,采用qRT-PCR检测了萝卜叶片花青素代谢与调控路径相关基因的表达差异,以期探明萝卜叶色突变体在植物学性状、光合特性、光合色素、花青素和叶绿体结构等方面的差异,初步解析萝卜叶片花青素含量变化的分子机制,为后期定位突变基因、研究基因功能及育种应用奠定基础。
1 材料与方法
1.1 试验材料
植物材料为胭脂萝卜自交系Ra9(WT),由南充市农业科学院通过提纯地方胭脂萝卜品种获得。萝卜紫红叶色突变体mu17为Ra9经化学诱变剂EMS处理后获得,经多代自交形成稳定遗传的自交系。2019年10月8日,在四川省南充市农业科学院试验基地(北纬30°75′,东经106°26′)将萝卜突变体及其野生型品系于自然条件下播种,各3畦,常规田间管理。
1.2 植物学性状统计
于播种后45、60、75 d时,分别取野生型Ra9与突变体mu17植株各6株,测定株高、株幅等性状。
1.3 叶片色素含量测定
萝卜叶片叶绿素及类胡萝卜素含量的测定方法:在萝卜材料播种后45、60、75 d时,由内向外取第4片基生叶的0.5 g叶片鲜样,经80%丙酮研磨后,黑暗条件下浸提24 h,定容至10 mL;测定470、645、663 nm处的吸光值,并参照李合生[22]的方法计算叶绿素a、叶绿素b、类胡萝卜素和叶绿素总量。
萝卜叶片花青素的含量按Gou等[23]的方法进行测定。在萝卜材料播种后45、60、75 d时,由内向外取第4片基生叶的1 g叶片鲜样,粉碎后,加入花青素萃取剂(含5%HCl的80%甲醇)4 mL,于4 ℃条件下浸提过夜;于530、620、650 nm波长下测定吸光值。
花青素光密度值(ODλ)计算公式如下。
ODλ=(OD530-OD620)-0.1 × (OD650-OD620)
(1)

(2)
式中,ε为花青素的摩尔消光系数,4.62×106;V为提取液总体积,mL;m为取样质量,g。
1.4 光合速率测定
在萝卜播种后50 d左右,采用便携式光合作用测量系统(LI-6400XT,Portable Photosynthesis System,USA)于晴朗无风的上午9:00—11:00测定萝卜叶片的光合速率。每个材料随机选择5株,取由内向外第4片基生叶,使用开放气路测定叶片的净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci)及蒸腾效率(transpiration rate,Tr)。
1.5 透射电镜观察叶绿体
在萝卜播种后50 d左右,取突变体mu17与野生型对照Ra9植株由内到外的第3片基生叶,用锋利小刀切成大小约为0.5 cm2小块,置于3%戊二醛固定液中预固定,经1%四氧化锇再固定。经丙酮逐级梯度脱水后,将样品先后经过脱水剂和环氧树脂渗透液的渗透处理,比例分别为3∶1、1∶1、1∶3,每步30~60 min。将渗透好的样品块放置模具中包埋后,采用超薄切片机(EM UC7,德国Leica)制成约50 nm厚的超薄切片。室温下,先用醋酸铀染色15~20 min,再用枸橼酸铅染色15~20 min;最后用JEM-1400PLUS透射电子显微镜(日本JEOL)观察和拍照。
1.6 花青素代谢及调控路径相关基因的表达分析
以萝卜播种45 d后的由内向外第4片基生叶为材料,参照植物总RNA提取试剂盒(RNAiso Plus,Takara,中国大连)说明书提取RNA;然后,利用MMLV逆转录酶(Takara,中国大连)合成cDNA,稀释至同一浓度,用于基因表达分析。
依据NCBI已公布萝卜RsCHS、RsCHI、RsF3H、RsMYB3、RsMYB4、RsMYB114与bHLH155的碱基序列,利用软件Primer 6.0设计各基因的荧光定量PCR引物(表1);选取RNA聚合酶II基因(RsRPII)作为内参基因[24]。分别以上述cDNA作为模板,用表1中的相应引物,采用TaKaRa SYBR©Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒(宝生物工程有限公司)提供的25 μL反应液体系,通过CFX Manager Software 在荧光定量PCR仪(C1000/CFX96 ,美国Bio-Rad)上进行qRT-PCR反应。反应程序为: 95 ℃预变性30 s;95 ℃变性5 s,退火温度30 s,40个循环。反应结束后采用2-ΔΔCT法计算相对表达量。

表1 荧光定量PCR引物Table 1 Primers for qRT-PCR
1.7 统计分析
采用软件Microsoft Excel 2013进行试验数据的统计分析,通过软件SPSS 13.0对数据进行方差分析及显著性检验。
2 结果与分析
2.1 萝卜叶色突变体mu17的表型及植物学性状
图1显示,与野生型Ra9相比,突变体mu17的子叶边缘、下胚轴及真叶均为紫红色;叶片在整个营养生长期内没有转绿,始终表现为紫红色。在叶片的生长过程中,虽然野生型Ra9与突变体mu17的叶柄均为红色,但突变体mu17的叶脉也表现为红色,而且叶面少刺毛。
除了萝卜叶片的颜色有明显区别外,叶色突变体的生长状况也有一定程度变化。图2结果显示,在45 d时,突变体mu17的株高与株幅分别为野生型Ra9的0.71、0.59倍;在60 d时,突变体mu17的株高与株幅分别为野生型Ra9的0.78、0.64倍;在75 d时,突变体mu17的株高与株幅分别为野生型Ra9的0.70、0.74倍,突变体植株相对野生型更加矮小,叶片也明显变小。由此可见,相比于同一时期的野生型Ra9植株,突变体mu17生长较为缓慢,长势相对更弱,株高与株幅极显著低于野生型对照Ra9。

A:野生型Ra9播种2周的植株形态;B:突变体mu17播种2周的植株形态;C:野生型Ra9播种4周的植株形态;D:突变体mu17播种4周的植株形态。A: Plant morphology of wild type Ra9 after 2 weeks of sowing; B: Plant morphology of mutant mu17 after 2 weeks of sowing; C: Plant morphology of wild type Ra9 after 4 weeks of sowing; D: Plant morphology of mutant mu17 after 4 weeks of sowing.图1 萝卜野生型Ra9与突变体mu17的形态特征Fig.1 Morphological characteristics of wild type Ra9 and mutant mu17 in radish
2.2 叶片光合特性分析
表2结果表明,mu17的净光合速率(Pn)明显低于野生型,为野生型Ra9的88.82%,差异显著;mu17的气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)均极显著高于野生型,分别高出野生型Ra9的38.89%、33.20%和39.76%。由此推测,可能是紫红叶色突变体mu17的CO2利用率较低,导致其光合速率下降。

表2 萝卜野生型Ra9与突变体mu17的叶片光合参数Table 2 Photosynthetic parameters of wild type Ra9 and mutant mu17 in radish
2.3 叶绿体超微结构的差异分析
图3显示,野生型Ra9的叶绿体紧靠细胞壁分布,形状呈半圆形或纺锤形,类囊体系统分化完全,类囊体堆积紧密,基质、基粒片层分化完全,垛叠较整齐,有淀粉粒;突变体mu17的叶绿体形状不规则,部分基粒结构分化不完全,基质片层分化较好,有淀粉粒。由此可见,突变体mu17的叶绿体结构发生了一定程度的变化,这也可能是突变体光合速率降低,植株生长缓慢的原因之一。
2.4 叶片色素含量差异
2.4.1光合色素含量比较 表3显示了不同时期萝卜叶片光合色素含量。由表3结果可以看出,不同时期紫红叶色突变体mu17中的叶绿素a、叶绿素b和类胡萝卜素含量显著低于野生型对照Ra9的含量。相比于野生型Ra9,播种后45、60、75 d的突变体mu17叶片中叶绿素a含量分别减少了16.28%、18.18%、15.00%,差异均极显著;叶绿素b减少了14.04%、15.25%、12.07%,差异均极显著;类胡萝卜素减少了17.39%、16.00%、8.70%,差异极显著或显著。以上结果说明,突变体mu17的总叶绿素含量低于野生型Ra9,且叶绿素a与叶绿素b的降幅相对较大,这也可能是该突变体材料光合速率下降的原因之一。
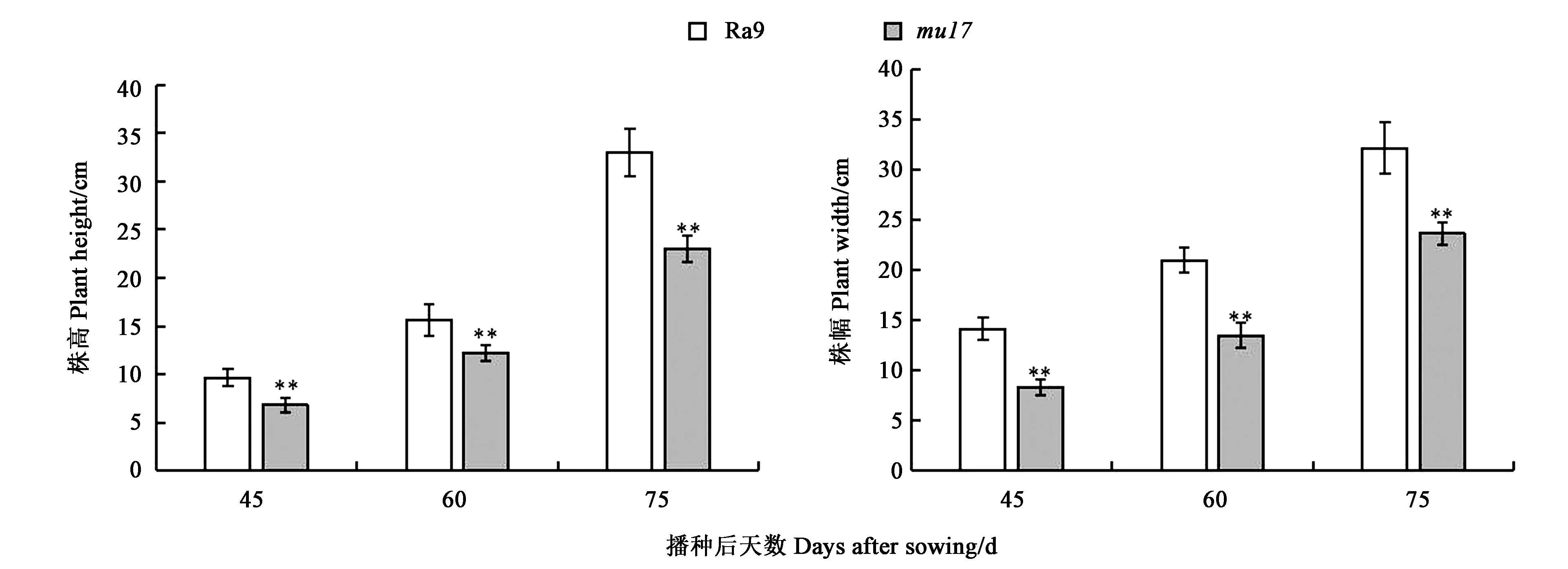
注:**表示在P<0.01水平差异显著。Note: ** indicates significant difference at P<0.01 level.图2 不同时期萝卜野生型Ra9与突变体mu17株高和株幅Fig.2 Plant height and plant width of wild type Ra9 and mutant mu17 in radish at different stages
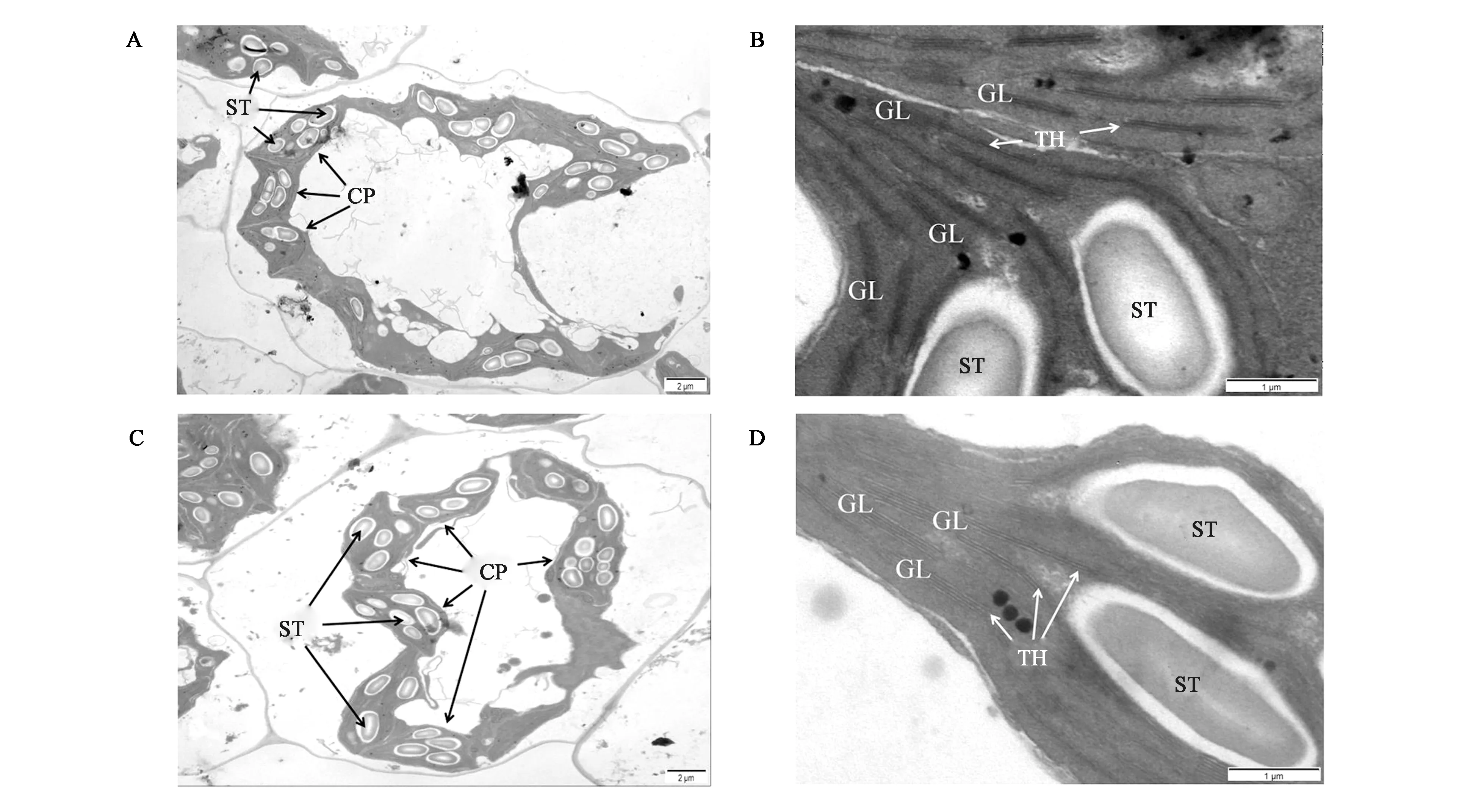
A: 野生型Ra9的叶绿体超微结构(标尺=2 μm);B: 野生型Ra9的叶绿体超微结构(标尺=1 μm);C: 突变体mu17的叶绿体超微结构(标尺=2 μm);D: 突变体mu17的叶绿体超微结构(标尺=1 μm)。CP—叶绿体;ST—淀粉粒;TH—类囊体;GL—基粒片层。A: Chloroplast ultrastructure of wild type Ra9 (Scale bar=2 μm); B: Chloroplast ultrastructure of wild type Ra9 (Scale bar=1 μm); C: Chloroplast ultrastructure of mutant mu17 (Scale bar=2 μm); D: Chloroplast ultrastructure of mutant mu17 (Scale bar=1 μm) ; CP— Chloroplast; ST— Starch granule; TH— Thylakoid; GL— Grana lamellae.图3 萝卜野生型Ra9与突变体mu17的叶绿体超微结构Fig.3 Chloroplast ultrastructure of wild type Ra9 and mutant mu17 in radish
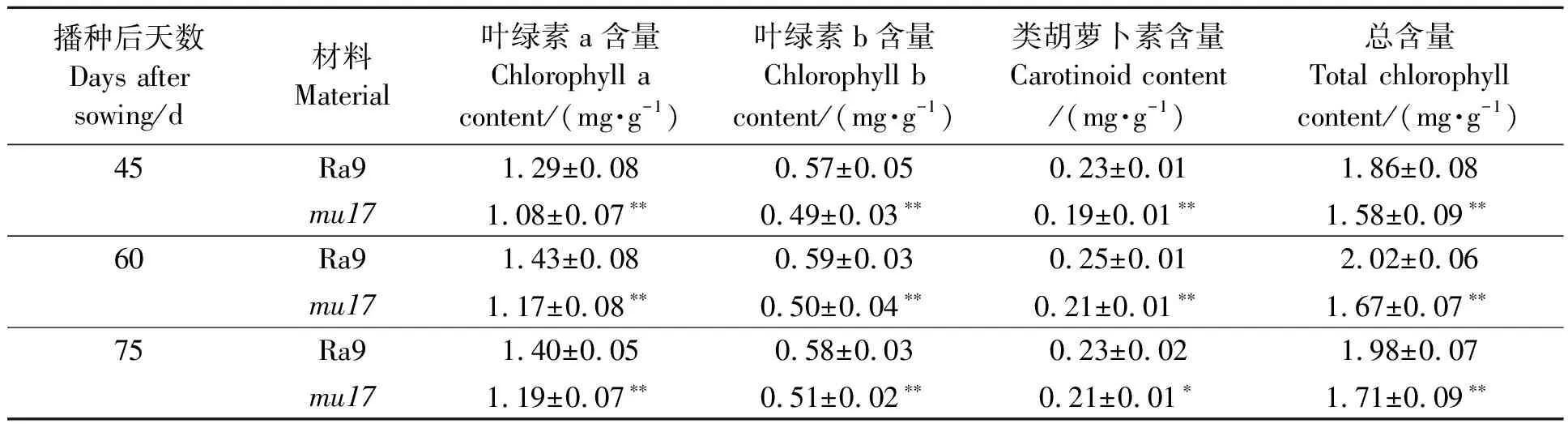
表3 萝卜野生型Ra9与突变体mu17的叶片光合色素含量Table 3 Photosynthetic pigment content in leaf of wild type Ra9 and mutant mu17 in radish
2.4.2花青素含量比较 图4结果表明,紫红叶色突变体mu17的花青素含量明显高于野生型对照Ra9的含量。在播种后45、60、75 d的突变体mu17叶片中花青素含量分别为1.03、1.17、1.34 nmol·g-1,分别是同时期野生型Ra9花青素含量的27、22、25倍,差异极显著。因此,推测突变体材料中花青素含量的明显升高,是造成突变体的叶片表现为紫红色的主要原因。
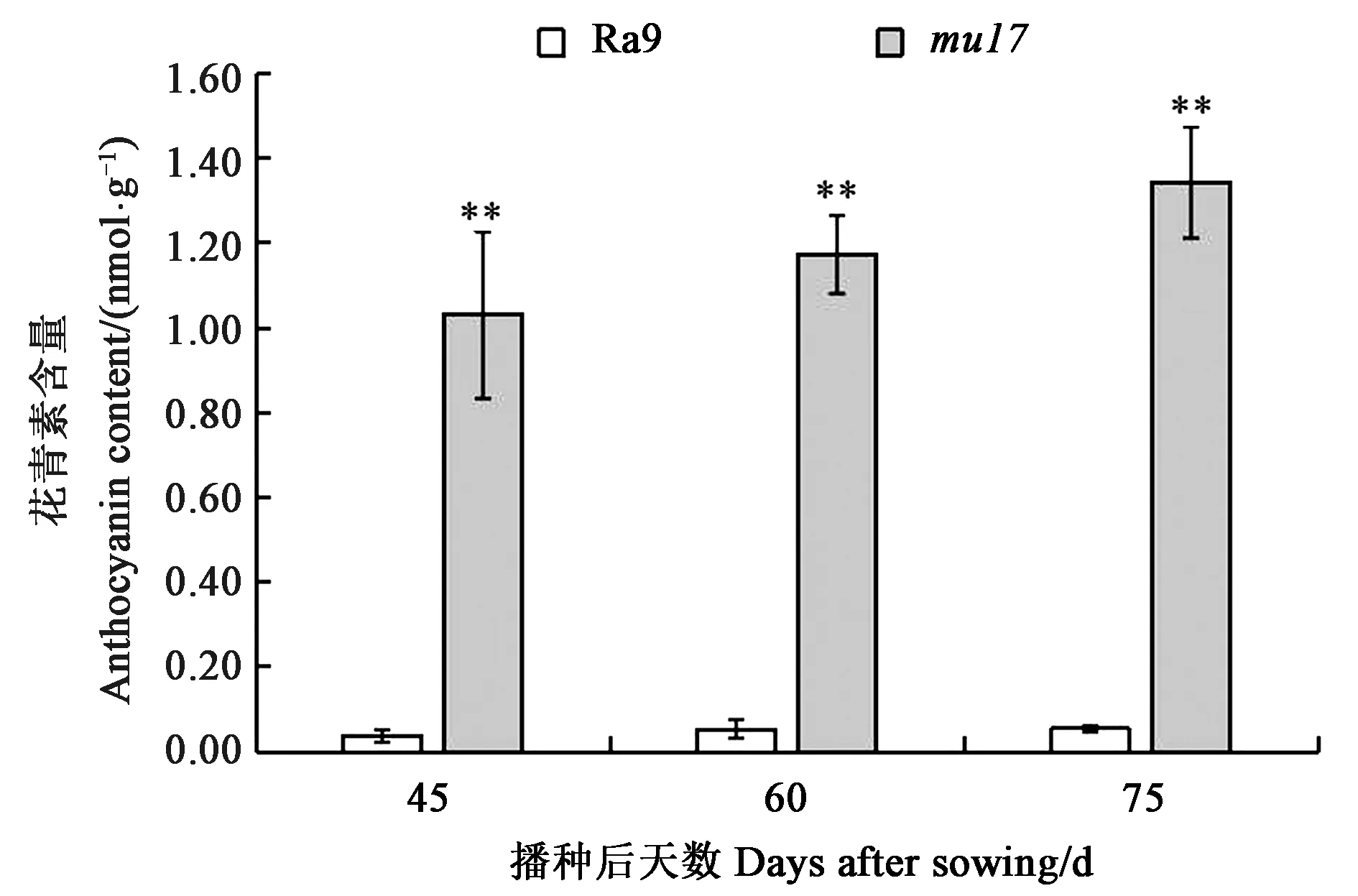
注:**表示与Ra9相比在P<0.01水平差异显著。Note:** indicates significant difference at P<0.01 level compared with Ra9.图4 不同时期萝卜Ra9与突变体mu17的花青素含量比较Fig.4 Comparison of anthocyanin contents between wild type Ra9 and mutant mu17 in radish at different stages
2.5 花青素代谢相关基因的表达水平差异
花青素代谢异常是导致植物叶色变化的重要原因之一。为了进一步探究萝卜突变体叶片花青素积累的可能分子机制,以萝卜突变体mu17及野生型Ra9的叶片为材料,对花青素代谢途径中的结构基因与转录因子进行了荧光定量PCR检测。
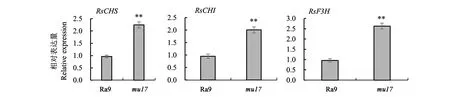
2.5.1结构基因RsCHS、RsCHI、RsF3H的表达分析 图5结果显示,基因RsCHS、RsCHI、RsF3H在紫红叶色突变体mu17叶片中的表达量分别为绿色野生型Ra9叶片的2.33、2.11、2.72倍,上调明显。由此可见,相对于野生型Ra9,紫红叶色突变体mu17叶片中的花青素合成途径相关基因RsCHS、RsCHI、RsF3H均出现不同程度的上调表达。
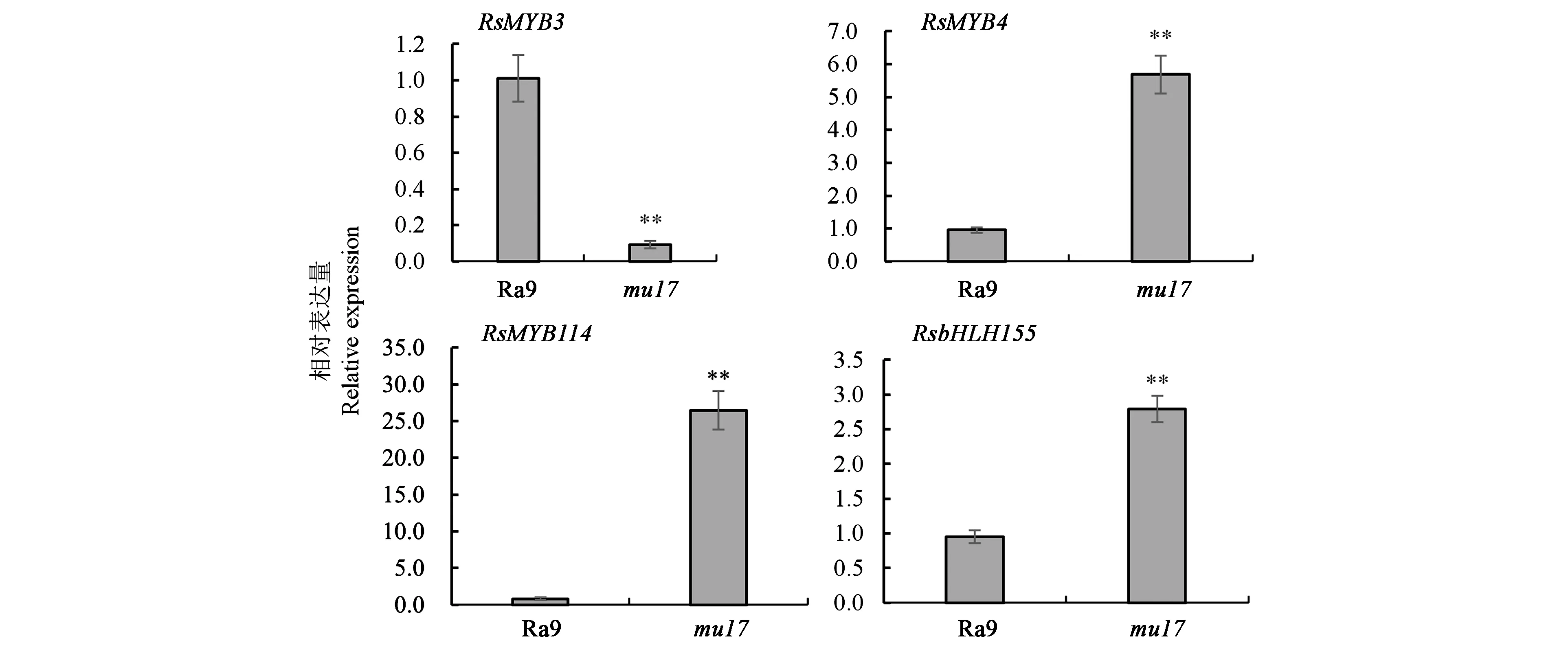
2.5.2转录因子RsMYB3、RsMYB4、RsMYB114、RsbHLH155的表达分析 图6结果表明,基因RsMYB3在突变体mu17叶片中的表达量为绿色野生型Ra9叶片的0.09倍,下调明显;基因RsMYB4、RsMYB114在突变体mu17叶片中的表达量分别为绿色野生型Ra9叶片的5.96、31.75倍,上调显著。基因RsbHLH155在突变体mu17叶片中的表达量为绿色野生型Ra9叶片的2.93倍,上调表达明显。由此可见,相对于野生型Ra9,紫红叶色突变体叶片中可能参与花青素合成调控的MYB家族基因RsMYB3、RsMYB4、RsMYB114与bHLH家族基因RsbHLH155均出现明显表达差异。
3 讨论
3.1 萝卜紫红叶色突变体的表型及生理特性变化
近年来,有关植物叶色突变体的研究越来越多,尤其以水稻[4,20]、玉米[12]、拟南芥[25]、小麦[14]、番茄[8,17]等模式植物中的研究成果最多。研究表明,植物叶绿素代谢紊乱或花青苷代谢异常是叶片颜色突变形成的两大主要因素[16]。其中,叶绿素代谢紊乱通常会导致叶片褪绿现象,出现黄化、白化、黄绿、浅绿、绿黄、绿白、条纹等褪绿突变体[26];花青苷代谢异常会使叶片花青素积累增多或减少,出现紫叶[14,27]、红叶[28-29]等彩叶突变体。本研究通过化学诱变获得一个萝卜突变体mu17,叶片变为紫红色,而且在整个营养生长阶段均表现为紫红色,植株生长较缓慢,这与大多数其他作物叶色突变体生长缓慢的表现一致[1]。
注: **表示与Ra9相比在P<0.01水平差异显著。Note:** indicates significant difference at P<0.01 level compared with Ra9.图5 花青素代谢途径中结构基因的表达分析Fig.5 Expression analysis of structural genes in anthocyanin metabolism pathway
注: **表示与Ra9相比在P<0.01水平差异显著。Note:** indicates significant difference at P<0.01 level compared with Ra9.图6 花青素合成通路中转录因子的表达分析Fig.6 Expression analysis of transcription factors in anthocyanin synthesis pathway
植物体内色素不平衡导致叶片色彩突变的同时,也往往能够引起叶片光合作用的变化[30]。本研究中萝卜紫红叶色突变体mu17的叶片花青素含量明显高于野生型,是野生型花青素含量的15倍以上,这是突变体mu17叶片表现为紫红色的主要原因。有研究表明,花青苷能一定程度缓解强光对叶片产生的破坏,具调节光能的作用[31];但花青苷过量积累会影响叶片对光的吸收,导致植物光合能力下降[32]。萝卜突变体mu17气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)均极显著高于野生型,但净光合速率(Pn)明显低于野生型,这可能与花青素的过量积累导致CO2利用率较低有关。植物叶绿素含量的降低会导致光合作用能力下降,引起植物生长不良[33]。本研究中萝卜叶色突变体mu17的叶绿素含量明显低于野生型Ra9,这可能也是其光合作用能力减弱的原因之一。由此可见,花青素含量的积累和叶绿素含量的降低是萝卜突变体mu17叶色发生变化的主要因素,也是突变体mu17叶片光合作用下降、植株生长缓慢的主要原因。
3.2 萝卜紫红叶色突变体的花青素代谢及调控基因表达水平变化
目前,植物花青素的生物合成代谢途径已被基本阐明,调控花青素合成的分子机制也正在被不断完善。作为各类常见植物花青苷生物合成的共同前体物质,二氢黄烷醇的生物合成受到查尔酮合酶基因CHS、查尔酮异构酶基因CHI、类黄酮3羟化酶基因F3H的控制。有研究发现,在芦笋[34]、马铃薯[35]、扁豆[36]、甘薯[37]、芹菜[38]、铁皮石斛[39]、无花果[40]等作物中,富含花青素品种的CHI、CHS、F3H基因表达水平均远高于普通品种。在十字花科植物中,相较于普通大白菜的白色心叶,紫心大白菜的紫色心叶基因BrCHI、BrCHS、BrF3H的表达量明显上调[41];紫叶芥菜基因BjCHI、BjCHS、BjF3H在紫色子叶与叶片中的表达量明显高于绿叶芥菜[42];萝卜红色肉质根的RsCHI、RsCHS、RsF3H基因表达量明显高于萝卜白色肉质根[43]。本研究中,基因RsCHS、RsCHI、RsF3H在萝卜紫红叶突变体mu17叶片中的表达量分别为绿色野生型Ra9叶片的2.33、2.11、2.72倍,上调表达显著,与前人高花青素植物中基因CHI、CHS、F3H表达量上调的研究结果基本一致,这也说明可能是基因RsCHS、RsCHI、RsF3H的上调表达导致萝卜紫红叶突变体mu17叶片花青素的积累。
花青素生物合成的转录调控因子主要有MYB、bHLH和WDR 3类,各转录因子的表达特征和作用机制各异,且具有物种特异性和多样性[44]。研究表明,转录因子MYB3在蓝莓、金柑花青素生物合成中起重要的负调控作用;NtMYB4a通过调节NtCHI、NtCHS、NtF3H等基因的表达水平正向调控烟草花青素的生物合成[45];MYB114的高表达量会导致梨、草莓与烟草花青素含量的升高[46-47]。本研究中,相比于对照萝卜Ra9的绿色叶片,红紫叶突变体mu17的RsMYB3基因表达量显著下调,RsMYB4、RsMYB114基因表达量明显上调,与上述研究报道结果一致。此外,萝卜紫红叶突变体RsbHLH155基因的表达量明显高于Ra9的绿色叶片。有报道指出,在苹果与拟南芥中,MdbHLH155通过上调花青素合成基因CHI、CHS、F3H等的表达水平,促进花青素的积累[48]。由此,推测RsMYB3、RsMYB4、RsMYB114、RsbHLH155等转录因子通过协同调控萝卜花青素合成相关基因RsCHS、RsCHI、RsF3H等的表达水平升高,促使萝卜紫红叶色突变体花青素大量积累。
叶色突变体为新品种的培育提供了大量优良种质,特异的突变叶色也可作为标记性状简化杂交制种、良种繁育的过程[9-10]。目前,叶色突变体在水稻、玉米、大豆、番茄等作物育种方面进行了广泛发掘与应用。但是,萝卜的叶色遗传资源挖掘甚少,对萝卜叶色突变体的鉴定工作也几乎没有。本研究通过化学诱变获得一个萝卜的彩叶突变体mu17,并从生理水平与分子水平上初步探究了萝卜彩叶突变体的叶色变化机理,为即将开展的突变基因精细定位与图位克隆奠定了良好基础,为改良和培育萝卜新品种提供了理论依据。

